| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 3-4, 2022
|
|
|---|---|---|
| Page(s) | 113 - 123 | |
| DOI | https://doi.org/10.1051/jbio/2022014 | |
| Publié en ligne | 6 février 2023 | |
Article
Comment, au fil du temps, l’ocytocine est devenue l’hormone de l’attachement
How oxytocin became overtime the attachment-mediating hormone
Institut des Neurosciences cellulaires et intégratives, UPR CNRS 3212, Université de Strasbourg, 4, rue Blaise Pascal, 67081 Strasbourg, France
* Auteur correspondant : freundmj@unistra.fr
Reçu :
4
Juillet
2022
L’ocytocine est une molécule pléiotrope qui, en plus de son action facilitatrice au cours de l’accouchement et de l’allaitement, est impliquée dans des comportements sociaux et prosociaux comme l’attachement. Cet article présente, après un bref rappel historique, l’action de l’ocytocine pendant le réflexe d’éjection de lait. L’ocytocine est en effet indispensable à cette fonction vitale chez les mammifères. Elle est à la fois une neurohormone, libérée dans la circulation sanguine par les terminaisons axonales de la post-hypophyse, et un neuromodulateur, libéré dans l’hypothalamus par le soma et les dendrites des neurones magnocellulaires ocytocinergiques. D’autre part, l’ocytocine est également libérée dans le cerveau par les terminaisons axonales des neurones parvocellulaires et des collatérales d’axones des neurones magnocellulaires. La libération centrale de l’ocytocine est à l’origine de ses effets dans l’attachement, qu’il s’agisse de l’attachement maternel comme chez la ratte et la brebis ou de l’attachement entre les partenaires sexuels chez le campagnol des prairies, une des rares espèces de rongeurs monogames. Toutefois, ni l’injection d’ocytocine dans le cerveau, ni l’augmentation de l’expression du récepteur de l’ocytocine dans le noyau accumbens grâce à une technique de transfert de gène, ne rendent monogames des campagnols polygames. La transposition à l’espèce humaine des données obtenues chez l’animal reste problématique en raison principalement de la difficulté à modifier le taux d’ocytocine dans le cerveau.
Abstract
Oxytocin is a pleiotropic molecule which, in addition to its facilitating action during parturition and milk ejection, is involved in social and prosocial behaviors such as attachment. This article presents, after a brief historical review, the action of oxytocin during the milk ejection reflex. Oxytocin is indeed essential for this vital function in mammals. It is both a neurohormone released into the bloodstream by the axon terminals of the posterior pituitary and a neuromodulator released in the hypothalamus by the soma and dendrites of oxytocinergic magnocellular neurons. In addition, oxytocin is also released by the axon terminals of parvocellular neurons and axon collaterals of magnocellular neurons in the brain. Both maternal attachment in rats and ewes and attachment between sexual partners in the prairie vole, one of the few monogamous rodent species, are mediated by central oxytocin. However, neither administering oxytocin into the brain nor increasing expression of the oxytocin receptor in the nucleus accumbens using a gene transfer technique converts polygamous voles to monogamous ones. Unfortunately, translation of animal data to human remains problematic due to still unsolved difficulties in modifying the level of oxytocin in the brain.
Mots clés : ocytocine / éjection de lait / neurohormone / neuromodulateur / attachement maternel / attachement au sein du couple
Key words: oxytocin / milk ejection / neurohormone / neuromodulator / maternal attachment / pair bonding
© Société de Biologie, 2023
Introduction
Depuis le début du 20e siècle, l’ocytocine est connue chez les mammifères pour ses effets pendant la parturition et l’allaitement. À partir des années 2000, cette neurohormone est devenue une molécule incontournable pour tenter d’expliquer de nombreux comportements sociaux et prosociaux comme l’attachement maternel ou entre les partenaires au sein du couple.
L’objectif de cet article est de présenter l’évolution des connaissances et des concepts qui, en un peu plus d’un siècle, ont conduit à considérer l’ocytocine comme l’hormone de l’attachement. Après un bref rappel historique, portant sur l’ocytocine et la neurosécrétion, seront présentés le réflexe d’éjection de lait et son contrôle par l’ocytocine. L’étude de ce réflexe nous a permis de mettre en évidence une des premières actions cérébrales de l’ocytocine, non plus en tant que neurohormone mais comme neuromodulateur. Ces rappels permettront de traiter ensuite le rôle de l’ocytocine dans l’attachement, terme désignant l’étroite relation qui peut exister entre deux individus et qui se caractérise par une proximité physique durable. On abordera ainsi l’attachement maternel et l’attachement au partenaire sexuel chez l’animal. Le rôle de l’ocytocine sera mis en évidence grâce à des études de pharmacologie comportementale, de distribution de ses récepteurs et de génétique. La question cruciale, encore incomplètement résolue à ce jour, de la libération centrale de l’ocytocine à l’origine des effets comportementaux, sera traitée séparément.
Toutes ces données comportementales obtenues chez l’animal sont à l’origine d’un regain d’intérêt pour l’ocytocine. Depuis une vingtaine d’années, le nombre d’articles scientifiques consacrés à l’ocytocine explose littéralement. Le sujet sort du domaine de la neuroendocrinologie pour intéresser plus largement les neurosciences, les sciences comportementales et cognitives. De nombreux médias s’emparent des résultats et en font rapidement la molécule de l’amour. Pour clore cet article, quelques observations concernant l’espèce humaine seront présentées et discutées.
Rappels historiques
L’ocytocine est découverte au début du 20e siècle par un physiologiste britannique, Sir Henry Dale. Il montre que des extraits d’hypophyse, plus précisément du lobe postérieur, sont capables de contracter l’utérus et de provoquer l’éjection de lait. La substance active est alors nommée ocytocine du grec ώκυτής (rapide), τóκoς (naissance). Elle est synthétisée dans des neurones particuliers, les neurones neurosécrétoires, décrits pour la première fois par Ernst et Berta Scharrer en 1928. Ces neurones neurosécrétoires sont de gros neurones, d’où leur nom de magnocellulaires. Leur corps cellulaire se situe dans l’hypothalamus et leur axone se termine au contact des capillaires du lobe postérieur de l’hypophyse. L’observation en microscopie électronique met en évidence la présence de gros granules, d’environ 200 nanomètres de diamètre, dans le corps cellulaire, les dendrites et l’axone des neurones neurosécrétoires. Ces granules ou grains de sécrétion contiennent le matériel sécrétoire.
Ce sont les travaux de Vincent du Vigneaud aux États Unis et de Roger Acher en France qui permettent, au milieu du 20e siècle, de découvrir la nature du matériel neurosécrétoire des neurones magnocellulaires (Du Vigneaud et al., 1953 ; Acher et al., 1956). Il s’agit d’une part de l’ocytocine, responsable de l’éjection de lait et des contractions utérines, et d’autre part de la vasopressine qui agit sur les vaisseaux sanguins (d’où son nom de vasopressine), mais qui est surtout responsable de la réabsorption de l’eau par le rein ; on l’appellera alors l’hormone antidiurétique. L’ocytocine et la vasopressine sont des peptides cycliques de 9 acides aminés, dont 3 forment une chaîne linéaire, les 6 autres constituant un cycle. Seuls 2 acides aminés diffèrent entre l’ocytocine et la vasopressine, l’un dans la chaîne linéaire, l’autre dans le cycle.
À la fin des années 1960, les travaux d’Eric Kandel montrent que les neurones neurosécrétoires présentent les caractéristiques d’authentiques neurones ; ils sont à l’origine d’une activité électrique et émettent des potentiels d’action (Kandel, 1964). Ces potentiels se propagent du corps cellulaire vers l’axone et sont à l’origine de l’exocytose des grains de sécrétion et donc de la libération de l’ocytocine ou de la vasopressine dans la circulation sanguine. Bien que libérées par des neurones suivant des mécanismes dépendants de l’activité électrique, l’ocytocine et la vasopressine ne sont pas des neurotransmetteurs mais des hormones puisqu’elles utilisent la circulation générale pour rejoindre les cellules cibles. C’est parce qu’elles sont synthétisées par des neurones qu’on les qualifie de neurohormones.
Chez les mammifères, les neurones neurosécrétoires ocytocinergiques ou vasopressinergiques sont localisés dans trois noyaux hypothalamiques : le noyau supraoptique, le noyau paraventriculaire et le noyau accessoire constitué de groupes de neurones magnocellulaires situés entre les deux noyaux précédents.
Le réflexe d’éjection de lait et son contrôle
L’une des actions cardinales de l’ocytocine est de provoquer l’éjection de lait. C’est même la seule fonction pour laquelle l’ocytocine est absolument indispensable. De fait, les souris knock-out, qui sont dépourvues d’ocytocine (Nishimori et al., 1996 : Young III W.S. et al., 1996 : Gross et al., 1998), peuvent mettre bas, grâce notamment à l’action des prostaglandines, et produire du lait, grâce à la prolactine. Cependant, le lait reste stocké dans les alvéoles mammaires malgré la tétée des petits, montrant que l’absence d’ocytocine bloque toute possibilité d’éjection de lait.
Chez les mammifères, l’éjection de lait s’effectue grâce à un réflexe neuroendocrinien.
La stimulation mécanique des mamelons lors de la tétée génère une activité nerveuse. Par l’intermédiaire des nerfs mammaires, cette information va rejoindre la moelle épinière, le tronc cérébral et in fine les neurones neurosécrétoires ocytocinergiques dans l’hypothalamus. L’activation de ces neurones entraîne la libération de l’ocytocine dans la circulation sanguine ; la neurohormone va alors atteindre la glande mammaire, induire la contraction des cellules myoépithéliales entourant les alvéoles mammaires, propulsant ainsi le lait vers les canaux galactophores. La partie afférente du réflexe est nerveuse, la partie efférente hormonale.
L’action de l’ocytocine est liée à son interaction avec un récepteur. Jusqu’à ce jour, un seul type de récepteur de l’ocytocine a été décrit, aussi bien dans des tissus périphériques comme la glande mammaire ou l’utérus que dans le système nerveux central, moelle épinière et cerveau (Gimpl & Fahrenholz, 2001). Ce récepteur unique de l’ocytocine est un récepteur à 7 domaines transmembranaires, couplé à une protéine G. Il est caractérisé par une haute affinité pour l’ocytocine, de l’ordre du nanomolaire.
Pendant la tétée des petits, les éjections de lait sont intermittentes. Chez la ratte, l’enregistrement de la pression à l’intérieur d’une glande mammaire, pendant la tétée des autres glandes, met en évidence une succession d’augmentations de la pression intra-mammaire toutes les 5 à 10 minutes (Lincoln et al., 1973). Des éjections de lait intermittentes d’ocytocine ont également été enregistrées chez la femme au rythme moyen de 5 éjections par période de 10 minutes (UvnäsMoberg et al., 2020). Cette intermittence des éjections de lait traduit une libération discontinue d’ocytocine, on parle de libération pulsatile. Chez la femme comme chez la ratte, le niveau plasmatique d’ocytocine passe d’une valeur très faible, de quelques picogrammes/mL avant l’éjection de lait, à une valeur de plusieurs dizaines de picogrammes/mL pendant un pulse d’ocytocine (Meyer et al., 1987 ; UvnäsMoberg et al., 2020).
La libération pulsatile d’ocytocine est directement liée à l’activité électrique des neurones magnocellulaires pendant le réflexe d’éjection de lait. La moitié des neurones qui projettent au lobe postérieur de l’hypophyse présente, en effet, pendant la tétée continue des petits, des bouffées de potentiels d’action ou bursts en anglais. Ces bouffées apparaissent toutes les 5 à 10 minutes ; elles durent 1 à 3 secondes, pendant lesquelles l’activité du neurone peut atteindre plusieurs dizaines de potentiels d’action, et sont suivies quelques secondes plus tard d’une éjection de lait (Figure 1A). L’activité en bouffées de potentiels d’action a été décrite pour la première fois chez la ratte allaitante par John Wakerley & Dennis Lincoln (1973). Ce type d’activité a aussi été mis en évidence, toujours chez la ratte, pendant la mise-bas ; les bouffées sont enregistrées à chaque naissance d’un petit et lors de l’expulsion du placenta (Jiang & Wakerley, 1995). La libération pulsatile d’ocytocine nécessite la synchronisation des bouffées de potentiels d’action de tous les neurones ocytocinergiques dans les trois noyaux hypothalamiques, supraoptique, paraventriculaire et accessoire (Belin et al., 1984 ; Belin & Moos, 1986).
En étudiant le contrôle du réflexe d’éjection de lait, nous avons pu mettre en évidence un rôle primordial de l’ocytocine elle-même sur sa propre libération. Injectée dans le 3e ventricule, l’ocytocine augmente et accélère en effet les bouffées de potentiels d’action des neurones ocytocinergiques (Freund-Mercier & Richard, 1981, 1984). Ces dernières se succèdent toutes les minutes, voire toutes les 30 secondes, et le nombre de potentiels d’action dans une bouffée peut atteindre plus de cent (Figure 1B). La mise en évidence d’un rétrocontrôle positif de l’ocytocine sur sa propre libération fut une découverte importante pour comprendre le contrôle central du réflexe d’éjection de lait en envisageant l’existence d’une libération d’ocytocine dans le cerveau. Une première preuve pharmacologique de l’existence d’une telle libération a été apportée par l’utilisation de molécules antagonistes. De fait, l’injection dans le 3e ventricule d’un antagoniste spécifique du récepteur de l’ocytocine pendant un réflexe bien installé bloque les bouffées de potentiels d’action des neurones ocytocinergiques et les éjections de lait qui leur sont liées. En plus de cette preuve pharmacologique, des techniques de prélèvement du fluide extracellulaire dans l’hypothalamus ont mis en évidence une augmentation des niveaux d’ocytocine juste avant et pendant la tétée des petits (Freund-Mercier et al., 1988 ; Moos et al., 1989). La libération centrale d’ocytocine est donc déterminante pour le bon déroulement du réflexe d’éjection de lait et l’activité en bouffées de potentiels d’action des neurones neurosécrétoires ocytocinergiques.
Pendant le réflexe d’éjection de lait, la libération d’ocytocine dans l’hypothalamus est somato-dendritique. En microscopie électronique, des images classiques d’exocytose des granules neurosécrétoires sont ainsi mises en évidence à la surface membranaire du soma et des dendrites des neurones magnocellulaires ocytocinergiques (Pow & Morris, 1989). Ce type de libération est indépendant de l’activité électrique des neurones ocytocinergiques contrairement à la libération de la neurohormone par les terminaisons axonales post-hypophysaires.
En utilisant la technique d’histo-autoradiographie sur coupes de cerveau, nous avons mis en évidence les récepteurs de l’ocytocine impliqués dans l’action centrale activatrice de l’ocytocine pendant le réflexe d’éjection de lait (Freund-Mercier et al., 1994). Ces récepteurs, marqués par la liaison de l’ocytocine, sont localisés sur les corps cellulaires et les dendrites des neurones magnocellulaires ocytocinergiques (Figure 2). Il s’agit à ma connaissance des premiers auto-récepteurs de peptides mis en évidence.
En conclusion, la libération somato-dendritique d’ocytocine est l’une des premières démonstrations d’une libération centrale de neuropeptide fonctionnellement reliée à un effet physiologique. Au cours du réflexe d’éjection de lait, l’action neurohormonale de l’ocytocine est associée à une action neuromodulatrice centrale du neuropeptide. Progressivement, à l’instar d’autres peptides, l’ocytocine est devenue un neuromédiateur ou plus exactement un neuromodulateur à action centrale impliqué non seulement dans des effets physiologiques mais aussi des effets comportementaux. Parmi les actions centrales de l’ocytocine, celles sur l’attachement, principalement maternel et au sein des couples, sont certainement les mieux documentées.
 |
Figure 1 Activité en bouffées de potentiels d’action d’un neurone neurosécrétoire ocytocinergique pendant l’allaitement chez la ratte (A) et effet facilitateur de l’ocytocine (B). (A) De haut en bas, enregistrements simultanés de la pression intra-mammaire (imp), l’activité unitaire (unit) et l’histogramme de fréquence (rate) en potentiels d’action par seconde d’un neurone ocytocinergique pendant la tétée. Une bouffée de potentiels d’action ou burst, suivie d’une courte période de silence, est enregistrée quelques secondes avant l’augmentation de la pression intra-mammaire, témoin de la libération d’ocytocine. Le chiffre à côté de la bouffée indique le nombre total de potentiels d’action. (B) Évolution de l’activité électrique et des bouffées de potentiels d’action (traits verticaux, PA/seconde) d’un neurone ocytocinergique pendant la tétée avant et après l’injection intra-cérébro-ventriculaire (i.c.v.) de 1 ng d’ocytocine (OT). L’ocytocine augmente l’amplitude des bouffées, c’est-à-dire le nombre total de potentiels d’action et leur fréquence. L’effet dure plus de 40 minutes. D’après Freund-Mercier & Richard (1981). |
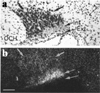 |
Figure 2 Les autorécepteurs somato-dendritiques de l’ocytocine. Détection histo-autoradiographique des sites de liaison de l’ocytocine. Photomicrographies en fond clair (a) et fond noir (b) mettant en évidence les autorécepteurs de l’ocytocine sur une coupe histologique du noyau supraoptique. Le marquage est modéré sur les corps cellulaires de la zone dorsolatérale (flèches) et beaucoup plus intense sur la couche interne (Int) de la zone ventrale, essentiellement constituée de dendrites. OCH : chiasma optique ; la barre blanche horizontale représente 100 μm. D’après Freund-Mercier et al. (1994). |
L’ocytocine et l’attachement chez l’animal
L’attachement maternel
Chez les mammifères, le comportement maternel varie considérablement selon l’espèce. Il fait suite à la gestation et surtout à la parturition et la lactation. Chez l’animal, contrairement à l’humain, il s’estompe dès le sevrage.
Plusieurs modèles animaux ont été utilisés pour mettre en évidence le rôle facilitateur de l’ocytocine dans le comportement maternel ; il s’agit principalement de rongeurs comme la ratte et diverses espèces de campagnols, mais aussi d’herbivores comme la brebis. Les travaux de Pedersen & Prange (1979) sont les premiers à montrer qu’une injection d’ocytocine dans le cerveau chez une ratte vierge traitée par des œstrogènes induit un comportement maternel vis-à-vis de petits nés d’une autre femelle. Chez la brebis, il est possible de mettre en évidence lors de la parturition (Kendrick & Keverne, 1992 ; Da Costa et al., 1996) ou d’une dilatation vaginale (Kendrick et al., 1991 ; Kendrick & Keverne, 1992) une augmentation du niveau d’ocytocine dans le plasma et le liquide céphalorachidien. La stimulation vaginale chez une brebis non parturiente induit en outre le développement d’un comportement maternel vis-à-vis d’un agneau nouveau-né. L’ocytocine exercerait ainsi une action comportementale complémentaire de ses actions physiologiques pendant la parturition et l’allaitement.
Le comportement maternel, et plus précisément l’attachement maternel, a majoritairement été étudié chez la ratte. Le réseau neuronal qui le sous-tend a été décrit par Michael Numan (Numan, 2007 ; Numan & Young, 2016) et les sites et mécanismes d’action de l’ocytocine ont pu être localisés et étudiés (voir l’ouvrage « Ocytocine : entre mythe et réalité », Freund-Mercier, 2022). Un autre modèle animal, le campagnol, a également permis de progresser dans la compréhension des effets de l’ocytocine sur l’attachement, maternel et paternel, ainsi que sur l’attachement des partenaires sexuels dans le couple.
L’attachement au sein du couple
Le modèle du campagnol
Les campagnols sont de petits rongeurs qui vivent en Amérique du Nord. Il en existe plusieurs espèces, certaines vivent dans des prairies (Microtus ochrogaster), d’autres dans des montagnes (Microtus montanus). Alors que leur patrimoine génétique est identique à 99 %, l’analyse comparée de leur comportement met en évidence deux modes de vie différents (Carter, 1992 ; Carter et al., 1995). Le campagnol des prairies forme avec son partenaire, dès le premier accouplement, un couple durable ; dans la nature les couples peuvent ainsi persister plusieurs années. Ce sont des couples « parfaits », dont les deux partenaires s’occupent des petits. De plus, ils entretiennent une forte cohésion sociale avec le reste du groupe. Ainsi, les campagnols des prairies sont rapidement devenus un modèle de rongeur social monogame. Le campagnol des montagnes en revanche ne prête aucune attention à son partenaire une fois l’accouplement terminé. Seule la femelle s’occupe des petits et développe un comportement maternel. Le campagnol des montagnes n’entretient pas de liens sociaux avec ses congénères. Enfin, contrairement au campagnol des prairies, le campagnol des montagnes comme 95 à 97 % des mammifères est un rongeur polygame.
Au laboratoire, ces caractéristiques comportementales différentes subsistent. Alors que le campagnol des prairies passe 50 % de son temps à proximité de ses congénères, le campagnol des montagnes n’y consacre que 5 % (Young et al., 1998).
Les données de la pharmacologie
L’expérience déterminante démontrant un rôle de l’ocytocine dans l’attachement au partenaire a été réalisée chez le campagnol des prairies, l’espèce monogame (Insel & Young, 2001). Les femelles qui ne se sont pas accouplées passent environ 50 % de leur temps avec leur congénère mâle (Figure 3) ; après le premier accouplement, elles vont privilégier le contact avec leur partenaire sexuel avec qui elles passent alors plus de 90 % de leur temps. Les mâles se comportent de la même façon. Chez cette espèce monoagame, l’attachement au partenaire dépend donc de l’accouplement. Or, comme l’accouplement, l’injection intra-cérébrale d’ocytocine chez des femelles n’ayant pas copulé augmente le temps passé auprès du mâle présent au moment de l’injection. Au contraire, chez les femelles ayant copulé, l’injection intra-cérébrale d’un antagoniste spécifique du récepteur de l’ocytocine bloque la préférence pour le partenaire sexuel (Figure 3). Chez les mâles, les résultats sont similaires mais avec la vasopressine et un antagoniste spécifique des récepteurs de type V1a.
Chez le campagnol des prairies, la formation des couples serait donc facilitée par une augmentation du niveau d’ocytocine dans le cerveau au moment de l’accouplement chez la femelle et par celle du niveau de vasopressine chez le mâle. Cette interprétation « dualiste », ocytocine chez la femelle, vasopressine chez le mâle, a cependant été remise en question. La formation des liens entre les partenaires sexuels a en effet été décrite après perfusion centrale aussi bien d’ocytocine que de vasopressine chez le campagnol des prairies mâles (Cho et al., 1999). De plus, une étude récente montre que l’injection d’un antagoniste hautement sélectif du récepteur de l’ocytocine dans le cerveau d’un grand nombre de campagnols des prairies mâles inhibe fortement la préférence pour le partenaire d’accouplement (Johnson et al., 2016).
En conclusion, l’attachement au partenaire chez une espèce monogame, le campagnol des prairies, est étroitement dépendant d’une libération d’ocytocine dans le cerveau au moment de l’accouplement. Même si la mesure directe de cette libération reste délicate (Ross et al., 2009a), en quelques années, l’ocytocine est devenue l’hormone de l’attachement et même de la monogamie.
 |
Figure 3 Effets de l’ocytocine et de la vasopressine sur la préférence pour le partenaire chez le campagnol des prairies. La durée du contact avec le partenaire est mesurée en % de la durée totale de l’expérience chez des femelles et des mâles sans accouplement (colonnes noires) et après accouplement (colonnes blanches). Les femelles passent plus de 50 % de leur temps auprès de leurs congénères et plus de 80 % auprès de leur partenaire d’accouplement ; des résultats équivalents sont obtenus chez les mâles. La préférence pour le partenaire est donc dépendante de l’accouplement. L’injection intra-cérébroventriculaire d’ocytocine (OT) chez des femelles non accouplées augmente le temps passé auprès des mâles présents au moment de l’injection ; inversement l’injection d’un antagoniste spécifique des récepteurs de l’ocytocine (OTA) chez des femelles qui se sont accouplées réduit considérablement le temps passé auprès du partenaire d’accouplement. Des résultats équivalents sont obtenus chez les mâles avec la vasopressine (AVP) et un antagoniste spécifique des récepteurs de type V1a (V1a antagonist). D’après Young et al. (1998). |
La distribution des récepteurs
Les effets de l’ocytocine s’exercent par l’intermédiaire d’un seul type de récepteur. Il existe en revanche deux grands types de récepteurs pour la vasopressine, le récepteur V2 dont l’activation est responsable de la réabsorption de l’eau au niveau du néphron et le récepteur V1 subdivisé en deux sous-types V1a et V1b. Dans le cerveau, le sous-type V1a est pratiquement le seul type mis en évidence.
L’autoradiographie sur film permet de visualiser les récepteurs de l’ocytocine et de la vasopressine à partir de coupes de cerveau (Figure 4). Chez le campagnol des prairies, espèce monogame biparentale, qu’il s’agisse du mâle ou de la femelle, le récepteur de l’ocytocine est fortement exprimé dans le noyau accumbens et le caudé-putamen ; ce n’est pas le cas chez le campagnol des montagnes, espèce polygame monoparentale. Chez le campagnol des montagnes, le récepteur de la vasopressine de type V1a est fortement exprimé dans le septum latéral, alors que chez le campagnol des prairies, il est présent dans le pallidum ventral (Insel & Shapiro, 1992 ; Lim et al., 2004). La distribution différente des récepteurs de l’ocytocine et de la vasopressine entre les campagnols des prairies et les campagnols des montagnes est-elle en lien avec la monogamie ?
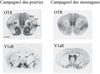 |
Figure 4 Distribution cérébrale des récepteurs de l’ocytocine et de la vasopressine chez le campagnol des prairies monogame et le campagnol des montagnes polygame. Films autoradiographiques générés à partir de coupes frontales de cerveau mettant en évidence les sites de liaison de l’ocytocine (OTR) et de la vasopressine de type V1a (V1aR). Le récepteur de l’ocytocine est exprimé dans le cortex préfrontal (PFC), le noyau accumbens (NAcc) et le caudé-putamen (CP) chez le campagnol des prairies ; mais uniquement dans le cortex préfrontal chez le campagnol des montagnes. Le récepteur de la vasopressine de type V1a est majoritairement exprimé dans le pallidum ventral (VP) chez le campagnol des prairies et dans le septum latéral (LS) chez le campagnol des montagnes. La barre horizontale représente 1 mm. D’après Young & Wang (2004). |
Les données de la génétique
L’analyse de la région codante du gène du récepteur de l’ocytocine révèle 99 % d’homologie entre le campagnol des prairies et le campagnol des montagnes (Young L.J. et al., 1996). L’expression génique spécifique d’un tissu est généralement considérée comme dirigée par des éléments régulateurs situés dans les régions non codantes du gène. L’analyse de ces séquences pour le gène du récepteur de l’ocytocine montre qu’elles n’influencent pas la densité des récepteurs d’une manière spécifique à la région (King et al., 2016). Elles contribueraient à expliquer les variations individuelles au sein d’une même espèce plutôt que les différences comportementales observées entre les espèces monogames et polygames.
Le gène du récepteur de la vasopressine présente en revanche en amont du site de transcription des séquences répétitives de 1 à 4 nucléotides, appelées microsatellites. Ces répétions sont très étendues (environ 500 paires de bases) chez le campagnol des prairies, espèce monogame, mais elles sont minimes chez le campagnol des montagnes, espèce polygame ; elles pourraient ainsi contribuer à l’évolution de la monogamie (Young et al., 1999 ; Young & Wang, 2004).
Les techniques actuelles de transfert de gène utilisant des virus adéno-associés et l’ARN interférent permettent d’exprimer ou de surexprimer, mais aussi de réduire, l’expression d’un gène dans une région cérébrale donnée. L’expression du récepteur de la vasopressine de type V1a du campagnol des prairies dans le pallidum ventral d’un campagnol polygame augmente chez ce dernier le temps passé auprès de son partenaire d’accouplement d’une vingtaine de minutes à quarante minutes (Figure 5A). Inversement, la réduction de l’expression du récepteur de la vasopressine dans le pallidum ventral chez le campagnol des prairies réduit significativement sa préférence pour le partenaire sexuel (Figure 5B) (Donaldson & Young, 2008 ; Barrett et al., 2013).
Ces expériences sont importantes car elles démontrent pour la première fois l’existence d’une relation causale entre l’expression, dans le pallidum ventral, du récepteur de la vasopressine de type V1a présentant des microsatellites longs (caractéristique de l’espèce monogame) et le comportement d’attachement au partenaire. Il est à noter que dans ces deux expériences le comportement parental des campagnols n’a jamais été modifié.
Les résultats obtenus avec le récepteur de l’ocytocine ne sont pas aussi convaincants (Figure 6). Chez le campagnol des prairies femelle, la surexpression du récepteur de l’ocytocine dans le noyau accumbens (où il est fortement exprimé) accroît le temps passé avec le partenaire de 80 à plus de 100 minutes (Ross et al., 2009b). Comme pour le récepteur de la vasopressine chez le mâle, il semble donc bien exister une relation causale entre l’expression du récepteur de l’ocytocine et l’attachement. Toutefois, il est impossible de transformer un campagnol polygame en monogame en induisant expérimentalement l’expression du récepteur de l’ocytocine dans son noyau accumbens (Figure 6).
 |
Figure 5 Mise en évidence d’une relation causale entre la présence des récepteurs de la vasopressine et la préférence pour le partenaire chez le campagnol. (A) La durée de contact avec le partenaire sexuel du campagnol polygame augmente significativement après surexpression dans le pallidum ventral du récepteur de la vasopressine de type V1a (V1aR) du campagnol des prairies, monogame. Le transfert de gène a été réalisé avec un vecteur de type AAV (virus adéno-associé). D’après Donaldson & Young (2008). (B) La durée de contact avec le partenaire sexuel du campagnol des prairies, monogame, diminue significativement lorsqu’on réduit l’expression du récepteur de la vasopressine de type V1a (V1aR) par l’administration d’un ARN interférent (iARN) dans son pallidum ventral. D’après Barrett et al. (2013). |
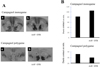 |
Figure 6 L’expression du récepteur de l’ocytocine dans le noyau accumbens chez le campagnol polygame est sans effet sur la préférence pour le partenaire. (A) Films autoradiographiques générés à partir de coupes frontales de cerveau mettant en évidence les sites de liaison de l’ocytocine chez un campagnol monogame et un campagnol polygame ; (a) condition contrôle ; (b) surexpression du récepteur de l’ocytocine (OTR) dans le noyau accumbens (NAcc). Le transfert de gène a été réalisé avec un vecteur de type AAV (virus adéno-associé). (B) Chez le campagnol monogame, la durée de contact avec le partenaire sexuel est augmentée après surexpression du récepteur de l’ocytocine dans le noyau accumbens (AAV OTR), ce qui n’est pas le cas chez le campagnol polygame. D’après Ross et al. (2009b). |
Les libérations cérébrales d’ocytocine
Chez l’animal, l’ocytocine cérébrale, en tant que neuromodulateur (et non en tant que neurohormone), est un facteur facilitant du comportement d’attachement maternel et au partenaire sexuel. Toutefois, si les sites d’action du neuropeptide semblent bien établis, ses sites et ses mécanismes de libération sont encore à l’étude.
Il convient de rappeler que l’ocytocine, comme tous les peptides hydrophiles, ne peut pas accéder au système nerveux central en raison de l’existence de la barrière hémato-encéphalique. On estime que, chez le rat, seulement 0,002 % de l’ocytocine injectée par voie sous-cutanée atteint le cerveau (Mens et al., 1983). L’ocytocine-neurohormone est libérée par les neurones neurosécrétoires au contact des capillaires du lobe postérieur de l’hypophyse en dehors de la barrière. Le taux d’ocytocine dans le sang est faible, entre 1 et 10 pg/mL dans les conditions basales car la demi-vie du peptide est courte, de 2 à 3 minutes. Dans le cerveau, le taux d’ocytocine dans le système ventriculaire et le fluide extracellulaire est plus élevé que dans le sang, entre 10 et 100 pg/mL, et la demi-vie du peptide est de 20 minutes. Ces chiffres, quasiment les mêmes chez le rat et dans l’espèce humaine, sont en faveur d’une absence de corrélation entre les niveaux d’ocytocine dans le sang et ceux du liquide céphalo-rachidien.
Trois mécanismes de libération d’ocytocine coexistent pour rendre compte du taux d’ocytocine dans le cerveau : (i) la libération somato-dendritique des neurones neurosécrétoires, mise en évidence au cours du réflexe d’éjection de lait ; (ii) la libération axonale des neurones parvocellulaires du noyau paraventriculaire (voir dans ce volume l’introduction d’André Calas) et (iii) la libération axonale par des collatérales d’axones des neurones neurosécrétoires, récemment démontrée (voir dans ce volume l’article d’Alexandre Charlet). L’ocytocine ainsi libérée diffuse dans le parenchyme cérébral suivant un mode de transmission volumique. Le récepteur de l’ocytocine, caractérisé par une haute affinité de l’ordre du nanomolaire, pourra être activé par ce mode de transmission diffuse, même loin du site de libération.
Les techniques d’optogénétique permettent de stimuler sélectivement et à distance des populations précises de neurones et d’en rechercher les conséquences physiologiques et comportementales. Ainsi, l’activation optogénétique des terminaisons axonales ocytocinergiques dans le noyau central de l’amygdale entraîne une réduction du comportement de peur (Knobloch et al., 2012) et d’anxiété (voir dans ce volume l’article d’Alexandre Charlet). Concernant les effets de l’ocytocine centrale dans l’attachement maternel et au partenaire sexuel, aucune étude en optogénétique n’a encore été réalisée pour connaître précisément la nature des neurones ocytocinergiques, magno- ou parvocellulaires, ainsi que le type de libération, somato-dendritique ou axonale, impliqués.
L’extrapolation à l’espèce humaine
Pourquoi, après toutes les recherches sur les modèles animaux, est-il toujours aussi difficile d’extrapoler à l’espèce humaine ? Plusieurs points posent problèmes. Comment administrer l’ocytocine chez l’Homme, sachant qu’elle ne passe pas la barrière hémato-encéphalique et que toute injection intra-cérébrale est impossible ? Comment évaluer l’attachement ? Le temps passé auprès de son partenaire ou de son enfant est loin d’être représentatif. Enfin, l’impossibilité de mesurer l’ocytocine cérébrale explique en grande partie le nombre croissant de publications ayant recours à la mesure de l’ocytocine plasmatique. Le taux d’ocytocine plasmatique est-il un bon marqueur pour étudier le rôle de l’ocytocine dans l’attachement ? Les exemples suivants sont loin de représenter le grand nombre d’articles publiés sur le sujet. Ils ont surtout pour objectif d’apporter quelques réponses aux questions posées ci-dessus.
Le spray intra-nasal d’ocytocine
Le spray intra-nasal a été utilisé à la fin des années 1950 en gynécologie. Le but était de faciliter les contractions utérines au moment de l’accouchement et de favoriser l’éjection de lait. Cette pratique a rapidement été abandonnée car la dose délivrée est difficile à contrôler et les effets ne sont obtenus qu’avec des doses importantes, 150 fois la dose injectée par voie intra-veineuse. L’utilisation de spray d’ocytocine a repris au tournant des années 2000, non plus dans la pratique médicale mais dans la recherche pour mimer une action centrale de l’ocytocine et rechercher d’éventuels effets comportementaux. La voie d’accès de l’ocytocine serait une voie dite directe par le biais des espaces situés le long des fibres olfactives et des autres nerfs crâniens (Veening & Olivier, 2013 ; Quintana et al., 2021). Les quantités qui parviennent au cerveau sont très faibles, ce qui explique les fortes doses utilisées, majoritairement 24 et 40 UI soit plusieurs fois le contenu de l’hypophyse. La plus grande partie de l’ocytocine inhalée se retrouve en fait dans la circulation sanguine périphérique et peut induire des effets non recherchés.
L’évaluation indirecte de l’attachement par la mesure d’une variable sociologique
La distance sociale est définie par les sociologues comme la distance minimale que maintiennent entre elles deux personnes lorsqu’elles se rencontrent ; elle est estimée à 55 cm. L’expérience réalisée par Scheele et al. (2012) consiste à faire se rencontrer une jolie femme avec un homme jeune, hétérosexuel, célibataire ou vivant en couple. Dans ces conditions, la distance sociale de 55 cm est confirmée. Les hommes vivant en couple et ayant reçu un spray intra-nasal d’ocytocine prennent en revanche une marge supplémentaire d’environ 15 cm. L’ocytocine renforcerait ainsi la fidélité des hommes vivant en couple en régulant le comportement d’approche avec une personne étrangère.
La mesure de l’attachement par le taux d’ocytocine plasmatique
Le taux d’ocytocine plasmatique est deux fois plus élevé chez les nouveaux amoureux que chez les hommes et les femmes célibataires (Figure 7A) (Schneiderman et al., 2012). Six mois plus tard, il est toujours élevé chez les couples qui sont restés ensemble mais un peu moins chez ceux qui se sont séparés (Figure 7B). Il est intéressant de souligner que dans ce cas le taux d’ocytocine plasmatique n’est pas revenu au niveau de celui des célibataires. Comment expliquer ce phénomène ? Une étude parallèle, menée dans le même laboratoire mais réalisée chez des mères et des pères au 2e et au 6e mois après la naissance de leur 1er enfant, montre que le taux d’ocytocine plasmatique est plus élevé que celui mesuré précédemment chez les célibataires, mais moins élevé que chez les nouveaux amoureux et chez les couples séparés (Feldman et al., 2010, 2011). Peut-on conclure de ces données que l’ocytocine est l’hormone de l’attachement chez l’humain ? Les avis sont très partagés.
 |
Figure 7 Taux d’ocytocine plasmatique dans différentes conditions d’attachement amoureux chez l’humain. Les taux d’ocytocine plasmatique sont mesurés chez des hommes (colonnes grisées noires) et des femmes (colonnes grisées blanches). (A) célibataires et nouveaux amoureux (2 tests). (B) au bout de 6 mois chez les couples restés unis et chez les couples séparés. D’après Schneiderman et al. (2012). |
Les stimulations à l’origine d’une augmentation du taux plasmatique d’ocytocine
L’ocytocine-neurohormone est libérée pendant la parturition et l’allaitement. Au regard de la demi-vie très courte de l’ocytocine, 1 à 2 minutes, les libérations sont des libérations pulsatiles. En dehors de ces deux états physiologiques, de très nombreuses situations semblent entraîner la libération d’ocytocine dans la circulation sanguine. Ces données font régulièrement les gros titres des journaux ; l’ocytocine est ainsi libérée pendant les caresses, les massages, le son de la voix aimée, l’exercice physique, la méditation etc. L’ocytocine a ainsi acquis le titre d’hormone du bien-être et de l’attachement, « calm and connection » (Uvnäs-Moberg et al., 2015). Une expérience mérite cependant d’être rapportée (Bello et al., 2008) : chez des hommes âgés de 19 à 45 ans, le taux d’ocytocine plasmatique augmente significativement 15 et 30 minutes après le début d’une séance de massage de 20 minutes (Figure 8) confirmant la libération d’ocytocine dans la circulation sanguine lors d’un épisode de calme ; toutefois, le même résultat est obtenu après 20 minutes de lecture du bulletin national de géographie des USA. Que faut-il en conclure ? La lecture du bulletin national de géographie est-elle une situation de calme et de bien-être ? ou bien faut-il remettre en question l’interprétation de ces observations ? Il semble en tout cas peu probable que l’ocytocine plasmatique soit un bon biomarqueur de l’ocytocine cérébrale, la seule impliquée dans les effets comportementaux.
 |
Figure 8 Taux d’ocytocine plasmatique chez des hommes dans deux situations différentes. Les mesures sont effectuées avant, puis 15 et 30 minutes après une séance de massage de 20 minutes (colonnes noires) ou de lecture du bulletin national de géographie des USA (colonnes grises). D’après Bello et al. (2008). |
Conclusion
À partir des nombreuses études réalisées chez l’animal, il est possible de comprendre pourquoi l’ocytocine est devenue au fil du temps l’hormone de l’attachement. Il faut cependant garder à l’esprit que d’une part, ce n’est pas l’hormone mais bien le neuromédiateur ou plus exactement le neuromodulateur qui est responsable des effets comportementaux, et d’autre part que l’ocytocine n’agit pas seule, la vasopressine et la dopamine par exemple sont étroitement liées aux effets centraux de l’ocytocine. Chez l’humain, l’absence de données expérimentales rigoureuses laisse la place à toutes les hypothèses. Des perspectives à court terme existent ; elles concernent surtout le développement de molécules analogues de l’ocytocine franchissant la barrière hémato-encéphalique. Ces perspectives sont présentées dans ce volume dans l’article de Marcel Hibert.
Références
- Acher, R., Chauvet, J., Olivry, G. (1956). Sur l’existence éventuelle d’une hormone unique neurohypophysaire I. Relations entre l’ocytocine, la vasopressine et la protéine de van Dyke extraites de la neurohypophyse du boeuf. Biochim Biophys Acta, 22, 421-427. [CrossRef] [PubMed] [Google Scholar]
- Barrett, C.E., Keebaugh, A.C., Ahern, T.H., Bass, C.E., Terwilliger, E.F., Young, L.J. (2013). Variation in vasopressin receptor (Avpr1a) expression creates diversity in behaviors related to monogamy in prairie voles. Horm Behav, 63, 518-526. [CrossRef] [PubMed] [Google Scholar]
- Belin, V., Moos, F. (1986). Paired recordings from supraoptic and paraventricular oxytocin cells in suckled rats: recruitment and synchronization. J Physiol, 377, 369-390. [CrossRef] [PubMed] [Google Scholar]
- Belin, V., Moos, F., Richard, P. (1984). Synchronization of oxytocin cells in the hypothalamic paraventricular and supraoptic nuclei in suckled rats: direct proof with paired extracellular recordings. Exp Brain Res, 57, 201-203. [CrossRef] [PubMed] [Google Scholar]
- Bello, D., White-Traut, R., Schwertz, D., Pournajafi-Nazarloo, H., Carter, C.S. (2008). An exploratory study of neurohormonal responses of healthy men to massage. J Altern Complement Med, 14, 387-394. [CrossRef] [PubMed] [Google Scholar]
- Carter, C.S. (1992). Oxytocin and sexual behavior. Neurosci Biobehav Rev, 16, 131-144. [CrossRef] [MathSciNet] [Google Scholar]
- Carter, C.S., DeVries, A.C., Getz, L.L. (1995). Physiological substrates of mammalian monogamy: the prairie vole model. Neurosci Biobehav Rev, 19, 303-314. [CrossRef] [PubMed] [Google Scholar]
- Cho, M.M., DeVries, A.C., Williams, J.R., Carter, C.S. (1999). The effects of oxytocin and vasopressin on partner preferences in male and female prairie voles (Microtus ochrogaster). Behav Neurosci, 113, 1071-1079. [CrossRef] [PubMed] [Google Scholar]
- Da Costa, A.P.C., Guevara-Guzman, R.G., Ohkura, S., Goode, J.A., Kendrick, K.M. (1996). The role of oxytocin release in the paraventricular nucleus in the control of maternal behaviour in the sheep. J Neuroendocrinol, 8, 163-177. [CrossRef] [PubMed] [Google Scholar]
- Donaldson, Z.R., Young, L.J. (2008). Oxytocin, vasopressin, and the neurogenetics of sociality. Science, 322, 900-904. [CrossRef] [PubMed] [Google Scholar]
- Du Vigneaud, V., Ressler, C., Trippett, S. (1953). The sequence of amino acids in oxytocin, with a proposal for the structure of oxytocin. J Biol Chem, 205, 949-957. [CrossRef] [PubMed] [Google Scholar]
- Feldman, R., Gordon, I., Schneiderman, I., Weisman, O., Zagoory-Sharon, O. (2010). Natural variations in maternal and paternal care are associated with systematic changes in oxytocin following parent-infant contact. Psychoneuroendocrinology, 35, 1133-1141. [CrossRef] [PubMed] [Google Scholar]
- Feldman, R., Gordon, I., Zagoory-Sharon, O. (2011). Maternal and paternal plasma, salivary, and urinary oxytocin and parent-infant synchrony: considering stress and affiliation components of human bonding: Oxytocin and parent-infant synchrony. Dev Sci, 14, 752-761. [CrossRef] [PubMed] [Google Scholar]
- Freund-Mercier, M.J. (2022). Ocytocine : entre mythe et réalité. Boin/John Libbey Eds, pp. 81-104. [Google Scholar]
- Freund-Mercier, M.J., Richard, P. (1981). Excitatory effects of intra-ventricular injections of oxytocin on the milk ejection reflex in the rat. Neurosci Lett, 23, 193-198. [CrossRef] [PubMed] [Google Scholar]
- Freund-Mercier, M.J., Richard, P. (1984). Electrophysiological evidence for facilitatory control of oxytocin neurones by oxytocin during suckling in the rat. J Physiol, 352, 447-466. [CrossRef] [PubMed] [Google Scholar]
- Freund-Mercier, M.J., Moos, F., Poulain, D.A., Richard, P., Rodriguez, F., Theodosis, D.T., Vincent, J.D. (1988). Role of central oxytocin in the control of the milk ejection reflex. Brain Res Bull, 20, 737-741. [CrossRef] [PubMed] [Google Scholar]
- Freund-Mercier, M.J., Stoeckel, M.E., Klein, M.J. (1994). Oxytocin receptors on oxytocin neurones: histoautoradiographic detection in the lactating rat. J Physiol, 480, 155-161. [CrossRef] [PubMed] [Google Scholar]
- Gimpl, G., Fahrenholz, F. (2001). The Oxytocin receptor system: Structure, function, and regulation. Physiol Rev, 81, 629-683. [CrossRef] [PubMed] [Google Scholar]
- Gross, G.A., Imamura, T., Luedke, C., Vogt, S.K., Olson, L.M., Nelson, D.M., Sadovsky, Y., Muglia, L.J. (1998). Opposing actions of prostaglandins and oxytocin determine the onset of murine labor. Proc Natl Acad Sci USA, 95, 11875-11879. [CrossRef] [PubMed] [Google Scholar]
- Insel, T.R., Shapiro, L.E. (1992). Oxytocin receptor distribution reflects social organization in monogamous and polygamous voles. Proc Natl Acad Sci USA, 89, 5981-5985. [CrossRef] [PubMed] [Google Scholar]
- Insel, T.R., Young, L.J. (2001). The neurobiology of attachment. Nat Rev Neurosci, 2, 129-136. [CrossRef] [PubMed] [Google Scholar]
- Jiang, Q.B., Wakerley, J.B. (1995). Analysis of bursting responses of oxytocin neurones in the rat in late pregnancy, lactation and after weaning. J Physiol, 486, 237-248. [CrossRef] [PubMed] [Google Scholar]
- Johnson, Z.V., Walum, H., Jamal, Y.A., Xiao, Y., Keebaugh, A.C., Inoue, K., Young, L.J. (2016). Central oxytocin receptors mediate mating-induced partner preferences and enhance correlated activation across forebrain nuclei in male prairie voles. Horm Behav, 79, 8-17. [CrossRef] [PubMed] [Google Scholar]
- Kandel, E.R. (1964). Electrical properties of hypothalamic neuroendocrine cells. J Gen Physiol, 47, 691-717. [CrossRef] [PubMed] [Google Scholar]
- Kendrick, K.M., Keverne, E.B. (1992). Control of synthesis and release of oxytocin in the sheep brain. Ann New York Acad Sci, 652, 102-121. [CrossRef] [Google Scholar]
- Kendrick, K.M., Keverne, E.B., Hinton, M.R., Goode, J.A. (1991). Cerebrospinal fluid and plasma concentrations of oxytocin and vasopressin during parturition and vaginocervical stimulation in the sheep. Brain Res Bull, 26, 803-807. [Google Scholar]
- King, L.B., Walum, H., Inoue, K., Eyrich, N.W., Young, L.J. (2016). Variation in the oxytocin receptor gene predicts brain region specific expression and social attachment. Biol Psychiatry, 80, 160-169. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Knobloch, H.S., Charlet, A., Hoffmann, L.C., Eliava, M., Khrulev, S., Cetin, A.H., Osten, P., Schwarz, M.K., Seeburg, P.H., Stoop, R., Grinevich, V. (2012). Evoked axonal oxytocin release in the central amygdala attenuates fear response. Neuron, 73, 553-566. [CrossRef] [PubMed] [Google Scholar]
- Lim, M.M., Murphy, A.Z., Young, L.J. (2004). Ventral striatopallidal oxytocin and vasopressin V1a receptors in the monogamous prairie vole (Microtus ochrogaster). J Comp Neurol, 468, 555-570. [CrossRef] [PubMed] [Google Scholar]
- Lincoln, D.W., Hill, A., Wakerley, J.B. (1973). The milk-ejection reflex of the rat: an intermittent function not abolished by surgical levels of anaesthesia. J Endocrinol, 57, 459-476. [CrossRef] [PubMed] [Google Scholar]
- Mens, W.B.J., Witter, A., Van Wimersma Greidanus, T.B. (1983). Penetration of neurohypophyseal hormones from plasma into cerebrospinal fluid (CSF): Half-times of disappearance of these neuropeptides from CSF. Brain Res, 262, 143-149. [CrossRef] [PubMed] [Google Scholar]
- Meyer, C., Freund-Mercier, M.J., Guerné, Y., Richard, P. (1987). Relationship between oxytocin release and amplitude of oxytocin cell neurosecretory bursts during suckling in the rat. J Endocrinol, 114, 263-270. [CrossRef] [PubMed] [Google Scholar]
- Moos, F., Poulain, D.A., Rodriguez, F., Guerné, Y., Vincent, J.D., Richard, P. (1989). Release of oxytocin within the supraoptic nucleus during the milk ejection reflex in rats. Exp Brain Res, 76, 593-602. [CrossRef] [PubMed] [Google Scholar]
- Nishimori, K., Young, L.J., Guo, Q., Wang, Z., Insel, T.R., Matzuk, M.M. (1996). Oxytocin is required for nursing but is not essential for parturition or reproductive behavior. Proc Natl Acad Sci USA, 93, 11699-11704. [CrossRef] [PubMed] [Google Scholar]
- Numan, M. (2007). Motivational systems and the neural circuitry of maternal behavior in the rat. Dev Psychobiol, 49, 12-21. [CrossRef] [PubMed] [Google Scholar]
- Numan, M., Young, L.J. (2016). Neural mechanisms of mother-infant bonding and pair bonding: Similarities, differences, and broader implications. Horm Behav, 77, 98-112. [CrossRef] [PubMed] [Google Scholar]
- Pedersen, C.A., Prange, A.J. (1979). Induction of maternal behavior in virgin rats after intra-cerebroventricular administration of oxytocin. Proc Natl Acad Sci USA, 76, 6661-6665. [CrossRef] [PubMed] [Google Scholar]
- Pow, D.V., Morris, J.F. (1989). Dendrites of hypothalamic magnocellular neurons release neurohypophysial peptides by exocytosis. Neuroscience, 32, 435-439. [CrossRef] [PubMed] [Google Scholar]
- Quintana, D.S., Lischke, A., Grace, S., Scheele, D., Ma, Y., Becker, B. (2021). Advances in the field of intra-nasal oxytocin research: lessons learned and future directions for clinical research. Mol Psychiatry, 26, 80-91. [CrossRef] [PubMed] [Google Scholar]
- Ross, H.E., Cole, C.D., Smith, Y., Neumann, I.D., Landgraf, R., Murphy, A.Z., Young, L.J. (2009a). Characterization of the oxytocin system regulating affiliative behavior in female prairie voles. Neuroscience, 162, 892-903. [CrossRef] [PubMed] [Google Scholar]
- Ross, H.E., Freeman, S.M., Spiegel, L.L., Ren, X., Terwilliger, E.F., Young, L.J. (2009b). Variation in oxytocin receptor density in the nucleus accumbens has differential effects on affiliative behaviors in monogamous and polygamous voles. J Neurosci, 29, 1312-1318. [CrossRef] [PubMed] [Google Scholar]
- Scheele, D., Striepens, N., Gunturkun, O., Deutschlander, S., Maier, W., Kendrick, K.M., Hurlemann, R. (2012). Oxytocin modulates social distance between males and females. J Neurosci, 32, 16074-16079. [CrossRef] [PubMed] [Google Scholar]
- Schneiderman, I., Zagoory-Sharon, O., Leckman, J.F., Feldman, R. (2012). Oxytocin during the initial stages of romantic attachment: Relations to couples’ interactive reciprocity. Psychoneuroendocrinology, 37, 1277-1285. [CrossRef] [PubMed] [Google Scholar]
- UvnäsMoberg, K., Ekström-Bergström, A., Buckley, S., Massarotti, C., Pajalic, Z., Luegmair, K., Kotlowska, A., Lengler, L., Olza, I., Grylka-Baeschlin, S., Leahy-Warren, P., Hadjigeorgiu, E., Villarmea, S., Dencker, A. (2020). Maternal plasma levels of oxytocin during breastfeeding − A systematic review. PLoS One, e0235806. [Google Scholar]
- Uvnäs-Moberg, K., Handlin, L., Petersson, M. (2015). Self-soothing behaviors with particular reference to oxytocin release induced by non-noxious sensory stimulation. Front Psychol, 5, article 1529. [CrossRef] [Google Scholar]
- Veening, J.G., Olivier, B. (2013). Intra-nasal administration of oxytocin: Behavioral and clinical effects, a review. Neurosci Biobehav Rev, 37, 1445-1465. [CrossRef] [PubMed] [Google Scholar]
- Wakerley, J.B., Lincoln, D.W. (1973). The milk-ejection reflex of the rat: a 20- to 40-fold acceleration in the firing of paraventricular neurones during oxytocin release. J Endocrinol, 57, 477-493. [CrossRef] [PubMed] [Google Scholar]
- Young III, W.S., Shepard, E., Amico, J., Hennighausen, L., Wagner, K.-U., LaMarca, M.E., McKinney, C., Ginns, E.I. (1996). Deficiency in mouse oxytocin prevents milk ejection,but not fertility or parturition. J Neuroendocrinol, 8, 847-853. [CrossRef] [PubMed] [Google Scholar]
- Young, L.J., Huot, B., Nilsen, R., Wang, Z., Insel, T.R. (1996). Species differences in central oxytocin receptor gene expression: comparative analysis of promoter sequences. J Neuroendocrinol, 8, 777-783. [CrossRef] [PubMed] [Google Scholar]
- Young, L.J., Wang, Z., Insel, T.R. (1998). Neuroendocrine bases of monogamy. Trends Neurosci, 21, 71-75. [CrossRef] [PubMed] [Google Scholar]
- Young, L.J., Nilsen, R., Waymire, K.G., MacGregor, G.R., Insel, T.R. (1999). Increased affiliative response to vasopressin in mice expressing the V1a receptor from a monogamous vole. Nature, 400, 766-768. [CrossRef] [PubMed] [Google Scholar]
- Young, L.J., Wang, Z. (2004). The neurobiology of pair bonding. Nat Neurosci, 7, 1048-1054. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Freund-Mercier, M.-J. (2022). Comment, au fil du temps, l’ocytocine est devenue l’hormone de l’attachement. Biologie Aujourd’hui, 216, 113-123
Liste des figures
 |
Figure 1 Activité en bouffées de potentiels d’action d’un neurone neurosécrétoire ocytocinergique pendant l’allaitement chez la ratte (A) et effet facilitateur de l’ocytocine (B). (A) De haut en bas, enregistrements simultanés de la pression intra-mammaire (imp), l’activité unitaire (unit) et l’histogramme de fréquence (rate) en potentiels d’action par seconde d’un neurone ocytocinergique pendant la tétée. Une bouffée de potentiels d’action ou burst, suivie d’une courte période de silence, est enregistrée quelques secondes avant l’augmentation de la pression intra-mammaire, témoin de la libération d’ocytocine. Le chiffre à côté de la bouffée indique le nombre total de potentiels d’action. (B) Évolution de l’activité électrique et des bouffées de potentiels d’action (traits verticaux, PA/seconde) d’un neurone ocytocinergique pendant la tétée avant et après l’injection intra-cérébro-ventriculaire (i.c.v.) de 1 ng d’ocytocine (OT). L’ocytocine augmente l’amplitude des bouffées, c’est-à-dire le nombre total de potentiels d’action et leur fréquence. L’effet dure plus de 40 minutes. D’après Freund-Mercier & Richard (1981). |
| Dans le texte | |
 |
Figure 2 Les autorécepteurs somato-dendritiques de l’ocytocine. Détection histo-autoradiographique des sites de liaison de l’ocytocine. Photomicrographies en fond clair (a) et fond noir (b) mettant en évidence les autorécepteurs de l’ocytocine sur une coupe histologique du noyau supraoptique. Le marquage est modéré sur les corps cellulaires de la zone dorsolatérale (flèches) et beaucoup plus intense sur la couche interne (Int) de la zone ventrale, essentiellement constituée de dendrites. OCH : chiasma optique ; la barre blanche horizontale représente 100 μm. D’après Freund-Mercier et al. (1994). |
| Dans le texte | |
 |
Figure 3 Effets de l’ocytocine et de la vasopressine sur la préférence pour le partenaire chez le campagnol des prairies. La durée du contact avec le partenaire est mesurée en % de la durée totale de l’expérience chez des femelles et des mâles sans accouplement (colonnes noires) et après accouplement (colonnes blanches). Les femelles passent plus de 50 % de leur temps auprès de leurs congénères et plus de 80 % auprès de leur partenaire d’accouplement ; des résultats équivalents sont obtenus chez les mâles. La préférence pour le partenaire est donc dépendante de l’accouplement. L’injection intra-cérébroventriculaire d’ocytocine (OT) chez des femelles non accouplées augmente le temps passé auprès des mâles présents au moment de l’injection ; inversement l’injection d’un antagoniste spécifique des récepteurs de l’ocytocine (OTA) chez des femelles qui se sont accouplées réduit considérablement le temps passé auprès du partenaire d’accouplement. Des résultats équivalents sont obtenus chez les mâles avec la vasopressine (AVP) et un antagoniste spécifique des récepteurs de type V1a (V1a antagonist). D’après Young et al. (1998). |
| Dans le texte | |
 |
Figure 4 Distribution cérébrale des récepteurs de l’ocytocine et de la vasopressine chez le campagnol des prairies monogame et le campagnol des montagnes polygame. Films autoradiographiques générés à partir de coupes frontales de cerveau mettant en évidence les sites de liaison de l’ocytocine (OTR) et de la vasopressine de type V1a (V1aR). Le récepteur de l’ocytocine est exprimé dans le cortex préfrontal (PFC), le noyau accumbens (NAcc) et le caudé-putamen (CP) chez le campagnol des prairies ; mais uniquement dans le cortex préfrontal chez le campagnol des montagnes. Le récepteur de la vasopressine de type V1a est majoritairement exprimé dans le pallidum ventral (VP) chez le campagnol des prairies et dans le septum latéral (LS) chez le campagnol des montagnes. La barre horizontale représente 1 mm. D’après Young & Wang (2004). |
| Dans le texte | |
 |
Figure 5 Mise en évidence d’une relation causale entre la présence des récepteurs de la vasopressine et la préférence pour le partenaire chez le campagnol. (A) La durée de contact avec le partenaire sexuel du campagnol polygame augmente significativement après surexpression dans le pallidum ventral du récepteur de la vasopressine de type V1a (V1aR) du campagnol des prairies, monogame. Le transfert de gène a été réalisé avec un vecteur de type AAV (virus adéno-associé). D’après Donaldson & Young (2008). (B) La durée de contact avec le partenaire sexuel du campagnol des prairies, monogame, diminue significativement lorsqu’on réduit l’expression du récepteur de la vasopressine de type V1a (V1aR) par l’administration d’un ARN interférent (iARN) dans son pallidum ventral. D’après Barrett et al. (2013). |
| Dans le texte | |
 |
Figure 6 L’expression du récepteur de l’ocytocine dans le noyau accumbens chez le campagnol polygame est sans effet sur la préférence pour le partenaire. (A) Films autoradiographiques générés à partir de coupes frontales de cerveau mettant en évidence les sites de liaison de l’ocytocine chez un campagnol monogame et un campagnol polygame ; (a) condition contrôle ; (b) surexpression du récepteur de l’ocytocine (OTR) dans le noyau accumbens (NAcc). Le transfert de gène a été réalisé avec un vecteur de type AAV (virus adéno-associé). (B) Chez le campagnol monogame, la durée de contact avec le partenaire sexuel est augmentée après surexpression du récepteur de l’ocytocine dans le noyau accumbens (AAV OTR), ce qui n’est pas le cas chez le campagnol polygame. D’après Ross et al. (2009b). |
| Dans le texte | |
 |
Figure 7 Taux d’ocytocine plasmatique dans différentes conditions d’attachement amoureux chez l’humain. Les taux d’ocytocine plasmatique sont mesurés chez des hommes (colonnes grisées noires) et des femmes (colonnes grisées blanches). (A) célibataires et nouveaux amoureux (2 tests). (B) au bout de 6 mois chez les couples restés unis et chez les couples séparés. D’après Schneiderman et al. (2012). |
| Dans le texte | |
 |
Figure 8 Taux d’ocytocine plasmatique chez des hommes dans deux situations différentes. Les mesures sont effectuées avant, puis 15 et 30 minutes après une séance de massage de 20 minutes (colonnes noires) ou de lecture du bulletin national de géographie des USA (colonnes grises). D’après Bello et al. (2008). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


