| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 3-4, 2022
|
|
|---|---|---|
| Page(s) | 89 - 103 | |
| DOI | https://doi.org/10.1051/jbio/2022016 | |
| Publié en ligne | 6 février 2023 | |
Article
Le système neurosécréteur caudal, l’autre système « neurohypophysaire » des poissons
The caudal neurosecretory system, the other “neurohypophysial” system in fish
1
Muséum National d’Histoire Naturelle, CNRS UMR 7221, Physiologie moléculaire et adaptation, 75005 Paris, France
2
Sorbonne Université, CNRS UMR 8246, INSERM U1130, IBPS, Neurosciences Paris Seine, Neuroplasticité des comportements de reproduction, 75005 Paris, France
* Auteur correspondant : herve.tostivint@mnhn.fr
Reçu :
1
Juin
2022
Le système neurosécréteur caudal (SNSC) est un complexe neuroendocrinien propre aux poissons. Sur le plan structural, il présente de nombreuses similitudes avec le complexe hypothalamo-neurohypophysaire d’autres vertébrés. Il s’en distingue toutefois par sa position, à l’extrémité caudale de la moelle épinière, et par la nature des hormones qu’il sécrète, les plus importantes étant les urotensines. Le SNSC a été décrit pour la première fois il y a plus de 60 ans, mais son origine embryologique est totalement inconnue et son rôle reste mal compris. Paradoxalement, il n’est presque plus étudié aujourd’hui. Les développements récents en imagerie et en génie génétique pourraient justifier la reprise d’investigations sur le SNSC afin de lever les mystères qui continuent de l’entourer.
Abstract
The caudal neurosecretory system (CNSS) is a neuroendocrine complex whose existence is specific to fishes. Structurally, it has many similarities with the hypothalamic-neurohypophyseal complex of other vertebrates. However, it differs regarding its position at the caudal end of the spinal cord and the nature of the hormones it secretes, the most important being urotensins. The CNSS was first described more than 60 years ago, but its embryological origin is totally unknown and its role is still poorly understood. Paradoxically, it is almost no longer studied today. Recent developments in imaging and genome editing could make it possible to resume investigations on CNSS in order to solve the mysteries that still surround it.
Mots clés : système neurosécréteur caudal / urophyse / cellules de Dahlgren / urotensines / poissons
Key words: caudal neurosecretory system / urophysis / Dahlgren cells / urotensins / fish
© Société de Biologie, 2023
Abréviations
CRH : Corticotropin-releasing hormone (corticolibérine)
GnRH : Gonadotropin-releasing hormone (gonadolibérine)
SNAPS : Système nerveux autonome parasympathique sacré
SNSC : Système neurosécréteur caudal
Introduction : la découverte du système neurosécréteur caudal
Les neurones de l’hypothalamus auxquels Madame Tixier-Vidal a consacré une grande partie de ses recherches constituent assurément les cellules neurosécrétrices les plus étudiées et les mieux connues. Les premiers neurones de ce type, qualifiés alors de cellules neuroglandulaires (car associant des propriétés à la fois de neurones et de cellules glandulaires), ont été décrits en 1928 par E. Scharrer dans le noyau préoptique d’un poisson téléostéen, le vairon Phoxinus laevis, puis, un peu plus tard, chez l’ensemble des vertébrés (Scharrer & Scharrer, 1945).
Pourtant, la première description chez les vertébrés de cellules reconnues comme neurosécrétrices a été faite non pas dans l’hypothalamus mais dans la moelle épinière caudale (Gabe, 1966). Elle émane des travaux de Dahlgren réalisés chez plusieurs espèces de raies, des poissons cartilagineux (Dahlgren, 1914). Les cellules observées par Dahlgren, et qui depuis portent son nom, ont d’abord retenu l’attention par leur taille exceptionnelle (avec un volume qui peut représenter jusqu’à 20 fois celui d’un motoneurone typique). Ce n’est toutefois pas Dahlgren lui-même qui en a compris la véritable nature (il les avait considérées comme de « simples » neurones moteurs, en lien avec l’organe électrique des raies), mais Speidel, quelques années plus tard, qui a su reconnaître leur caractère glandulaire (Speidel, 1919). Dans une publication de 1922, celui-ci a étendu ses observations aux poissons téléostéens chez lesquels il a retrouvé les mêmes types de cellules (Speidel, 1922).
Malgré leur importance, ces travaux pionniers sont tombés ensuite presque complètement dans l’oubli et le concept de neurosécrétion chez les vertébrés s’est finalement élaboré surtout à partir des travaux menés sur l’hypothalamus (Gabe, 1966). Le fait que les cellules de Dahlgren ne soient pas colorables par la méthode de Gomori, contrairement à leurs équivalents hypothalamiques, explique peut-être cette désaffection. Quoi qu’il en soit, il a fallu attendre 1955 pour que ces cellules soient à nouveau mises à l’honneur, et ce grâce aux recherches d’Enami. Celui-ci, en travaillant tout d’abord sur l’anguille Anguilla japonica (Enami, 1955) puis sur plus d’une centaine d’autres espèces de téléostéens, a été le premier à comprendre que ces cellules étaient les composants majeurs d’un second système neurosécréteur, analogue au complexe hypothalamo-neurophypophysaire (Enami, 1959). Baptisé système neurosécréteur caudal (SNSC), ce système est formé par deux éléments majeurs (Figures 1A et 1B) : (i) une population de neurones neurosécréteurs, les cellules de Dahlgren et (ii) un organe richement vascularisé, dit neuro-hémal, vers lequel les axones de ces cellules convergent pour y déverser leurs produits de sécrétion. Cet organe se présente comme un renflement en position le plus souvent ventrale de la moelle épinière caudale. Compte tenu de sa position et de sa forte similitude avec la neurohypophyse, il a été d’abord nommé neurohypophyse spinale ou urohypophyse par Enami, puis neurophyse spinale caudale, avant finalement que le terme d’urophyse ne vienne s’imposer (Fridberg & Bern, 1968). Si Enami a été le premier à fournir une interprétation correcte de ce qu’est l’urophyse, il n’a pas été le premier à en révéler l’existence puisque, dès le début du XIXe siècle, la présence de cette structure avait déjà été signalée par plusieurs auteurs, en particulier Arsaky (1813) et Weber (1827). Dans un article de 1925, Favaro avait fourni une étude particulièrement approfondie de l’organe, qu’il avait alors qualifié d’hypophyse caudale et montré sa quasi-constance chez les téléostéens (Favaro, 1925).
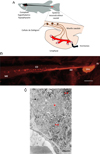 |
Figure 1 Organisation du système neurosécréteur caudal. (A) Représentation schématique du SNSC des poissons téléostéens (inspirée de Ichikawa et al., 1986). (B) Visualisation du SNSC de poisson-zèbre adulte par immunohistochimie. Le matériel immunoréactif de type UII apparaît fluorescent. Noter le gradient de taille décroissant des cellules de Dahlgren (CD) dans le sens rostro-caudal. Ax : faisceau d’axones neusécrétoires ; Ft : filum terminal ; ME : moelle épinière ; Uro : urophyse. Barre d’échelle : 50 μm. (C) Ultrastructure de l’urophyse de poisson-zèbre adulte. Deux catégories de granules de densité électronique différente peuvent être distinguées, qui semblent définir deux catégories de fibres neurosécrétrices, notées * et **, respectivement. f : fenestration ; L : lumière d’un capillaire sanguin ; LB : lame basale. Barre d’échelle : 1 μm. |
L’organisation du système neurosécréteur caudal chez les poissons téléostéens
L’organisation du SNSC qui vient d’être décrite (Figure 1A) est globalement bien conservée chez l’ensemble des espèces de téléostéens étudiées (Bern & Takasugi, 1962 ; Holmgren, 1964 ; Fridberg & Bern, 1968 ; Ichikawa et al., 1986 ; Kobayashi et al., 1986). Les cellules de Dahlgren sont généralement arrangées en deux colonnes de part et d’autre du canal central. Leurs corps cellulaires se concentrent en amont de l’urophyse avec une distribution qui peut s’étendre sur un nombre variable de vertèbres (de 3 à 10 le plus souvent). Ils manifestent un net gradient de taille (décroissant) selon l’axe rostro-caudal (Figure 1B). Chez certaines espèces, des cellules de petite taille sont également présentes dans la partie la plus postérieure de la moelle située au-delà de l’urophyse et dénommée filum terminal (Fridberg, 1962a). Les cellules les plus volumineuses sont généralement multipolaires, alors que les plus petites sont uni- ou bipolaires. La taille des somas des cellules de Dahlgren est très variable d’une espèce à l’autre, de moins de 10 μm de diamètre pour les plus petites à plus de 100 μm pour les plus grosses (Fridberg, 1962a).
Le noyau des cellules de Dahlgren contient une chromatine très dense et présente un fort polymorphisme, d’autant plus accentué qu’elles sont volumineuses avec notamment, dans ce dernier cas, un aspect souvent multilobé. Leur cytoplasme est fortement basophile en raison de concentrations élevées en ARN, ce qui est considéré comme le signe d’une synthèse protéique intense (Fridberg, 1962a). Celle-ci est également soulignée par un réticulum endoplasmique abondant et un appareil de Golgi comportant de nombreux dictyosomes.
Les axones des cellules de Dahlgren qui, pour la plupart, sont non myélinisés, projettent principalement vers l’urophyse (Kobayashi et al., 1986). L’existence de projections vers le canal central de la moelle, au contact du liquide céphalo-rachidien, a été aussi signalée (Fridberg & Nishioka, 1966 ; Vigh & Vigh-Teichmann, 1998).
L’urophyse est en général localisée en position ventrale par rapport à la moelle, dans la concavité de la dernière vertèbre, appelée urostyle. Sa morphologie montre de grandes variations suivant les espèces (Favaro, 1925 ; Fridberg, 1962a ; Fridberg & Bern, 1968). Dans certains taxons, par exemple l’anguille, le brochet et des salmonidés, l’urophyse apparaît peu individualisée par rapport à la moelle, alors que chez d’autres, comme le poisson-coffre Ostracion lentiginosus, elle en est séparée par une structure qui rappelle fortement la tige pituitaire du complexe hypothalamo-hypophysaire (Fridberg & Bern, 1968). Il est à noter que certains poissons, comme les syngnathes, sont apparemment dépourvus d’urophyse, alors que chez d’autres, comme le flet commun Platichthys flesus ou le thon, l’existence d’urophyses surnuméraires a été rapportée. Au premier abord, toutes ces variations peuvent sembler sans rapport avec la position phylogénétique des espèces considérées : ainsi une tige urophysaire est détectée chez certains lophiiformes comme la baudroie Lophius piscatorius, alors que chez le poisson-lune Mola mola, une espèce appartenant pourtant à son groupe-frère, les molidés, l’urophyse est apparemment absente (Fridberg & Bern, 1968). Nous verrons plus loin qu’il n’en est rien et que l’individualisation de l’urophyse chez les espèces citées précédemment est une véritable tendance évolutive au sein du groupe (monophylétique) des néotéléostéens (Hughes et al., 2018).
Sur le plan histologique, l’urophyse se décompose en une région interne, généralement peu développée, la médulla, et une région périphérique plus épaisse, le cortex (Fridberg & Bern 1968). La médulla est la partie traversée par les axones des cellules de Dahlgren et le cortex correspond à la zone vascularisée au niveau de laquelle les terminaisons axonales des cellules de Dahlgren entrent en contact avec des capillaires sanguins de type fenestré (Figure 1C). Ces terminaisons présentent parfois des renflements en tous points similaires aux corps de Herring de la neurohypophyse (Fridberg, 1962a ; Holmgren, 1964 ; Cioni et al., 1998). Elles sont remplies de vésicules à cœur dense qui, chez le cyprin doré Carassius auratus et le poisson-zèbre Danio rerio, forment deux populations distinctes sur la base de leur diamètre (Figure 1C) (Cioni et al., 1998 ; Parmentier et al., 2006).
L’urophyse est irriguée par l’aorte. Son drainage veineux est assuré par la veine caudale qui rejoint ensuite le système porte-rénal. Ce système comporte plusieurs branches qui, outre le rein, permettent d’atteindre également la vessie urinaire, la vessie natatoire, le foie et l’intestin postérieur (Bern et al., 1985).
Le SNSC est innervé par des voies descendantes provenant du cerveau, en particulier du tegmentum et du noyau réticulaire du tronc cérébral (O’Brien & Kriebel, 1982). Il a été montré par immunohistochimie que cette innervation est principalement de type aminergique (Kobayashi et al., 1980 ; Audet & Chevalier, 1981 ; McKeon et al., 1988) mais également cholinergique (Kobayashi et al., 1979), et peptidergique, avec en particulier la présence de fibres immunoréactives pour la gonadolibérine (gonadotropin-releasing hormone ou GnRH) (Miller & Kriebel, 1986) et le neuropeptide Y (NPY) (Oka et al., 1997). Plus récemment, la présence de récepteurs de la dopamine (type D5), du glutamate (types R1-3), de l’acide gamma-aminobutyrique (GABA, type A) et de la GnRH a été démontrée par RT-PCR dans le SNSC du cardeau Paralichthys olivaceus (Lan et al., 2018a, b, 2021 ; Jiang et al., 2021).
Les sécrétions urophysaires
Dès lors que la nature glandulaire des cellules de Dahlgren a été reconnue, la recherche de leurs produits de sécrétion a pu être entreprise. Des extraits urophysaires ont ainsi été préparés et testés sur tout un éventail de tissus appartenant à des espèces couvrant les principaux groupes de vertébrés. Les actions exercées par ces extraits se sont révélées multiples, en particulier sur les muscles lisses des vaisseaux sanguins et sur les épithéliums osmorégulateurs (Chan & Bern, 1976). Dans la mesure où elles étaient abolies par un traitement aux peptidases, il était clair que les principes actifs qui en étaient responsables étaient de nature peptidique. Les propriétés vasoactives de ces extraits ont pu être attribuées à deux facteurs principaux : l’urotensine I (UI), pour ses effets hypotensifs et vasodilatateurs, et l’urotensine II (UII), pour ses effets hypertensifs et spasmogéniques (Chan & Bern, 1976).
Après de longues années d’efforts, grâce en particulier au suivi, tout au long des procédures de purification, de sa capacité à diminuer la pression de perfusion dans la patte postérieure isolée de rat, l’UI a été finalement isolée par Lederis et al. (1982), à partir d’extraits urophysaires du meunier noir Catostomus commersii. Il s’agit d’un peptide amidé de 41 acides aminés qui appartient à la famille de la corticolibérine (corticotropin-releasing hormone ou CRH) (Lovejoy & de Lannoy, 2013 ; Cardoso et al., 2016). L’UI a d’ailleurs été initialement considérée comme l’équivalent de la CRH chez les poissons mais la découverte chez C. commersii d’une authentique CRH (Okawara et al., 1988) a permis de réaliser que l’UI et la CRH étaient issues de deux gènes paralogues. L’UI existe non seulement chez les téléostéens mais aussi chez l’ensemble des vertébrés (Cardoso et al., 2016, 2020). L’UI des mammifères est plus connue sous le nom d’urocortine 1 (Vaughan et al., 1995). Il a été montré que les gènes de la CRH et de l’UI sont vraisemblablement apparus à la faveur des deux évènements de tétraploïdisation (1R et 2R) qui ont touché le génome des vertébrés au tout début de leur histoire (Cardoso et al., 2016, 2020 ; Endsin et al., 2017).
L’UII, quant à elle, a été caractérisée deux ans avant l’UI, à partir d’extraits urophysaires du gobie Gillichthys mirabilis grâce à sa capacité à stimuler les contractions du rectum de truite (Pearson et al., 1980). Il s’agit d’un peptide cyclique de 12 acides aminés qui présente de nombreuses similitudes structurales avec la somatostatine (SST). En raison de leur très grande proximité chromosomique chez de nombreuses espèces de vertébrés, il a été proposé que les gènes de l’UII et de la SST soient issus de la duplication en tandem d’un même gène ancestral (Tostivint et al., 2006). Tout comme l’UI, l’UII est présente chez l’ensemble des vertébrés (Tostivint et al., 2013, 2014), y compris les mammifères (Coulouarn et al., 1998, 1999). Toutefois, la réalité de son existence chez les cyclostomes est encore sujette à caution dans la mesure où, si le peptide a bien été isolé chez plusieurs espèces de lamproie (Waugh et al., 1995), son gène demeure introuvable dans les génomes correspondants. Ce paradoxe pourrait peut-être s’expliquer par la localisation du gène de l’UII dans des régions réfractaires aux méthodes actuelles de séquençage.
Chez les poissons, le gène de l’UII s’exprime très majoritairement dans les cellules de Dahlgren (Ohsako et al., 1986 : Lu et al., 2006 : Parmentier et al., 2008), et en constitue donc un marqueur spécifique et quasi exclusif. À cet égard, il convient de préciser que la présence dans certains neurones au contact du liquide céphalo-rachidien d’un matériel immunoréactif de type UII, présenté un temps comme « extra-urophysaire » (Yulis & Lederis, 1986), est aujourd’hui attribuée, non pas à l’UII, mais à des peptides apparentés appelés UII-related peptides 1 et 2 (URP1 et URP2) (Parmentier et al., 2011 : Quan et al., 2015).
Contrairement au gène de l’UII, celui de l’UI est également fortement exprimé en dehors du SNSC, notamment dans le cerveau et plus particulièrement l’hypothalamus (Alderman & Bernier, 2007). Chez les tétrapodes, qui sont dépourvus de SNSC (voir plus loin), l’UII est principalement produite par des motoneurones localisés dans la moelle épinière et le tronc cérébral (Coulouarn et al., 1998, 1999 ; Egginger et al., 2006 ; Dubessy et al., 2008).
Des expériences de double marquage, soit par immunohistochimie, soit par hybridation in situ, suggèrent que la proportion de cellules de Dahlgren produisant à la fois l’UI et l’UII est très variable d’une espèce à l’autre : très forte chez la carpe (Ichikawa et al., 1988), faible chez le poisson-zèbre D. rerio (Parmentier et al., 2008) et intermédiaire chez le poisson-crapaud Porichthys notatus (Onstott & Elde, 1986a). La microscopie électronique a révélé chez le poisson-zèbre D. rerio que l’UII est stockée principalement dans les vésicules à cœur dense de grand diamètre, alors que l’UI est accumulée dans des vésicules de plus petit diamètre (Parmentier et al., 2006). La coexistence des deux peptides a toutefois pu être observée dans les mêmes granules. Toutes ces données suggèrent que les cellules de Dahlgren qui synthétisent l’UI et celles qui synthétisent l’UII ne forment pas des sous-populations totalement distinctes, à l’instar de ce qui est observé dans l’hypothalamus avec les neurones à vasopressine et les neurones à ocytocine (Gainer, 2012). D’ailleurs, il a été suggéré que la proportion de cellules de Dahlgren exprimant l’UI et l’UII puisse changer en fonction des conditions physiologiques (McCrohan et al., 2007).
L’activité sécrétoire des cellules de Dahlgren est sous-tendue par une activité électrique qui se caractérise par l’émission de potentiels d’action plus de 10 fois plus longs que ceux détectés dans les motoneurones voisins (Morita et al., 1961 ; Bennett & Fox, 1962). Cette activité électrique met en jeu principalement des canaux calciques de type L ainsi que des canaux potassiques activés par le calcium (Brierley et al., 2004). Chez le flet P. flesus, les cellules de Dahlgren présentent deux types principaux de profils électrophysiologiques (Hubbard et al., 1996) : les cellules de type 1 manifestent une activité spontanée importante, rappelant celle des neurones magnocellulaires à vasopressine des mammifères (Leng et al., 1999), alors que les cellules de type 2 sont majoritairement silencieuses et peu excitables. Ces deux types de cellules ont été un temps considérés comme formant deux populations distinctes, d’autant plus que leur distribution spatiale semblait coïncider avec la distribution immunohistochimique respective des cellules à UI et à UII (Arnold-Reed et al., 1991). Les travaux ultérieurs n’ont toutefois pas confirmé cette vision et suggèrent plutôt que les deux types d’activité décrits initialement correspondent à deux états inter-convertibles d’un type unique de cellule (McCrohan et al., 2007).
Si l’UI et l’UII sont les produits de sécrétion majoritaires des cellules de Dahlgren, ils n’en sont toutefois pas les seuls. Les principaux autres produits détectés, soit par immunohistochimie soit par hybridation in situ, sont la CRH (Lu et al., 2004), la protéine apparentée à l’hormone parathyroïdienne (PTH-rP) (Ingleton et al., 2002 ; Lu et al., 2017) et la Met-enképhaline (Yamada et al., 1988). La présence du transcrit de la stanniocalcin-1 (STC-1), une hormone impliquée dans la régulation de la calcémie (Yeung et al., 2012), a été également rapportée par PCR dans le SNSC du flet P. flesus (Greenwood et al., 2009). Enfin, la vasotocine (équivalent chez les poissons de la vasopressine) et l’isotocine (homologue de l’ocytocine) sont deux peptides dont la présence a été démontrée dans l’urophyse chez plusieurs espèces de téléostéens (Lacanilao, 1972 ; Gozdowska et al., 2013). Il n’est toutefois pas certain qu’elles soient réellement produites par les cellules de Dahlgren. La même problématique se pose avec l’acétylcholine, très abondante dans l’urophyse mais dont la véritable source n’est pas connue (Ichikawa, 1978 ; Conlon & Balment, 1996). Enfin, il est à noter que les cellules de Dahlgren produisent l’oxyde nitrique (NO) synthase (Cioni et al., 1997 ; Marley et al., 2007). Sur la base de ces données, il a été proposé que la sécrétion des urotensines soit modulée par le NO (Cioni et al., 2002, 2019).
L’évolution du système neurosécréteur caudal
Comme nous l’avons mentionné plus haut, les premières descriptions des cellules de Dahlgren émanent d’observations réalisées chez les poissons cartilagineux (chondrichthyens), en particulier du groupe des élasmobranches (requins et raies) (Dahlgren, 1914 ; Speidel, 1919). Ces cellules, de taille souvent considérable (parfois plus de 250 μm de longueur), se sont révélées homologues à celles identifiées chez les téléostéens, à la fois sur le plan histologique (Fridberg, 1959) et fonctionnel puisqu’elles synthétisent également l’UI et l’UII (Owada et al., 1985 ; Onstott & Elde, 1986a, b).
Les mêmes types de cellules ont été également identifiés chez les holocéphales (chimères), les polyptériformes, les chondrostéens (esturgeons) et les holostéens (lépisostés et amies) (Fridberg, 1962b ; Onstott & Elde, 1986b), ce qui indique d’une part qu’un SNSC est présent à la fois chez les poissons cartilagineux et les poissons osseux à nageoires rayonnées (actinoptérygiens) et, d’autre part, que celui-ci existait donc déjà probablement chez le dernier ancêtre commun des vertébrés à mâchoires (gnathostomes) (Fridberg & Bern, 1968) (Figure 2).
Chez les poissons cartilagineux ainsi que chez les actinoptérygiens non téléostéens, le SNSC présente toutefois une différence majeure par rapport à celui décrit chez les téléostéens, à savoir l’absence d’urophyse (Figure 2). Par ailleurs, les cellules de Dahlgren y sont distribuées sur une portion beaucoup plus étendue de la moelle caudale. Chez certaines espèces, celle-ci peut couvrir plus de cinquante vertèbres (Fridberg, 1962b). Du fait de cette absence d’urophyse, les axones des cellules de Dahlgren sont beaucoup plus courts et projettent à la surface ventrale ou latéro-ventrale de la moelle qui leur fait face. Selon les espèces, les terminaisons axonales peuvent demeurer dans le tissu nerveux ou bien pénétrer à l’intérieur du tissu méningé pour contacter les capillaires sanguins au niveau desquels ils libèrent leurs produits de sécrétion (Fridberg, 1962b).
Si l’existence d’un SNSC chez le dernier ancêtre commun des vertébrés à mâchoires ne semble pas faire de doute, sa présence chez les cyclostomes (lamproies et myxines) est peu probable dans la mesure où aucune structure située dans leur moelle caudale ne l’évoque clairement (Fridberg & Bern, 1968 ; Kobayashi et al., 1986) ; d’ailleurs toutes les tentatives de recherche de matériel immunoréactif de type UII chez ces espèces ont échoué (Owada et al., 1985 ; Onstott & Elde, 1986b ; Waugh et al., 1995). Il est utile de rappeler à cet égard que l’UII isolée chez les lamproies l’a été à partir du cerveau et non de la moelle (Waugh et al., 1995). Il semble toutefois évident que la recherche exhaustive des sites de synthèse de l’UII restera hors d’atteinte tant que son gène ne sera pas identifié (voir plus haut). Si elle devait se confirmer, l’absence de SNSC chez les cyclostomes pourrait indiquer que le SNSC est probablement une innovation des gnathostomes (Figure 2).
L’absence de SNSC chez les tétrapodes est quant à elle largement admise (Bern & Takasugi, 1962 ; Fridberg & Bern, 1968 ; Kobayashi et al., 1986), ce qui suggère que le système a été certainement perdu, au plus tard à la racine de ce groupe (Figure 2). Cette régression pourrait même avoir eu lieu plus précocement puisque, chez les dipneustes, la présence de cellules immunoréactives à l’UII a certes été rapportée dans la moelle (Bern & Takasugi, 1962) mais l’identité de ces cellules reste inconnue. Une étude anatomique réalisée chez le cœlacanthe Latimeria chalumnae note l’absence apparente d’urophyse (Millot & Anthony, 1965). Toutefois, à notre connaissance, aucune recherche des cellules de Dahlgren n’a été entreprise chez cette espèce.
L’organisation du SNSC des poissons cartilagineux et des actinoptérygiens non téléostéens, caractérisée par une aire neuro-hémale diffuse, est généralement considérée comme primitive car moins complexe que celle des téléostéens pourvus d’une authentique urophyse (Bern & Takasugi, 1962 ; Fridberg, 1962b ; Fridberg & Bern, 1968). De manière intéressante, il a été constaté que chez les élopomorphes (qui rassemblent notamment les anguilles) et les salmoniformes le SNSC peut présenter une organisation intermédiaire entre les deux états décrits ci-dessus, avec une urophyse peu individualisée et parfois difficile à distinguer du reste de la moelle (Fridberg & Bern, 1968) (Figure 2). Chez le tarpon Albula vulpes, une espèce d’élopomorphe, Fridberg et al. (1966a) ont en outre signalé la présence, en avant de l’urophyse, de régions neuro-hémales extra-urophysaires diffuses qui ressemblent beaucoup à celles qui existent chez les poissons cartilagineux. D’une façon générale, même si cette règle peut souffrir quelques exceptions (voir plus haut), on peut constater que les espèces de téléostéens dont l’urophyse atteint son plus haut degré de différenciation (avec notamment une tige qui la relie à la moelle) appartiennent toutes au groupe (monophylétique) des néotéléostéens (Hughes et al., 2018).
Sur la base de ces observations, Bern & Takasugi (1962) ont proposé que la formation de l’urophyse résulterait d’une évolution par condensation progressive d’une aire neuro-hémale initialement diffuse. Dans leur schéma initial (partie droite de la Figure 2), les deux auteurs ont présenté une vision linéaire de ces transformations, depuis les poissons cartilagineux, considérés comme « ancestraux », jusqu’aux téléostéens les plus « évolués », en passant par d’autres présentés comme plus « primitifs ». Cette vision est typique d’une conception gradiste de l’évolution, encore très en vogue dans les années 1960, mais depuis fortement remise en cause. De fait, des signes de condensation de la région neuro-hémale sont également observés chez la raie Torpedo ocellata (Fridberg, 1962b), qui est un chondrichtyen, tout comme chez le spatulaire Polyondon spathula (Brady, 1984), une espèce rattachée au groupe des esturgeons (chondrostéens), et chez le poisson-roseau Erpetoichthys calabaricus (Onstott & Elde, 1986b). Ces observations laissent à penser que la condensation du SNSC est une tendance évolutive qui ne s’est pas produite une seule fois chez les téléostéens, mais qu’elle s’est au contraire répétée à plusieurs reprises, et à des degrés variés au cours de l’évolution des « poissons » (Figure 2).
Munro (1995) a noté que la disparition des neurones du SNSC chez les tétrapodes est concomitante de l’apparition des neurones spinaux du système nerveux autonome parasympathique sacré (SNAPS), qui sont absents chez les télostéens. Au vu des similitudes d’action du SNAPS et des urotensines, en particulier sur les muscles lisses, il a émis l’hypothèse que le SNSC et le SNAPS soient sinon homologues, du moins analogues. Il a même été plus loin en suggérant que les modifications de structure du SNSC et son remplacement par (ou son évolution en) le SNAPS soient liés à des changements de l’importance de la queue, en particulier via la répartition des motoneurones, qui varie en fonction de la forme de la queue (homocerque versus hétérocerque) et du type de locomotion principale (ondulations du corps ou bien de la nageoire caudale, ou encore des nageoires ou des membres pairs).
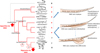 |
Figure 2 Évolution du système neurosécréteur caudal chez les vertébrés. Les taxons qui possèdent un SNSC sont indiqués par le signe + et ceux qui en sont dépourvus, par un 0. Le point d’interrogation se rapporte à des taxons chez lesquels l’existence d’un SNSC reste incertaine. Les moments présumés de l’apparition et de la régression du SNSC sont signalés. Une illustration schématique du SNSC chez les élasmobranches (sans urophyse) et les téléostéens (avec urophyse) est également présentée. Dans le cas des téléostéens, deux organisations sont indiquées, l’une avec urophyse peu différenciée, et l’autre avec urophyse bien individualisée. Il est classiquement admis que l’organisation sans urophyse, avec une aire neuro-hémale diffuse, constitue un état primitif du SNSC. L’apparition de l’urophyse traduirait une tendance évolutive marquée par une condensation de plus en plus forte de l’aire neuro-hémale. Celle-ci aurait atteint son niveau maximal chez les néotéléostéens, mais aurait pu se produire à plusieurs reprises indépendamment, bien qu’à des degrés moindres, dans d’autres groupes de poissons (repérés par l’astérisque *). La partie droite de la figure est inspirée de Bern & Takasugi (1962). |
L’origine développementale du système neurosécréteur caudal
À ce jour, très peu d’informations sont disponibles sur les modalités de la mise en place du SNSC au cours du développement. Les rares études disponibles sont pour la plupart très anciennes, uniquement descriptives et menées sur un nombre très limité d’espèces de téléostéens (Holmgren, 1959 ; Sano & Kawamoto, 1959 ; Sano et al., 1962 ; Fridberg, 1962a ; Honma & Tamura, 1967). De ces études, il ressort toutefois que la morphogénèse du SNSC est très tardive et ne s’achève généralement que plusieurs semaines voire même plusieurs mois après l’éclosion des alevins (Fridberg & Bern, 1968). Deux études plus récentes réalisées chez le saumon Onchorynchus keta (Oka et al., 1993) et chez le tilapia Oreochromis nilotica (Cioni et al., 2000) confirment ces données en montrant que l’urophyse n’acquiert ses caractéristiques définitives qu’au bout de 5 et 4 mois de vie libre, respectivement. Chez ces deux espèces, il est toutefois intéressant de noter que l’UI et/ou l’UII peuvent être détectées par immunohistochimie dès la période de l’éclosion (juste avant ou peu après), ce qui suggère que la détermination des cellules de Dahlgren se produit beaucoup plus précocement. En tout état de cause, cette chronologie est en fort contraste avec celle qui s’applique au complexe hypothalamo-hypophysaire puisque celui-ci est déjà pleinement fonctionnel au moment de l’éclosion.
L’origine des cellules de Dahlgren est, quant à elle, beaucoup plus controversée. Selon les travaux de Sano & Kawamoto (1959), réalisées chez le guppy Lebistes reticulatus (aujourd’hui renommé Poecilia reticulata), elles dériveraient de deux rangées de cellules épendymaires situées dans la zone médio-ventrale du tube neural. Les observations pionnières de Speidel (1919) réalisées chez la raie Raja punctata suggèrent au contraire qu’elles pourraient provenir des mêmes progéniteurs que les motoneurones. Fridberg (1962a) a tiré de ses observations chez le gardon Leuciscus rutilus des conclusions très semblables. En effet, il a identifié dans la moelle caudale de jeunes alevins des neuroblastes qui se singularisent des cellules voisines par leur grande taille et leurs noyaux volumineux. Initialement impossibles à distinguer des neuroblastes donnant naissance aux motoneurones, ils acquièrent progressivement une morphologie propre qui, sur des spécimens plus âgés, permet de les reconnaître sans ambiguïté comme étant des cellules de Dahlgren. Le fait que très peu de motoneurones coexistent dans les portions de moelle où les cellules de Dahlgren sont présentes (Fridberg & Bern, 1968) pourrait être vu comme un argument en faveur de cette hypothèse.
Il est intéressant de noter que le SNSC peut montrer des capacités importantes de régénération (Kobayashi et al., 1986) après ablation. Ainsi, chez le tilapia O. mossambicus, Fridberg et al. (1966b) ont observé qu’il peut se rétablir de manière apparemment complète et fonctionnelle dans les trois semaines qui suivent l’opération, c’est-à-dire avec de nouvelles cellules de Dahlgren et reconstitution d’une aire neuro-hémale, même si celle-ci reste en position interne dans la moelle. Des résultats comparables ont été obtenus chez le poisson-chat Clarias batrachus (Jaiswal & Belsare, 1974). Il a été observé que dans de telles situations, les cellules de Dahlgren se forment à partir de cellules épendymaires. Toutefois, les différentes espèces de téléostéens ne semblent pas toutes disposer de ces capacités régénératrices (Tsuneki & Kobayashi, 1979).
Les fonctions du système neurosécréteur caudal
Les premières études fonctionnelles portant sur le SNSC ont été réalisées par Enami (Enami, 1956 ; Enami et al., 1956). Certainement influencé par les similitudes entre ce système et le complexe hypothalamo-neurohypophysaire, Enami a tout d’abord testé son implication dans les processus d’osmorégulation. Il a ainsi montré, chez la loche Misgurnus anguillicaudatus, qu’une injection intrapéritonéale de NaCl induit des modifications histologiques au sein du SNSC qui traduisent une augmentation de l’activité sécrétoire des cellules de Dahlgren (Enami, 1956). Il a par ailleurs établi que, chez le medaka Oryzias latipes, l’ablation chirurgicale de l’urophyse ou la section de la moelle en amont de cet organe aboutit à des perturbations importantes du métabolisme minéral, et tout particulièrement celui du Na+, tandis que l’injection d’extraits urophysaires modifie la teneur en Na+ des poissons (Enami et al., 1956). Ces résultats ont été les premiers à suggérer l’existence de facteurs hormonaux produits et libérés par le SNSC et ont ainsi ouvert la voie à la découverte des urotensines (voir plus haut). En raison de sa disparition prématurée en 1958, Enami n’a malheureusement pas pu poursuivre ses recherches, mais le nouveau champ d’études qu’il a ouvert a pu être rapidement investi par de nombreux autres chercheurs. Les travaux de ces derniers ont également permis d’explorer l’implication du SNSC dans d’autres fonctions que celles liées à l’osmorégulation.
L’implication du SNSC dans le contrôle de l’équilibre hydrominéral
Les approches expérimentales suivies par Enami pour tester le rôle du SNSC dans le contrôle de l’équilibre hydrominéral ont été largement reprises par ses successeurs. Leurs travaux ont permis de multiplier les arguments en faveur d’un tel rôle, même si, paradoxalement, celui-ci reste encore aujourd’hui particulièrement difficile à cerner de façon claire (Bern & Nishioka, 1979 ; Bern, 1985a ; Ichikawa et al., 1986 ; Winter et al., 2000).
Les effets osmorégulateurs des sécrétions urophysaires
Des injections d’extraits urophysaires se sont révélées pouvoir perturber l’équilibre hydrominéral chez diverses espèces. Ainsi, chez le cyprin doré C. auratus, elles entraînent une augmentation du flux entrant branchial de Na+ ainsi qu’une augmentation de la diurèse rénale (Maetz et al., 1964). Chez l’anguille Anguilla anguilla, ces injections ont également un effet diurétique (Chester-Jones et al., 1969) tandis que chez le gobie G. mirabilis, elles provoquent une augmentation des taux plasmatiques de Na+, Mg2+ et Cl− (Fryer et al., 1978). Chez le poisson à tête de serpent Ophiocephalus maculatus, elles conduisent à des effets similaires à ceux rapportés chez le gobie lorsque les spécimens sont acclimatés en eau douce mais opposés lorsqu’ils sont acclimatés en eau salée (Woo et al., 1980).
L’isolement des urotensines au tout début des années 1980 (voir plus haut) a permis de tester directement l’action de ces peptides sur les organes osmorégulateurs. Ces études ont montré que les urotensines sont effectivement capables de modifier les flux ioniques à travers les épithéliums de plusieurs de ces organes comme la peau (Marshall & Bern, 1979, 1981), l’intestin (Mainoya & Bern, 1982 ; Loretz et al., 1983) et la vessie urinaire (Loretz & Bern, 1981). De manière intéressante, les effets de l’UI et de l’UII sur ces épithéliums se sont parfois révélés opposés. Ainsi, chez le gobie G. mirabilis, la sécrétion active de Cl− par les cellules à chlorure du tégument est activée par l’UI, alors qu’elle est inhibée par l’UII (Marshall & Bern, 1981). Il est à noter qu’un effet similaire de l’UII (inhibition de l’expulsion de NaCl) a été rapporté chez le killi Fundulus heteroclitus au niveau de l’épithélium operculaire, une structure classiquement utilisée comme modèle des branchies (Evans et al., 2011). De ces études est donc ressortie l’idée selon laquelle l’UII avait plutôt tendance à favoriser la rétention des sels dans le milieu intérieur, suggérant qu’elle serait importante avant tout dans le cadre d’une adaptation à la vie en eau douce, alors que l’UI serait profitable surtout en eau salée (Mainoya & Bern, 1982). Toutefois, chez le tilapia Sarotherodon mossambicus (aujourd’hui renommé O. mossambicus), il a été rapporté que l’UII stimule bien l’absorption intestinale d’eau et de NaCl mais uniquement chez les poissons acclimatés en eau salée, alors qu’elle est sans effet sur ceux acclimatés en eau douce, et inversement pour l’UI, ce qui suggère que les effets de l’UII seraient surtout favorables en milieu hyperosmotique et ceux de l’UI en milieu dilué (Mainoya & Bern, 1982). Au total, les fonctions des urotensines apparaissent difficiles à cerner car elles peuvent s’avérer très différentes selon les espèces et leurs milieux de vie (Baldisserotto et al., 1996 ; Baldisserotto & Mimura, 1997).
Quelles que puissent être ces fonctions, l’expression du gène du récepteur de l’UII à la fois dans les branchies, le rein, l’intestin et la vessie (Lu et al., 2006 ; Evans et al., 2011 ; Sun et al., 2013) est en tout cas un argument fort pour considérer tous ces organes comme des cibles potentielles de l’UII. Il convient toutefois de garder à l’esprit que le récepteur de l’UII mentionné ci-dessus, aujourd’hui appelé UTR1, ne représente que l’un des cinq sous-types identifiés chez les téléostéens (Tostivint et al., 2014). Il est donc parfaitement possible que certains des effets de l’UII passent par d’autres récepteurs, mais cela reste à démontrer. Notons qu’à ce jour, très peu de données sont disponibles sur l’expression des deux récepteurs de l’UI (CRHR1 et CRHR2, ainsi appelés car ils sont communs avec ceux de la CRH) chez les téléostéens (Arai et al., 2001).
La question de savoir si les urotensines agissent de manière directe ou indirecte sur leurs organes-cibles a été posée. En effet, compte tenu de leurs propriétés vasoactives, notamment celles de l’UII qui est un facteur vasoconstricteur puissant (Le Mevel et al., 1996 ; Vaudry et al., 2015), il a été suggéré que les urotensines puissent contrôler le fonctionnement de ces organes simplement en modifiant l’intensité du flux sanguin qui les irrigue (Bern, 1985b). La localisation cellulaire du récepteur UTR1 dans les branchies du killi F. heteroclitus et du flet P. flesus illustre bien cette dualité des mécanismes d’action possibles de l’UII puisque chez le premier, il a été détecté dans les cellules à chlorure de l’épithélium branchial (Lu et al., 2006) alors que chez le second, il est localisé dans les éléments vasculaires qui lui sont associés (Evans et al., 2011).
La sensibilité du SNSC à l’environnement osmotique
S’il semble aujourd’hui à peu près acquis que les sécrétions urophysaires, en particulier les urotensines, peuvent participer au contrôle de l’équilibre hydrominéral, qu’en est-il des conditions physiologiques dans lesquelles elles se produisent ? La plupart des études mises en œuvre pour répondre à cette question ont été réalisées chez des espèces euryhalines, c’est-à-dire capables de supporter des environnements de salinité très variable, justement en recherchant les conséquences de modifications de leur environnement osmotique. Les premières études ont été menées avant la caractérisation des urotensines et, de ce fait, se sont appuyées sur des indicateurs indirects de l’activité sécrétoire du SNSC. Des modifications histologiques du SNSC associées à des variations de l’environnement osmotique ont été effectivement rapportées par plusieurs auteurs. Fridberg et al. (1966a), par exemple, ont observé chez le tarpon A. vulpes divers indices cytologiques attestant d’une augmentation de l’activité sécrétoire des cellules de Dahlgren chez les formes vivant dans les étangs littoraux par rapport à celles vivant en mer. De même, Chevalier (1976) a constaté chez la truite mouchetée Salvelinus fontalis des modifications similaires lorsque les poissons sont transférés d’une eau douce dans une eau désionisée. Il est à noter que les changements observés étaient surtout marqués dans la journée suivant l’exposition à ces conditions mais s’estompaient rapidement après.
Parallèlement à ces modifications histologiques, des changements électrophysiologiques témoignant de modifications de l’activité sécrétoire des cellules de Dahlgren ont été également mis en évidence. Les enregistrements réalisés chez le tilapia O. mossambicus par Yagi & Bern (1965) ont ainsi révélé au sein de la moelle caudale l’existence de cellules sensibles à une augmentation du taux sanguin de Na+ et d’autres sensibles à sa baisse. De leur côté, Bennett & Fox (1962) ont observé chez la plie Paralichthys dentatus un accroissement de l’activité électrique spontanée des cellules de Dahlgren en réponse à l’injection intraveineuse d’eau distillée. Les études menées chez une espèce voisine, le flet P. flesus, ont montré que l’activité électrique des cellules de Dahlgren est moins forte chez les poissons acclimatés en eau douce que chez ceux acclimatés en eau de mer (Ashworth et al., 2005).
Après l’isolement des urotensines (Pearson et al., 1980 ; Lederis et al., 1982) et, un peu plus tard, le clonage de leur ADNc (Ohsako et al., 1986 ; Ishida et al., 1986), des dosages des peptides ont pu être réalisés, de même qu’une quantification de leurs transcrits, et ce dans des conditions de salinité différentes. Toutefois, les études les plus poussées à ce jour n’ont été menées que chez un nombre très limité d’espèces. Ainsi, chez le flet P. flesus, qui est une espèce migratrice amenée durant son cycle de vie à évoluer dans des milieux de salinité très variable (Summers, 1979), il a été montré que les variations de ces paramètres sont significatives uniquement en cas de transfert rapide des poissons d’un milieu à un autre (Bond et al., 2002 ; Lu et al., 2006, 2019). Les modifications les plus nettes ont été observées dans le cas d’un transfert d’eau salée en eau douce, avec notamment une concentration de l’UII qui baisse dans le plasma et qui s’élève dans l’urophyse. Dans cette même condition, les taux des ARNm de l’UI et de l’UII dans le SNSC augmentent, alors que ceux du récepteur de l’UII (UTR1) diminuent, aussi bien dans le rein que dans les branchies (Lu et al., 2006, 2019). Ces résultats confirment la grande plasticité du SNSC vis-à-vis de l’environnement osmotique déjà entrevue au travers des études citées plus haut. Ils suggèrent en outre que, tout du moins chez le flet, le SNSC est surtout recruté pour lutter contre les risques liés à un environnement hyperosmotique (Lu et al., 2006).
Chez la truite arc-en-ciel Oncorhynchus mykiss, il a été observé que le transfert d’eau douce en eau salée induit une augmentation des taux des ARNm de l’UI et de la CRH dans le SNSC (Craig et al., 2005). Ces changements sont corrélés à un pic important de sécrétion du cortisol, l’hormone qui, chez les téléostéens, joue le rôle principal dans l’adaptation aux conditions de forte salinité (Takei & McCormick, 2013). Or, il a été montré que la sécrétion de cortisol peut être stimulée directement par l’UI et la CRH provenant du SNSC (Arnold-Reed & Balment, 1994 ; Kelsall & Balment, 1998) et ce, indépendamment de la voie hypophysaire impliquant l’ACTH (Craig et al., 2005). Parallèlement, des expériences réalisées chez le tilapia O. mossambicus ont montré que l’UII inhibe in vitro la sécrétion hypophysaire de la prolactine (Grau et al., 1982 ; Rivas et al., 1986), une des hormones cruciales pour la survie des poissons en eau douce. D’autres expériences, menées chez la dorade Sparus aurata cette fois, ont montré que l’UII inhibe la libération de vasotocine et stimule celle d’isotocine (Kalamarz-Kubiak et al., 2014), deux hormones dont les fonctions osmorégulatrices semblent également importantes chez les téléostéens (Takei & McCormick, 2013). L’ensemble de ces données indique donc que le SNSC pourrait contribuer de manière indirecte au contrôle de l’équilibre hydrominéral, en modulant la sécrétion de plusieurs hormones osmorégulatrices.
Les conséquences de l’ablation du SNSC sur l’équilibre hydrominéral
L’implication du SNSC dans le contrôle de l’équilibre hydrominéral a également été testée dans le cadre d’expériences d’ablation, notamment par élimination de l’urophyse (urophysectomie). Là encore, ces expériences ont conduit à des résultats souvent contradictoires. Des altérations de l’équilibre hydrominéral ont bien été observées chez quelques espèces, comme l’anguille A. anguilla chez laquelle l’excrétion urinaire de K+, Ca2+ et Mg2+ est affectée (Chester-Jones et al., 1969) ou le cyprin doré C. auratus chez lequel le taux plasmatique de Na+ et la diurèse sont abaissés par l’urophysectomie (Turtle, 1974). En revanche, chez plusieurs autres espèces, comme le killi Fundulus kansae (Imai et al., 1965), le gobie G. mirabilis (Fryer et al., 1978), ou le guppy Poecilia vivipara (Mimura & Amaez, 1980), l’ablation de l’urophyse n’a eu aucun effet apparent. Plusieurs explications à cette absence d’effets ont été proposées (Baldisserotto et al., 1994), notamment le fait que certaines des hormones urophysaires puissent avoir d’autres sources que le SNSC ainsi que la capacité de ce dernier à se régénérer assez rapidement (voir plus haut). On peut aussi remarquer que les effets de l’urophysectomie rapportés chez le tilapia O. mossambicus sont apparus très variables selon les études puisque Baldisserotto et al. (1994) ont constaté des changements du taux plasmatique de certains ions chez les poissons traités alors qu’Imai et al. (1965) n’ont rien observé de tel. Par ailleurs, Takasugi & Bern (1962) ont fait des observations comparables à celles de Baldisserotto et al. (1994) mais, dans le même temps, ont noté une mortalité fortement accrue des poissons opérés.
En conclusion, de toutes les données actuellement disponibles, il ressort que le rôle joué par le SNSC et les urotensines dans le contrôle de l’équilibre hydrominéral reste à préciser mais, selon Larson & Bern (1987), ce rôle est probablement mineur par rapport à celui exercé par d’autres systèmes neuroendocriniens comme le système à vasotocine ou celui impliquant les minéralocorticoïdes. En fait, le SNSC participerait principalement à des ajustements fins de la physiologie des poissons lorsque ceux-ci sont confrontés à des changements de salinité de leur milieu. On a pu toutefois observer que le rôle de ce système est certainement différent selon les espèces, ce qui rend difficile toute généralisation. Le fait que l’urophyse soit en place relativement tardivement au cours du développement a vraisemblablement des implications fonctionnelles importantes mais qui, pour l’heure, n’ont jamais été réellement explorées. Par ailleurs, les causes de la disparition du SNSC chez les tétrapodes restent totalement inconnues.
Participation du SNSC à d’autres fonctions
Si, comme nous venons de le voir, les expériences d’ablation du SNSC se sont avérées pour la plupart assez peu informatives, celles basées sur l’injection d’extraits urophysaires ont été beaucoup plus fructueuses et ont ainsi permis de mettre en évidence de nombreux effets. Outre leurs actions osmorégulatrices, que nous venons de détailler, et vasomotrices qui ont conduit à la découverte des urotensines (voir plus haut), ces extraits ou les produits qui en ont été isolés se sont révélés efficaces sur plusieurs autres fonctions, en particulier la reproduction et le métabolisme. Des effets en lien avec le stress ont été également rapportés.
L’idée d’une implication du SNSC dans les fonctions métaboliques est soutenue principalement par les travaux de Sheridan & Bern (1986) et Sheridan et al. (1987). Ces auteurs ont montré, chez le saumon coho Oncorhynchus kisutch, que l’UII stimule la mobilisation des lipides stockés par le foie et augmente en conséquence les taux circulants d’acides gras libres. L’UII favorise également la glycogénolyse hépatique mais, dans le même temps, induit aussi une hypoglycémie. Cet effet paradoxal s’expliquerait par le fait que le glucose produit par le foie serait utilisé pour la synthèse d’acides gras (Sheridan et al., 1987).
Les premiers arguments en faveur d’un rôle du SNSC dans les fonctions de reproduction proviennent d’études menées chez le gobie G. mirabilis et chez le guppy P. reticulata qui ont montré que des extraits urophysaires ont la capacité d’induire une contraction des conduits spermatiques (Berlind, 1972) et ovocytaires ainsi que de la paroi des ovaires (Lederis, 1970). Dans les deux premiers cas toutefois, les facteurs responsables n’ont jamais pu être identifiés et, à ce jour, seul l’effet sur la paroi des ovaires a pu être formellement attribué à un facteur connu, à savoir l’UII (Leonard et al., 1993). En revanche, chez toutes les espèces étudiées jusqu’à présent, les sécrétions urophysaires se sont révélées sans effet sur le processus de ponte lui-même (Behr et al., 2000).
D’autres études suggèrent un rôle possible du SNSC dans la reproduction mais de manière plus indirecte. Ces études réalisées chez plusieurs espèces ont mis en évidence certaines modifications de l’activité du SNSC en lien avec des transformations saisonnières qui touchent l’appareil reproducteur. Ainsi, chez le cyprin doré C. auratus, les cellules de Dahlgren montrent leur taille maximale pendant toute la phase de préparation du frai (Chen & Mu, 2008), tandis que chez le flet P. flesus, la période de frai est concomitante d’une expression minimale des gènes des urotensines (Lu et al., 2007). Rien toutefois ne dit que ces changements soient réellement liés aux fonctions de reproduction dans la mesure où de nombreux autres processus physiologiques sont contrôlés de façon saisonnière, comme l’osmorégulation et le métabolisme. Une étude récente réalisée chez le cardeau P. olivaceus a toutefois redonné un certain poids à cette hypothèse en montrant que l’application d’un analogue de la GnRH sur une préparation de moelle caudale peut modifier l’activité électrique des cellules de Dahlgren (Jiang et al., 2021). Cette étude a permis en outre de mettre en évidence une corrélation positive, pendant toute la période de reproduction, entre les taux des ARNm de l’UII et du récepteur de la GnRH dans le SNSC et le degré de maturation des gonades (indice gonadosomatique).
Les espèces qui, comme le flet P. flesus, migrent de façon saisonnière, sont amenées chaque année à évoluer dans des environnements très différents. Ces changements ont un retentissement sur tous les aspects de leur physiologie, en particulier leur activité osmorégulatrice, puisque les milieux traversés sont de salinité variable, leur métabolisme, car celui-ci est très dépendant des ressources alimentaires disponibles dans chacun d’eux et, évidemment, leur reproduction. Ils demandent en conséquence de puissantes capacités d’adaptation. Lu et al. (2007) ont émis l’hypothèse selon laquelle le SNSC pourrait participer à la reprogrammation saisonnière de ces mécanismes adaptatifs. La mise en évidence récente d’une sensibilité du SNSC à la température s’inscrit a priori plutôt bien dans un tel schéma (Yuan et al., 2020a, b).
Comme nous l’avons déjà mentionné, le SNSC constitue chez certaines espèces une source importante de CRH, en plus des urotensines et notamment de l’UI avec laquelle la CRH est étroitement apparentée. La CRH est bien connue pour jouer un rôle central dans les réponses au stress. Or, il a été montré que l’expression des gènes de la CRH et de l’UI dans le SNSC peut être modulée dans certaines situations de stress, tout comme elle l’est dans l’hypothalamus (Lu et al., 2004 ; Bernier et al., 2008). La réponse des deux systèmes neuroendocriniens s’est révélée toutefois très différente selon les types de stress étudiés, ce qui suggère une certaine spécialisation de chacun d’eux (Bernier et al., 2008).
Quelles perspectives pour l’étude du système neurosécréteur caudal ?
Comme nous venons de le voir, l’étude du SNSC a suscité de nombreux travaux, mais ceux-ci ont surtout fleuri entre la fin des années 1950, juste après les contributions pionnières d’Enami, et les années 1980–1990, à la suite de la caractérisation des urotensines. De fait, les équipes publiant aujourd’hui sur ce système sont très peu nombreuses. La situation est d’autant plus paradoxale que de nombreux aspects de sa biologie restent très mystérieux. Ainsi, nous avons pu montrer dans les lignes qui précèdent à quel point les fonctions précises du SNSC sont mal comprises. Par ailleurs, l’étude de son développement s’est jusqu’ici limitée à des investigations purement descriptives du fait des méthodes expérimentales disponibles lorsqu’elles ont été réalisées, ce qui laisse donc énormément de questions en suspens, par exemple sur l’origine des cellules de Dahlgren.
Au cours de ces dernières années, des progrès considérables ont été réalisés, en imagerie et en génie génétique notamment, grâce auxquels des nouveaux outils d’étude extrêmement puissants ont été mis au point. Parallèlement, le poisson-zèbre D. rerio s’est imposé comme un modèle incontournable dans de nombreux champs de la biologie, tout d’abord en embryologie mais aussi, et de plus en plus, en physiologie. Au carrefour de ces évolutions, les conditions semblent désormais réunies pour reprendre les investigations sur le SNSC et le poisson-zèbre pourrait se présenter comme le modèle idéal.
Remerciements
Les auteurs expriment leur plus vive reconnaissance au Professeur André Calas (Université de Bordeaux) pour sa relecture critique du manuscrit et ses conseils avisés. Ils remercient également le Professeur Michel Hamon pour son précieux travail d’édition.
Références
- Alderman, S.L., Bernier, N.J. (2007). Localization of corticotropin-releasing factor, urotensin I, and CRF-binding protein gene expression in the brain of the zebrafish, Danio rerio. J Comp Neurol, 502, 783–793. [CrossRef] [PubMed] [Google Scholar]
- Arai, M., Assil, I.Q., Abou-Samra, A.B. (2001). Characterization of three corticotropin-releasing factor receptors in catfish: a novel third receptor is predominantly expressed in pituitary and urophysis. Endocrinology, 142, 446–454. [CrossRef] [PubMed] [Google Scholar]
- Arnold-Reed, D.E., Balment, R.J., McCrohan, C.R., Hackney, C.M. (1991). The caudal neurosecretory system of Platichthys flesus: general morphology and responses to altered salinity. Comp Biochem Physiol, 99A, 137–143. [CrossRef] [Google Scholar]
- Arnold-Reed, D.E., Balment, R.J. (1994). Peptide hormones influence in vitro interrenal secretion of cortisol in the trout, Oncorhynchus mykiss. Gen Comp Endocrinol, 96, 85–91. [CrossRef] [PubMed] [Google Scholar]
- Arsaky, A. (1813). De piscium cerebro et medulla spinali, dissertatio inauguralis, Halae, p. 6. [Google Scholar]
- Ashworth, A.J., Banks, J.R., Brierley, M.J., Balment, R.J., McCrohan, C.R. (2005). Electrical activity of caudal neurosecretory neurons in seawater and freshwater-adapted Platichthys flesus, in vivo. J Exp Biol, 208, 267–275. [CrossRef] [PubMed] [Google Scholar]
- Audet, C., Chevalier, G. (1981). Monoaminergic innervation of the caudal neurosecretory system of the brook trout Salvelinus fontinalis in relation to osmotic stimulation. Gen Comp Endocrinol, 45, 189–203. [CrossRef] [PubMed] [Google Scholar]
- Baldisserotto, B., Mimura, O.M., Salomão, L.C. (1994). Urophyseal control of plasma ionic concentration in Oreochromis mossambicus (Pisces) exposed to osmotic stress. Ciência e Natura, 16, 39–50. [CrossRef] [Google Scholar]
- Baldisserotto, B., Roni João Rakoski, R.J., da Silva Fernandes, C.L. (1996). Effect of urotensin II on water and ion fluxes in the intestine, gallbladder and urinary bladder of the freshwater teleost, Hoplias malabaricus. Ciência e Natura, 18, 71–82. [CrossRef] [Google Scholar]
- Baldisserotto, B., Mimura, O.M. (1997). Changes in the electrophysiological parameters of the posterior intestine of Anguilla Anguilla (pisces) induced by oxytocin, urotensin II and aldosterone. Braz J Med Bial Res, 30, 35–39. [CrossRef] [PubMed] [Google Scholar]
- Behr, E.R., Baldisserotto, B., Parra, W.G., Brandão, D.A, Herke, Z. (2000). Urophysial and pituitary extracts for spawning induction in teleosts. Ciência Rural, 30, 897–898. [CrossRef] [Google Scholar]
- Bennett, M.V., Fox, S. (1962). Electrophysiology of caudal neurosecretory cells in the skate and fluke. Gen Comp Endocrinol, 2, 77–95. [CrossRef] [PubMed] [Google Scholar]
- Berlind, A. (1972). Teleost caudal neurosecretory system: sperm duct contraction induced by urophysial material. J Endocrinol, 52, 567–574. [Google Scholar]
- Bern, H.A. (1985a). The elusive urophysis – Twenty-five years in pursuit of caudal neurohormones. Am Zool, 25, 763–770. [CrossRef] [Google Scholar]
- Bern, H.A. (1985b). Osmoregulation function of the urotensins. In: Lofts B., Holmes W.N. (eds.). Currents Trends in Comparative Endocrinology. Hong Kong University Press, pp. 897–899. [Google Scholar]
- Bern, H.A., Takasugi, N. (1962). The caudal neurosecretory system of fishes. Gen Comp Endocrinol, 2, 96–110. [CrossRef] [PubMed] [Google Scholar]
- Bern, H.A., Nishioka, R.S. (1979). The caudal neurosecretory system and osmoregulation. Gunma Symp Endocrinol, 16, 9–17. [Google Scholar]
- Bern, H.A., Pearson, D., Larson, B.A., Nishioka, R.S. (1985). Neurohormones from fish tails: The caudal neurosecretory system. I: Urophysiology and the caudal neurosecretory system of fishes. Rec Prog Horm Res, 41, 533–552. [Google Scholar]
- Bernier, N.J., Alderman, S.L., Bristow, E.N. (2008). Heads or tails? Stressor-specific expression of corticotropin-releasing factor and urotensin I in the preoptic area and caudal neurosecretory system of rainbow trout. J Endocrinol, 196, 637–648. [CrossRef] [PubMed] [Google Scholar]
- Bond, H., Winter, M.J., Warne, J.M., McCrohan, C.R., Balment, R.J. (2002). Plasma concentrations of arginine vasotocin and urotensin II are reduced following transfer of the euryhaline flounder (Platichthys flesus) from seawater to fresh water. Gen Comp Endocrinol, 125, 113–120. [CrossRef] [PubMed] [Google Scholar]
- Brady, D.R. (1984). Caudal neurosecretory system of the paddlefish Polyodon spathula. A light microscopic study. Zool Am, 213, 215–223. [Google Scholar]
- Brierley, M.J., Bauer, C.S., Lu, W., Riccardi, D., Balment, R.J., McCrohan, C.R. (2004). Voltage- and Ca2+-dependent burst generation in neuroendocrine Dahlgren cells in the teleost Platichthys flesus. J Neuroendocrinol, 16, 832–841. [CrossRef] [PubMed] [Google Scholar]
- Cardoso, J.C., Bergqvist, C.A., Félix, R.C., Larhammar, D. (2016). Corticotropin-releasing hormone family evolution: five ancestral genes remain in some lineages. J Mol Endocrinol, 57, 73–86. [Google Scholar]
- Cardoso, J.C., Bergqvist, C.A., Larhammar, D. (2020). Corticotropin-Releasing Hormone (CRH) gene family duplications in lampreys correlate with two early vertebrate genome doublings. Front Neurosci, 14, 672. [CrossRef] [PubMed] [Google Scholar]
- Chan, D.K., Bern, H.A. (1976). The caudal neurosecretory system. A critical evaluation of the two-hormone hypothesis. Cell Tissue Res, 174, 339–354. [CrossRef] [PubMed] [Google Scholar]
- Chen, H., Mu, R. (2008). Seasonal morphological and biochemical changes of Dahlgren cells implies a potential role of the caudal neurosecretory system (CNSS) in the reproduction cycle of teleostean fish. Fish Physiol Biochem, 34, 37–42. [CrossRef] [PubMed] [Google Scholar]
- Chester-Jones, I., Chan, D.K., Rankin, J.C. (1969). Renal function in the European eel (Anguilla anguilla L.): effects of the caudal neurosecretory system, corpuscles of Stannius, neurohypophysial peptides and vasoactive substances. J Endocrinol, 43, 21–31. [CrossRef] [PubMed] [Google Scholar]
- Chevalier, G. (1976). Ultrastructural changes in the caudal neurosecretory cells of the trout Salvelinus fontinalis in relation to external salinity. Gen Comp Endocrinol, 29, 441–454. [CrossRef] [PubMed] [Google Scholar]
- Cioni, C., Greco, A., Pepe, A., De Vito, L., Colasanti, M. (1997). Nitric oxide synthase in the caudal neurosecretory system of the teleost Oreochromis niloticus. Neurosci Lett, 238, 57–60. [CrossRef] [PubMed] [Google Scholar]
- Cioni, C., De Vito, L., Greco, A., Pepe, A. (1998). The caudal neurosecretory system and its afferent synapses in the goldfish, Carassius auratus: morphology, immunohistochemistry, and fine structure. J Morphol, 235, 59–76. [CrossRef] [PubMed] [Google Scholar]
- Cioni, C., Francia, N., Greco, A., De Vito, L., Bordieri, L., Crosetti, D. (2000). Development of the caudal neurosecretory system of the nile tilapia Oreochromis niloticus: an immunohistochemical and electron microscopic study. J Morphol, 243, 209–218. [CrossRef] [PubMed] [Google Scholar]
- Cioni, C., Bordieri, L., De Vito, L. (2002). Nitric oxide and neuromodulation in the caudal neurosecretory system of teleosts. Comp Biochem Physiol B Biochem Mol Biol, 132, 57–68. [CrossRef] [PubMed] [Google Scholar]
- Cioni, C., Angiulli, E., Toni, M. (2019). Nitric oxide and the neuroendocrine control of the osmotic stress response in teleosts. Int J Mol Sci, 20, 489. [CrossRef] [PubMed] [Google Scholar]
- Conlon, J.M., Balment, R.J. (1996). Synthesis and release of acetylcholine by the isolated perifused trout caudal neurosecretory system. Gen Comp Endocrinol, 103, 36–40. [CrossRef] [PubMed] [Google Scholar]
- Coulouarn, Y., Lihrmann, I., Jegou, S., Anouar, Y., Tostivint, H., Beauvillain, J.C., Conlon, J.M., Bern, H.A., Vaudry H. (1998). Cloning of the cDNA encoding the urotensin II precursor in frog and human reveals intense expression of the urotensin II gene in motoneurons of the spinal cord. Proc Natl Acad Sci USA, 95, 15803–15808. [CrossRef] [PubMed] [Google Scholar]
- Coulouarn, Y., Jégou, S., Tostivint, H., Vaudry, H., Lihrmann, I. (1999). Cloning, sequence analysis and tissue distribution of the mouse and rat urotensin II precursors. FEBS Lett, 457, 28–32. [CrossRef] [PubMed] [Google Scholar]
- Craig, P.M., Al-Timimin H., Bernier, N.J. (2005). Differential increase in forebrain and caudal neurosecretory system corticotropin-releasing factor and urotensin I gene expression associated with seawater transfer in rainbow trout. Endocrinology, 146, 3851–3860. [CrossRef] [PubMed] [Google Scholar]
- Dahlgren, U. (1914). The electric motor nerve centers in the skates (Rajidae). Science, 1041, 862–863. [CrossRef] [PubMed] [Google Scholar]
- Dubessy, C., Cartier, D., Lectez, B., Bucharles, C., Chartrel, N., Montero-Hadjadje, M., Bizet, P., Chatenet, D., Tostivint, H., Scalbert, E., Leprince, J., Vaudry, H., Jégou, S., Lihrmann, I. (2008). Characterization of urotensin II, distribution of urotensin II, urotensin II-related peptide and UT receptor mRNAs in mouse: evidence of urotensin II at the neuromuscular junction. J Neurochem, 107, 361–374. [CrossRef] [PubMed] [Google Scholar]
- Egginger, J.G., Camus, A., Calas, A. (2006). Urotensin-II expression in the mouse spinal cord. J Chem Neuroanat, 31, 146–154. [CrossRef] [PubMed] [Google Scholar]
- Endsin, M.J., Michalec, O., Manzon, L.A., Lovejoy, D.A., Manzon, R.G. (2017) CRH peptide evolution occurred in three phases: evidence from characterizing sea lamprey CRH system members. Gen Comp Endocrinol, 240, 162–173. [CrossRef] [PubMed] [Google Scholar]
- Enami, M. (1955). Caudal neurosecretory system in the eel (Anguilla japonica). Gunma Med Sci, 4, 23–36. [Google Scholar]
- Enami, M. (1956). Changes in the caudal neurosecretory system of the loach (Misgurnus anguillicaudatus) in response to osmotic stimuli. Proc Jap Acad, 32, 759–764. [CrossRef] [Google Scholar]
- Enami, M. (1959). The morphology and functional significance of the caudal neurosecretory system of fishes. In: Gorbman A. (ed.). Comparative Endocrinology. New York: John Wiley, pp. 697–724. [Google Scholar]
- Enami, M., Miyashita, S., Imai, K. (1956). Studies on neurosecretion. IX. Possibility of occurrence of a sodium-regulating hormone in the caudal neurosecretory system of teleosts. Endocrinol Jap, 3, 280–290. [CrossRef] [PubMed] [Google Scholar]
- Evans, D.H., Hyndman, K.A., Cornwell, E., Buchanan, P. (2011). Secretion into the cerebrospinal fluid by caudal neurokillifish gill: regulators of NaCl extrusion. J Exp Biol, 214, 3985–3991. [CrossRef] [PubMed] [Google Scholar]
- Favaro, G. (1925) Contributi allo studio morfologico dell’ipofisi caudale dei teleostei. Mem Classe Sci Fis Mat Nat, 6, 30–72. [Google Scholar]
- Fridberg, G. (1959). A histological evidence of the homology between Dahlgren’s cells in rays and teleosts. Acta Zool, 40, 101–104. [CrossRef] [Google Scholar]
- Fridberg, G. (1962a). Studies on the caudal neurosecretory system in teleosts. Acta Zool, 43, 1–77. [CrossRef] [Google Scholar]
- Fridberg, G. (1962b). The caudal neurosecretory system in some elasmobranchs. Gen Comp Endocrinol, 2, 249–265. [CrossRef] [PubMed] [Google Scholar]
- Fridberg, G., Nishioka, R.S. (1966). Secretion into the cerebrospinal fluid by caudal neurosecretory neurons. Science, 152, 90–91. [CrossRef] [PubMed] [Google Scholar]
- Fridberg, G., Bern, H.A. (1968). The urophysis and the caudal neurosecretory system of fishes. Biol Rev, 43, 175–199. [CrossRef] [PubMed] [Google Scholar]
- Fridberg, G., Bern, H.A., Nishioka, R.S. (1966a). The caudal neurosecretory system of the isospondylous teleost, Albula vulpes, from different habitats. Gen Comp Endocrinol, 6, 195–212. [PubMed] [Google Scholar]
- Fridberg, G., Nishioka, R.S., Bern, H.A., Fleming, W.R. (1966b). Regeneration of the caudal neurosecretory system in the cichlid teleost Tilapia mossambica. J Exp Zool, 162, 311–335. [CrossRef] [Google Scholar]
- Fryer, J.N., Woo, N.Y., Gunther, R.L., Bern, H.A. (1978). Effect of urophysial homogenates on plasma ion levels in Gillichthys mirabilis (Teleostei:Gobiidae). Gen Comp Endocrinol, 35, 238–244. [CrossRef] [PubMed] [Google Scholar]
- Gabe, M. (1966). Neurosecretion. Pergamon Press. [Google Scholar]
- Gainer, H. (2012). Cell-type specific expression of oxytocin and vasopressin genes: an experimental odyssey. J Neuroendocrinol, 24, 528–538. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Gozdowska, M., Ślebioda, M., Kulczykowska, E. (2013). Neuropeptides isotocin and arginine vasotocin in urophysis of three fish species. Fish Physiol Biochem, 39, 863–869. [CrossRef] [PubMed] [Google Scholar]
- Grau, E.G., Nishioka, R.S., Bern, H.A. (1982). Effects of somatostatin and urotensin II on tilapia pituitary prolactin release and interactions between somatostatin, osmotic pressure Ca++, and adenosine 3’,5’-monophosphate in prolactin release in vitro. Endocrinology, 110, 910–915. [CrossRef] [PubMed] [Google Scholar]
- Greenwood, M.P., Flik, G., Wagner, G.F., Balment, R.J. (2009). The corpuscles of Stannius, calcium-sensing receptor, and stanniocalcin: responses to calcimimetics and physiological challenges. Endocrinology, 150, 3002–3010. [CrossRef] [PubMed] [Google Scholar]
- Holmgren, U. (1959). On the caudal neurosecretory system of the teleost fish, Fundulus heteroclitus. Anat Rec, 132, 454–455. [Google Scholar]
- Holmgren, U. (1964). Neurosecretion in teleost fishes: the caudal neurosecretory system. Am Zool, 4, 37–45. [CrossRef] [PubMed] [Google Scholar]
- Honma, Y., Tamura, E. (1967). Studies on Japanese chars of the genus Salvelinus IV. The caudal neurosecretory system of the Nikkoiwana, Salvelinus leucomaenis pluvius (Hilgendorf). Gen Comp Endocrinol, 9, 1–9. [CrossRef] [PubMed] [Google Scholar]
- Hubbard, P.C., Balment, R.J., McCrohan, C.R. (1996). Adrenergic receptor activation hyperpolarizes the caudal neurosecretory cells of the flounder, Platichthys flesus. J Neuroendocrinol, 8, 153–159. [CrossRef] [PubMed] [Google Scholar]
- Hughes, L.C., Ortí, G., Huang, Y., Sun, Y., Baldwin, C.C., Thompson, A.W., Arcila, D., Betancur, R. R., Li, C., Becker, L., Bellora, N., Zhao, X., Li, X., Wang, M., Fang, C., Xie, B., Zhou, Z., Huang, H., Chen, S., Venkatesh, B., Shi, Q. (2018). Comprehensive phylogeny of ray-finned fishes (Actinopterygii) based on transcriptomic and genomic data. Proc Natl Acad Sci USA, 115, 6249–6254. [CrossRef] [PubMed] [Google Scholar]
- Ichikawa, T. (1978). Acetylcholine in the urophysis of several species of teleosts. Gen Comp Endocrinol, 35, 226–233. [CrossRef] [PubMed] [Google Scholar]
- Ichikawa, T., Pearson, D., Yamada, C., Kobayashi, H. (1986). The caudal neurosecretory system of fishes. Zool Sci 3, 585–598. [Google Scholar]
- Ichikawa, T., Ishida, I., Ohsako, S., Deguchi, T. (1988). In situ hybridization demonstrating coexpression of urotensins I, II-alpha, and II-gamma in the caudal neurosecretory neurons of the carp, Cyprinus carpio. Gen Comp Endocrinol, 71, 493–501. [CrossRef] [PubMed] [Google Scholar]
- Imai, K., Stanley, J.G., Fleming, W.R., Bern, H.A. (1965). On the suggested ionoregulatory role of the teleost caudal neurosecretory system. Proc Soc Exp Biol Med, 118, 1102–1106. [CrossRef] [Google Scholar]
- Ingleton, P.M., Bendell, L.A., Flanagan, J.A., Teitsma, C., Balment, R.J. (2002). Calcium-sensing receptors and parathyroid hormone-related protein in the caudal neurosecretory system of the flounder (Platichthys flesus). J Anat, 200, 487–497. [CrossRef] [PubMed] [Google Scholar]
- Ishida, I., Ichikawa, T., Deguchi, T. (1986). Cloning and sequence analysis of cDNA encoding urotensin I precursor. Proc Natl Acad Sci USA, 83, 308–312. [CrossRef] [PubMed] [Google Scholar]
- Jaiswal, A.G., Belsare, D.K. (1974). Regeneration of the caudal neurosecretory system in the catfish, Clarias batrachus L. Z Mikrosk Anat Forsch, 88, 987–996. [PubMed] [Google Scholar]
- Jiang, P., Pan, X., Zhang, W., Dai, Z., Lu, W. (2021). Neuromodulatory effects of GnRH on the caudal neurosecretory Dahlgren cells in female olive flounder. Gen Comp Endocrinol, 307, 113754. [CrossRef] [PubMed] [Google Scholar]
- Kalamarz-Kubiak, H., Ashkenazi, I.M., Kleszczyńska, A., Rosenfeld, H. (2014) Urotensin II inhibits arginine vasotocin and stimulates isotocin release from nerve endings in the pituitary of gilthead sea bream (Sparus aurata). J Exp Zool A Ecol Genet Physiol, 321, 467–471. [CrossRef] [PubMed] [Google Scholar]
- Kelsall, C.J., Balment, R.J. (1998). Native urotensins influence cortisol secretion and plasma cortisol concentration in the euryhaline flounder, Platichthys flesus. Gen Comp Endocrinol, 112, 210–219. [CrossRef] [PubMed] [Google Scholar]
- Kobayashi, Y., Ichikawa, T., Kobayashi, J. (1979). Innervation of the caudal neurosecretory system of the teleost. Gunma Sym Endocrinol, 16, 81–86. [Google Scholar]
- Kobayashi, Y., Kobayashi, H., Ohshiro, S., Osume, Y., Fujiwara, M. (1980). Monoaminergic innervation of the caudal neurosecretory system of the carp, Cyprinus carpio. Zbl Vet C Anat Histol Embryol, 9, 65–72. [CrossRef] [PubMed] [Google Scholar]
- Kobayashi, H., Owada, K., Yamada, C., Okawara, Y. (1986). The caudal neurosecretory system in fishes. In: Pang P.K.T., Schreibman M.P. (eds.). Vertebrate Endocrinology. New York, London: Academic Press, pp. 147–174. [Google Scholar]
- Lacanilao, F. (1972). The urophysial hydrosmotic factor of fishes. I. Characteristics and similarity to neurohypophysial hormones. Gen Comp Endocrinol, 19, 405–412. [CrossRef] [PubMed] [Google Scholar]
- Lan, Z., Zhang, W., Xu, J., Zhou, M., Chen, Y., Zou, H., Lu, W. (2018a). Modulatory effect of dopamine receptor 5 on the neurosecretory Dahlgren cells of the olive flounder, Paralichthys olivaceus. Gen Comp Endocrinol, 266, 67–77. [CrossRef] [PubMed] [Google Scholar]
- Lan, Z., Xu, J., Wang, Y., Lu, W. (2018b). Modulatory effect of glutamate GluR2 receptor on the caudal neurosecretory Dahlgren cells of the olive flounder, Paralichthys olivaceus. Gen Comp Endocrinol, 261, 9–22. [CrossRef] [PubMed] [Google Scholar]
- Lan, Z., Zhang, W., Xu, J., Lu, W. (2021). GABAA receptor-mediated inhibition of Dahlgren cells electrical activity in the olive flounder, Paralichthys olivaceus. Gen Comp Endocrinol, 306, 113753. [CrossRef] [PubMed] [Google Scholar]
- Larson, B.A., Bern, H.A. (1987). The urophysis and osmoregulation. In: Pang P.K.T., Schreibman M.P. (eds.). Vertebrate Endocrinology: Fundamentals and Biomedical Implications, Vol. 2. Orlando, FL: Academic Press, pp. 143–156. [Google Scholar]
- Le Mevel, J.C., Olson, K.R., Conklin, D., Waugh, D., Smith, D.D., Vaudry, H., Conlon, J.M. (1996) Cardiovascular actions of trout urotensin II in the conscious trout, Oncorhynchus mykiss. Am J Physiol, 271, R1335–1343. [PubMed] [Google Scholar]
- Lederis, K. (1970). Active substances in the caudal neurosecretory system of bony fishes. Memb Soc Endocrinol, 18, 465–484 [Google Scholar]
- Lederis, K., Letter, A., McMaster, D., Moore, G., Schlesinger, D. (1982). Complete amino acid sequence of urotensin I, a hypotensive and corticotropin-releasing neuropeptide from Catostomus. Science, 218, 162–165. [CrossRef] [PubMed] [Google Scholar]
- Leng, G., Brown, C.H., Russell, J.A. (1999). Physiological pathways regulating the activity of magnocellular neurosecretory cells. Prog Neurobiol, 57, 625–655. [CrossRef] [PubMed] [Google Scholar]
- Leonard, J.B.K., Bartley, S.M., Taylor, M.H. (1993). Effects of ions and bioactive substances on ovarian contraction in Fundulus heteroclitus. J Exp Zool, 267, 468–473. [CrossRef] [Google Scholar]
- Loretz, C.A., Bern, H.A. (1981). Stimulation of sodium transport across the teleost urinary bladder by urotensin II. Gen Comp Endocrinol, 43, 325–330. [CrossRef] [PubMed] [Google Scholar]
- Loretz, C.A., Freel, R.W., Bern, H.A. (1983). Specificity of response of intestinal ion transport systems to a pair of natural peptide hormone analogs: somatostatin and urotensin II. Gen Comp Endocrinol, 52, 198–206. [CrossRef] [PubMed] [Google Scholar]
- Lovejoy, D.A., de Lannoy, L. (2013). Evolution and phylogeny of the corticotropin-releasing factor (CRF) family of peptides: expansion and specialization in the vertebrates. J Chem Neuroanat, 54, 50–56. [CrossRef] [PubMed] [Google Scholar]
- Lu, W., Dow, L., Gumusgoz, S., Brierley, M.J., Warne, J.M., McCrohan, C.R., Balment, R.J., Riccardi, D. (2004). Coexpression of corticotropin-releasing hormone and urotensin I precursor genes in the caudal neurosecretory system of the euryhaline flounder (Platichthys flesus): a possible shared role in peripheral regulation. Endocrinology, 145, 5786–5797. [CrossRef] [PubMed] [Google Scholar]
- Lu, W., Greenwood, M., Dow, L., Yuill, J., Worthington, J., Brierley, M.J. McCrohan, C.R., Riccardi, D., Balment, R.J. (2006). Molecular characterization and expression of urotensin II and its receptor in the flounder (Platichthys flesus): a hormone system supporting body fluid homeostasis in euryhaline fish. Endocrinology, 147, 3692–3708. [CrossRef] [PubMed] [Google Scholar]
- Lu, W., Worthington, J., Riccardi, D., Balment, R.J., McCrohan, C.R. (2007). Seasonal changes in peptide, receptor and ion channel mRNA expression in the caudal neurosecretory system of the European flounder (Platichthys flesus). Gen Comp Endocrinol, 153, 262–272. [CrossRef] [PubMed] [Google Scholar]
- Lu, W., Jin, Y., Xu, J., Greenwood, M.P., Balment, R.J. (2017). Molecular characterisation and expression of parathyroid hormone-related protein in the caudal neurosecretory system of the euryhaline flounder, Platichthys flesus. Gen Comp Endocrinol, 249, 24–31. [CrossRef] [PubMed] [Google Scholar]
- Lu, W., Zhu, G., Chen, A., Li, X., McCrohan, C.R., Balment R.J. (2019). Gene expression and hormone secretion profile of urotensin I associated with osmotic challenge in caudal neurosecretory system of the euryhaline flounder, Platichthys flesus. Gen Comp Endocrinol, 277, 49–55. [CrossRef] [PubMed] [Google Scholar]
- Maetz, J., Bourquet, J., Lahlou, B. (1964). Urophyse et osmoregulation chez Carassius auratus. Gen Comp Endocrinol, 4, 401–414. [CrossRef] [PubMed] [Google Scholar]
- Mainoya, J.R., Bern, H.A. (1982). Effects of teleost urotensins on intestinal absorption of water and NaCl in tilapia, Sarotherodon mossambicus, adapted to fresh water or seawater. Gen Comp Endocrinol, 47, 54–58. [CrossRef] [PubMed] [Google Scholar]
- Marley, R., Lu, W., Balment, R.J., McCrohan, C.R. (2007). Evidence for nitric oxide role in the caudal neurosecretory system of the European flounder, Platichthys flesus. Gen Comp Endocrinol, 153, 251–261. [CrossRef] [PubMed] [Google Scholar]
- Marshall, W.S., Bern, H.A. (1979). Teleostean urophysis: urotensin II and ion transport across the isolated skin of a marine teleost. Science, 204, 519–521. [CrossRef] [PubMed] [Google Scholar]
- Marshall, W.S., Bern, H.A. (1981). Active chloride transport by the skin of a marine teleost is stimulated by urotensin I and inhibited by urotensin II. Gen Comp Endocrinol, 43, 484–491. [CrossRef] [PubMed] [Google Scholar]
- McCrohan, C.R., Lu, W., Brierley, M.J., Dow, L., Balment, R.J. (2007). Fish caudal neurosecretory system: a model for the study of neuroendocrine secretion. Gen Comp Endocrinol, 153, 243–250. [CrossRef] [PubMed] [Google Scholar]
- McKeon, T.W., Cohen, S.L., Black, E.E., Kriebel, R.M., Parsons, R.L. (1988). Monoamines in the caudal neurosecretory complex: biochemistry and immunohistochemistry. Brain Res Bull, 21, 37–42. [CrossRef] [PubMed] [Google Scholar]
- Miller, K.E., Kriebel, R.M. (1986). Peptidergic innervation of caudal neurosecretory neurons. Gen Comp Endocrinol, 64, 396–400. [CrossRef] [PubMed] [Google Scholar]
- Millot, J., Anthony, J. (1965). Anatomie de Latimeria chalumnae, Tome II : Système Nerveux et Organes des Sens (pp. 1–130). Paris : CNRS. [Google Scholar]
- Mimura, O.M., Amaez, R.H. 1980. Sistema neurosecretor caudal de Poecilia vivipara (Pisces, Teleostei, Cyprinodontiformes) e concentração osmótica. Bolm Fisiol Animal USP, 5, 99–106. [Google Scholar]
- Morita, H., Ishibashi, T., Yamashita, S. (1961). Synaptic transmission in neurosecretory cells. Nature, 191, 183. [CrossRef] [PubMed] [Google Scholar]
- Munro, A.D. (1995). Possible functions of the caudal neurosecretory system. Rev Fish Biol Fisheries, 5, 447–454 [CrossRef] [Google Scholar]
- O’Brien, J.P., Kriebel, R.M. (1982). Brain stem innervation of the caudal neurosecretory system. Cell Tissue Res, 227, 153–160. [PubMed] [Google Scholar]
- Ohsako, S., Ishida, I., Ichikawa, T., Deguchi, T. (1986). Cloning and sequence analysis of cDNAs encoding precursors of urotensin II-alpha and -gamma. J Neurosci, 6, 2730–2735. [CrossRef] [PubMed] [Google Scholar]
- Onstott, D., Elde, R. (1986a). Coexistence of urotensin I/corticotropin-releasing factor and urotensin II immunoreactivities in cells of the caudal neurosecretory system of a teleost and an elasmobranch fish. Gen Comp Endocrinol, 63, 295–300. [CrossRef] [PubMed] [Google Scholar]
- Onstott, D., Elde, R. (1986b). Immunohistochemical localization of urotensin I/corticotropin-releasing factor, urotensin II, and serotonin immunoreactivities in the caudal spinal cord of nonteleost fishes. J Comp Neurol, 249, 205–225. [CrossRef] [PubMed] [Google Scholar]
- Oka, S., Chiba, A., Honma, Y., Iwanaga, T., Fujita, T. (1993). Development of the caudal neurosecretory system of the chum salmon, Oncorhynchus keta, as revealed by immunohistochemistry for urotensins I and II. Cell Tissue Res, 272, 221–226. [CrossRef] [Google Scholar]
- Oka, S., Chiba, A., Honma, Y. (1997). Structures immunoreactive with porcine NPY in the caudal neurosecretory system of several fishes and cyclostomes. Zool Sci, 14, 665–669. [CrossRef] [Google Scholar]
- Okawara, Y., Morley, S.D., Burzio, L.O., Zwiers, H., Lederis, K., Richter, D. (1988). Cloning and sequence analysis of cDNA for corticotropin-releasing factor precursor from the teleost fish Catostomus commersoni. Proc Natl Acad Sci USA, 85, 8439–8443. [CrossRef] [PubMed] [Google Scholar]
- Owada, K., Yamada, C., Kobayashi, H. (1985). Immunohistochemical investigation of urotensins in the caudal spinal cord of four species of elasmobranchs and the lamprey, Lampetra japonica. Cell Tissue Res, 242, 527–530. [CrossRef] [PubMed] [Google Scholar]
- Parmentier, C., Taxi, J., Balment, R.J., Nicolas, G., Calas, A. (2006). Caudal neurosecretory system of the zebrafish: ultrastructural organization and immunocytochemical detection of urotensins. Cell Tissue Res, 325, 111–124. [CrossRef] [PubMed] [Google Scholar]
- Parmentier, C., Hameury, E., Lihrmann, I., Taxi, J., Hardin-Pouzet, H., Vaudry, H., Calas, A., Tostivint, H. (2008). Comparative distribution of the mRNAs encoding urotensin I and urotensin II in zebrafish. Peptides, 29, 820–829. [CrossRef] [PubMed] [Google Scholar]
- Parmentier, C., Hameury, E., Dubessy, C., Quan, F.B., Habert, D., Calas, A., Vaudry, H., Lihrmann, I., Tostivint, H. (2011). Occurrence of two distinct urotensin II-related peptides in zebrafish provides new insight into the evolutionary history of the urotensin II gene family. Endocrinology, 152, 2330–2341. [CrossRef] [PubMed] [Google Scholar]
- Pearson, D., Shively, J.E., Clark, B.R., Geschwind, I.I., Barkley, M., Nishioka R.S., Bern, H.A. (1980). Urotensin II: a somatostatin-like peptide in the caudal neurosecretory system of fishes. Proc Natl Acad Sci USA, 77, 5021–5024. [CrossRef] [PubMed] [Google Scholar]
- Quan, F.B., Dubessy, C., Galant, S., Kenigfest, N.B., Djenoune, L., Leprince, J., Wyart, C., Lihrmann, I., Tostivint, H. (2015). Comparative distribution and in vitro activities of the urotensin II-related peptides URP1 and URP2 in zebrafish: evidence for their colocalization in spinal cerebrospinal fluid-contacting neurons. PLoS One, 10, e0119290. [CrossRef] [PubMed] [Google Scholar]
- Rivas, R.J., Nishioka, R.S., Bern, H.A. (1986). In vitro effects of somatostatin and urotensin II on prolactin and growth hormone secretion in tilapia, Oreochromis mossambicus. Gen Comp Endocrinol, 63, 245–251. [CrossRef] [PubMed] [Google Scholar]
- Sano, Y., Kawamoto, M. (1959). Entwicklungsgeschichtliche beobachtungen an der neurophysis spinalis caudalis von Lebistes reticulatus Peters. Z Zellforsch, 51, 56–64. [CrossRef] [Google Scholar]
- Sano, Y., Hamana, K., Kawamoto, M. (1962). Uber die segmentale Ausbildung der Neurophysis spinalis caudalis bei einigen Fisharten. Z Zellforsh, 57, 881–887. [CrossRef] [Google Scholar]
- Scharrer, E., Scharrer, B. (1945). Neurosecretion. Physiol Rev, 25, 171–181. [CrossRef] [Google Scholar]
- Sheridan, M.A., Bern, H.A. (1986). Both somatostatin and the caudal neuropeptide, urotensin II, stimulate lipid mobilization from coho salmon liver incubated in vitro. Regul Pept, 14, 333–344. [CrossRef] [PubMed] [Google Scholar]
- Sheridan, M.A., Plisetskaya, E.M., Bern, H.A., Gorbman, A. (1987). Effects of somatostatin-25 and urotensin II on lipid and carbohydrate metabolism of coho salmon, Oncorhynchus kisutch. Gen Comp Endocrinol, 66, 405–414. [CrossRef] [PubMed] [Google Scholar]
- Speidel, C.C. (1919). Gland-cells of internal secretion of the spinal cord of skates. Pap Dept Marine Biol Carnegie Inst Wash, 13, 1–31. [Google Scholar]
- Speidel, C.C. (1922). Further comparative studies in other fishes of cells that are homologous to the large irregular glandular cells in the spinal cord of the skates. J Comp Neurol, 34, 303–317. [CrossRef] [Google Scholar]
- Summers, R.W. (1979). Life-cycle and population ecology of the flounder Platichthys flesus in the Ythan estuary, Scotland. J Nat Hist, 13, 703–723. [CrossRef] [Google Scholar]
- Sun, C., Duan, D., Li, B., Qin, C., Jia, J., Wang, B., Dong, H., Li, W. (2013). UII and UT in grouper: cloning and effects on the transcription of hormones related to growth control. J Endocrinol, 220, 35–48. [Google Scholar]
- Takasugi, N., Bern, H.A. (1962). Experimental studies on the caudal neurosecretory system of Tilapia mossambica. Comp Biochem Physiol, 6, 289–303. [CrossRef] [PubMed] [Google Scholar]
- Takei, Y., McCormick, S.D. (2013). Hormonal control of fish euryhalinity. In: McCormick, S.D., Farrell, A.P., Brauner, C. (eds.). Euryhaline Fishes. New York: Academic Press, pp. 70–123. [Google Scholar]
- Tostivint, H., Joly, L., Lihrmann, I., Parmentier, C., Lebon, A., Morisson, M., Calas, A., Ekker, M., Vaudry, H. (2006). Comparative genomics provides evidence for close evolutionary relationships between the urotensin II and somatostatin gene families. Proc Natl Acad Sci USA, 103, 2237–2242. [CrossRef] [PubMed] [Google Scholar]
- Tostivint, H., Quan, F.B., Bougerol, M., Kenigfest, N.B., Lihrmann I. (2013). Impact of gene/genome duplications on the evolution of the urotensin II and somatostatin families. Gen Comp Endocrinol, 188, 110–117. [CrossRef] [PubMed] [Google Scholar]
- Tostivint, H., Ocampo Daza, D., Bergqvist, C.A., Quan, F.B., Bougerol, M., Lihrmann, I., Larhammar, D. (2014). Molecular evolution of GPCRs: Somatostatin/urotensin II receptors. J Mol Endocrinol, 52, T61–86. [CrossRef] [PubMed] [Google Scholar]
- Tsuneki, K., Kobayashi, H. (1979). Regeneration of the caudal neurosecretory cells in the teleosts, Misgurnus anguillicaudatus and Oryzias latipes. Gunma Symp Endocrinol, 16, 69–79. [Google Scholar]
- Turtle, M.J. (1974). Effect of urophysectomy and preoptic nucleus lesioning on ionic and osmotic regulation in the goldfish (Carassius auratus). M.Sc. Thesis in Zoology, University of Alberta, Edmonton. [Google Scholar]
- Vaudry, H., Leprince, J., Chatenet, D., Fournier, A., Lambert, D.G., Le Mével, J.C., Ohlstein, E.H., Schwertani, A., Tostivint, H., Vaudry, D. (2015). International Union of Basic and Clinical Pharmacology. XCII. Urotensin II, urotensin II-related peptide, and their receptor: from structure to function. Pharmacol Rev, 67, 214–258. [CrossRef] [PubMed] [Google Scholar]
- Vaughan, J., Donaldson, C., Bittencourt, J., Perrin, M.H., Lewis, K., Sutton, S., Chan, R., Turnbull, A.V., Lovejoy, D., Rivier, C., Rivier, J., Sawchenko, P.E., Vale, W. (1995). Urocortin, a mammalian neuropeptide related to fish urotensin I and to corticotropin-releasing factor. Nature, 378, 287–292. [CrossRef] [PubMed] [Google Scholar]
- Vigh, B., Vigh-Teichmann, I. (1998). Actual problems of the cerebrospinal fluid-contacting neurons. Microsc Res Tech, 41, 57–83. [CrossRef] [PubMed] [Google Scholar]
- Waugh, D., Youson, J., Mims, S.D., Sower, S., Conlon, J.M. (1995). Urotensin II from the river lamprey (Lampetra fluviatilis), the sea lamprey (Petromyzon marinus), and the paddlefish (Polyodon spathula). Gen Comp Endocrinol, 99, 323–332. [CrossRef] [PubMed] [Google Scholar]
- Weber, E.H. (1827). Knoten und unpaarer Faden, mit dem sich das Rückenmark bei einigen Fishen endigt, namentlich beim Cyprinus carpio. Arch Anat Physiol, 2, 316–317. [Google Scholar]
- Winter, M.J., Ashworth, A., Bond, H., Brierley, M.J., McCrohan, C.R., Balment, R.J. (2000). The caudal neurosecretory system: control and function of a novel neuroendocrine system in fish. Biochem Cell Biol, 78, 193–203. [CrossRef] [PubMed] [Google Scholar]
- Woo, N.Y., Tong, W.C., Chan, E.L. (1980). Effects of urophysial extracts on plasma electrolyte and metabolite levels in Ophiocephalus maculatus. Gen Comp Endocrinol, 41, 458–466. [CrossRef] [PubMed] [Google Scholar]
- Yagi, K., Bern, H.A. (1965). Electrophysiologic analysis of the response of the caudal neurosecretory system of Tilapia mossambica to osmotic manipulations. Gen Comp Endocrinol, 5, 509–526. [CrossRef] [PubMed] [Google Scholar]
- Yamada, C., Mikami, S., Kuraishi, Y., Kobayashi, H. (1988). Immunoreactive methionine-enkephalin in the caudal neurosecretory system of the carp, Cyprinus carpio. Cell Tissue Res, 253, 485–487. [CrossRef] [PubMed] [Google Scholar]
- Yeung, B.H., Law, A.Y., Wong, C.K. (2012). Evolution and roles of stanniocalcin. Mol Cell Endocrinol, 349, 272–280. [CrossRef] [PubMed] [Google Scholar]
- Yuan, M., Li, X., Long, T., Chen, Y., Lu, W. (2020a). Dynamic responses of the caudal neurosecretory system (CNSS) under thermal stress in olive flounder (Paralichthys olivaceus). Front Physiol, 10, 1560. [CrossRef] [PubMed] [Google Scholar]
- Yuan, M., Li, X., Lu, W. (2020b). The caudal neurosecretory system: a novel thermosensitive tissue and its signal pathway in olive flounder (Paralichthys olivaceus). J Neuroendocrinol, 32, e 12876. [CrossRef] [Google Scholar]
- Yulis, C.R., Lederis, K. (1986). Extraurophyseal distribution of urotensin II immunoreactive neuronal perikarya and their processes. Proc Natl Acad Sci USA, 83, 7079–7083. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Tostivint, H., Girardot, F., Parmentier, C., et Pézeron, G. (2022). Le système neurosécréteur caudal, l’autre système « neurohypophysaire » des poissons. Biologie Aujourd’hui, 216, 89-103
Liste des figures
 |
Figure 1 Organisation du système neurosécréteur caudal. (A) Représentation schématique du SNSC des poissons téléostéens (inspirée de Ichikawa et al., 1986). (B) Visualisation du SNSC de poisson-zèbre adulte par immunohistochimie. Le matériel immunoréactif de type UII apparaît fluorescent. Noter le gradient de taille décroissant des cellules de Dahlgren (CD) dans le sens rostro-caudal. Ax : faisceau d’axones neusécrétoires ; Ft : filum terminal ; ME : moelle épinière ; Uro : urophyse. Barre d’échelle : 50 μm. (C) Ultrastructure de l’urophyse de poisson-zèbre adulte. Deux catégories de granules de densité électronique différente peuvent être distinguées, qui semblent définir deux catégories de fibres neurosécrétrices, notées * et **, respectivement. f : fenestration ; L : lumière d’un capillaire sanguin ; LB : lame basale. Barre d’échelle : 1 μm. |
| Dans le texte | |
 |
Figure 2 Évolution du système neurosécréteur caudal chez les vertébrés. Les taxons qui possèdent un SNSC sont indiqués par le signe + et ceux qui en sont dépourvus, par un 0. Le point d’interrogation se rapporte à des taxons chez lesquels l’existence d’un SNSC reste incertaine. Les moments présumés de l’apparition et de la régression du SNSC sont signalés. Une illustration schématique du SNSC chez les élasmobranches (sans urophyse) et les téléostéens (avec urophyse) est également présentée. Dans le cas des téléostéens, deux organisations sont indiquées, l’une avec urophyse peu différenciée, et l’autre avec urophyse bien individualisée. Il est classiquement admis que l’organisation sans urophyse, avec une aire neuro-hémale diffuse, constitue un état primitif du SNSC. L’apparition de l’urophyse traduirait une tendance évolutive marquée par une condensation de plus en plus forte de l’aire neuro-hémale. Celle-ci aurait atteint son niveau maximal chez les néotéléostéens, mais aurait pu se produire à plusieurs reprises indépendamment, bien qu’à des degrés moindres, dans d’autres groupes de poissons (repérés par l’astérisque *). La partie droite de la figure est inspirée de Bern & Takasugi (1962). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


