| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 3-4, 2022
|
|
|---|---|---|
| Page(s) | 105 - 110 | |
| DOI | https://doi.org/10.1051/jbio/2022019 | |
| Publié en ligne | 6 février 2023 | |
Article
La prolactine et son récepteur : Des modèles animaux à la physiopathologie hypophysaire
Prolactin and its receptor: From animal models to pituitary pathophysiology
Service de chirurgie gynécologique, gynécologie médicale et de médecine de la reproduction, Centre Aliénor d’Aquitaine, CHU et Université de Bordeaux, Place Amélie Raba-Léon, 33076 Bordeaux Cedex, France
* Auteur correspondant : valerie.bernard@chu-bordeaux.fr
Reçu :
1
Septembre
2022
La prolactine (PRL), hormone de la lactation par excellence, est majoritairement synthétisée et sécrétée par les cellules lactotropes de l’antéhypophyse. Ses actions sont médiées par le récepteur transmembranaire de la prolactine (PRLR). Alors que plus de 300 fonctions différentes ont été attribuées à cette hormone selon les espèces, son rôle chez l’Homme reste limité au développement de la glande mammaire et à l’allaitement. Les pathologies en lien avec la PRL sont essentiellement celles rencontrées en cas d’hypersécrétion de cette hormone. En effet, l’hyperprolactinémie entraîne l’altération du fonctionnement de l’axe gonadotrope chez l’homme comme chez la femme. Ainsi, l’hyperprolactinémie est une étiologie fréquente d’hypogonadisme hypogonadotrope acquis et l’une des principales causes d’anovulation et d’infertilité chez la femme. Ces dernières années, les études de modèles murins invalidés pour le PRLR, de manière globale ou conditionnelle dans l’hypophyse, ont permis d’apporter de nouveaux éléments dans la compréhension de la régulation des axes gonadotrope et lactotrope. Il est maintenant démontré que la prolactine exerce des actions autocrines ou paracrines sur les cellules lactotropes in vivo. Une des avancées majeures a été de mieux comprendre, à l’aide des modèles murins, l’impact de l’hyperprolactinémie sur l’axe gonadotrope. C’est ainsi qu’il a pu être établi que, comme chez les rongeurs, l’hypogonadisme hypogonadotrope chez les patientes atteintes d’hyperprolactinémie est médié par un déficit de sécrétion de kisspeptine hypothalamique, et que l’axe gonadotrope peut être restauré par l’administration intraveineuse de kisspeptine. Les mécanismes de tumorigenèse lactotrope des animaux Prlr −/− restent cependant incomplètement compris et transposables dans l’espèce humaine, puisque, jusqu’à présent, l’unique patiente porteuse d’une mutation bi-allélique perte de fonction du PRLR ayant fait l’objet d’une publication présentait une imagerie hypophysaire sans anomalie.
Abstract
Prolactin (PRL) is a polypeptide hormone that is mainly synthesized and secreted by lactotroph cells of the anterior pituitary gland. The actions of prolactin are mediated by its transmembrane receptor, PRLR. The principal role attributed to PRL is to stimulate the proliferation and differentiation of the mammary cells required for lactation, but studies of animal models have assigned more than 300 separate actions to this hormone in various species. Hyperprolactinaemia is the prototypical pathological state associated with this hormone. Indeed, hyperprolactinaemia is the most common cause of amenorrhoea due to hypogonadotropic anovulation and is one of the most prevalent endocrine causes of infertility in women. In recent years, the study of conditional or complete Prlr −/− mouse models had improved the understanding concerning the regulation of gonadotroph and lactotroph axes. It is now demonstrated that prolactin exerts autocrine or paracrine actions on lactotroph cells in vivo. One of the major advances was to better understand, using mouse models, the impact of hyperprolactinemia on gonadotroph axis. It is now accepted that hypogonadotropic hypogonadism in patients with hyperprolactinemia is mediated by a decrease of hypothalamic kisspeptin secretion. Gonadotroph axis can be restored by intravenous administration of kisspeptin. However, the mechanisms of lactotroph tumorigenesis in Prlr −/− animals remain incompletely understood and transposable to the human species, since the only patient with biallelic PRLR loss-of-function mutation leading to complete prolactin resistance that has been described so far did not have pituitary adenoma visible on MRI.
Mots clés : prolactine / kisspeptine / hyperprolactinémie / prolactinome / hypophyse
Key words: prolactin / kisspeptin / hyperprolactinaemia / prolactinoma / pituitary
© Société de Biologie, 2023
Abréviations
D2R : Récepteur dopaminergique de type D2
PRLR : Récepteur de la prolactine
TIDA : Neurone tubéro-infundibulaire dopaminergique
Introduction
La prolactine (PRL) est majoritairement synthétisée et sécrétée par les cellules lactotropes de l’antéhypophyse. Alors que plus de 300 fonctions différentes ont été attribuées à cette hormone selon les espèces, chez l’Homme son rôle reste essentiellement limité au développement de la glande mammaire et à l’allaitement. Cependant, des taux élevés de PRL circulante sont responsables d’une altération du fonctionnement de l’axe gonadotrope chez l’homme comme chez la femme. Ainsi, l’hyperprolactinémie est une étiologie fréquente d’hypogonadisme hypogonadotrope acquis et l’une des principales causes d’anovulation et d’infertilité chez la femme. Ces dernières années, l’étude de modèles murins invalidés pour le récepteur de la prolactine (PRLR) de manière globale, ou conditionnelle dans l’hypophyse, a permis d’apporter de nouveaux éléments dans la compréhension de la régulation des axes gonadotrope et lactotrope. Après quelques rappels physiologiques sur la prolactine et son récepteur, nous aborderons les nouveautés concernant le lien entre hyperprolactinémie et infertilité, puis nous décrirons le rôle de la PRL dans l’homéostasie des cellules lactotropes.
Physiologie de la prolactine
La prolactine et son récepteur
La prolactine est une hormone synthétisée majoritairement par les cellules lactotropes qui représentent environ 20 % de la population cellulaire antéhypophysaire. C’est une hormone peptidique constituée de 199 acides aminés, correspondant à un poids moléculaire de 23 kDa (Freeman et al., 2000). La PRL a une grande homologie structurelle avec l’hormone de croissance et appartient à la grande famille des cytokines hématopoïétiques. Les nombreux variants protéiques de la PRL qui ont été identifiés dans le plasma et l’hypophyse résultent pour la plupart de modifications post-traductionnelles telles que la phosphorylation et la glycosylation (Walker, 2007). Bien que la PRL monomérique soit l’isoforme majoritaire dans la circulation sanguine, on retrouve également des formes oligomériques, résultant de la dimérisation non covalente de la PRL (forme appelée « big PRL »), et des assemblages de plus hauts poids moléculaires impliquant des immunoglobulines (formes appelées « big big PRL » ou « macroprolactine ») qui auraient peu d’activité biologique (Fahie-Wilson & Smith, 2013). Bien que la synthèse et la sécrétion de PRL soient majoritairement d’origine hypophysaire, il a été démontré que celles-ci pouvaient également avoir lieu dans des tissus et organes périphériques, par des mécanismes de régulation distincts (Marano & Ben-Jonathan, 2014). Parmi les différences existant entre la PRL hypophysaire (pPRL) et la PRL extra-hypophysaire (ePRL), l’ARN messager de l’ePRL contient 150 bases additionnelles, dues à la transcription d’un exon non codant sous le contrôle d’un promoteur distal (Gellersen et al., 1994). Quant à la transcription du gène de la pPRL, elle est régulée par un promoteur proximal appelé promoteur hypophysaire (Peers et al., 1990). Les structures protéiques des pPRL et ePRL sont en revanche identiques, et toutes deux lient le PRLR (Ben-Jonathan et al., 1996). Cependant, le rôle de l’ePRL est peu connu. Une fois libérée dans le sang, la PRL exerce ses différentes fonctions physiologiques essentiellement de manière endocrine en stimulant ses tissus cibles mais aussi de façon autocrine, en exerçant directement son action sur la cellule épithéliale mammaire par exemple.
Les effets biologiques de la PRL s’exercent par l’interaction de l’hormone avec son récepteur transmembranaire (PRLR), membre de la superfamille des récepteurs de cytokines hématopoïétiques de type 1. Il existe plusieurs isoformes de PRLR qui se caractérisent par des domaines extracellulaires identiques mais se différencient par la longueur de leur domaine cytoplasmique (Bole-Feysot et al., 1998). En plus de ces différentes isoformes membranaires, un PRLR soluble a été identifié, ne contenant que la partie extracellulaire du récepteur (Postel-Vinay et al., 1991). La principale isoforme de PRLR chez l’Homme est la forme longue de 598 acides aminés, quasi-ubiquitaire. L’activation du PRLR, tout comme celle des autres récepteurs de cytokines hématopoïétiques, a lieu par homodimérisation. On pensait que celle-ci était dépendante du ligand, mais il est maintenant établi que le PRLR est constitutivement exprimé sous forme d’homodimère à la surface des cellules (Gadd & Clevenger, 2006). La PRL vient ainsi se fixer à un homodimère de récepteurs préformé. La formation du complexe hormone/récepteur provoque un changement de conformation du dimère de PRLR, permettant la transduction du signal en aval (Waters et al., 2014), notamment via la voie canonique JAK2 (Janus Kinase 2)/Stat5 (Signal transducer and activator of transcription 5).
La régulation de la sécrétion de prolactine
La biosynthèse et la sécrétion de la PRL hypophysaire sont contrôlées essentiellement par des facteurs centraux hypothalamiques. Le contrôle hypothalamique de l’axe lactotrope est principalement inhibiteur, via la dopamine. Cette dernière est synthétisée par les neurones tubéro-infundibulaires dopaminergiques (TIDA) dont les corps cellulaires sont localisés dans les noyaux arqués hypothalamiques et dont les axones se projettent dans l’éminence médiane. La dopamine libérée dans le système porte hypothalamo-hypophysaire vient se lier aux récepteurs dopaminergiques de type D2 (D2R) présents à la surface des cellules lactotropes, inhibant ainsi la synthèse de PRL (Grattan, 2015). La PRL elle-même est capable d’exercer un rétrocontrôle sur sa propre sécrétion en stimulant la sécrétion de dopamine.
Les effets biologiques de la prolactine
La PRL est l’hormone de la lactation. Elle permet la différenciation lobulo-alvéolaire terminale des cellules épithéliales de la glande mammaire et la synthèse des protéines du lait. Cependant, son activité biologique est loin de se limiter à la seule stimulation de la glande mammaire. Selon les espèces, elle pourrait exercer ses fonctions dans des domaines très divers tels que le métabolisme, la croissance et le développement de certains organes (glande mammaire, prostate, squelette), le comportement maternel, l’immunomodulation et l’osmorégulation (Bole-Feysot et al., 1998). Ainsi, dans l’espèce humaine, l’action physiologique de la PRL reste, à notre connaissance, limitée au développement mammaire et à la lactation, tandis que les pathologies sont essentiellement celles rencontrées dans le cadre d’une production excessive de l’hormone que l’on appelle hyperprolactinémie.
Des modèles animaux à la physiopathologie hypophysaire humaine
Lien entre hyperprolactinémie et anovulation
L’hyperprolactinémie est définie par une élévation de la concentration sérique de la PRL au-delà de la limite supérieure du dosage, le plus souvent de 20 à 25 ng/ml (Brue et al., 2007). Il s’agit d’un motif très fréquent de consultation en endocrinologie, gynécologie ou médecine de la reproduction. En effet, l’hyperprolactinémie est l’une des principales causes d’anovulation, d’aménorrhée et de déficit gonadotrope chez la femme. Dans environ 50 % des cas, l’hypersécrétion de PRL est la conséquence d’une tumeur hypophysaire appelée prolactinome (Vilar et al., 2008). Les principales autres étiologies sont iatrogènes (comme la prise de neuroleptiques ayant un effet anti-dopaminergique) ou des lésions tumorales ou infiltratives hypothalamo-hypophysaires qui peuvent être à l’origine d’une hyperprolactinémie dite de déconnexion, par compression de la tige pituitaire et perte du tonus inhibiteur dopaminergique. Des données récentes ont permis de préciser l’impact neuroendocrinien de l’hyperprolactinémie ; ainsi, le mécanisme du déficit gonadotrope induit par l’excès de prolactine a été récemment élucidé. Il est admis depuis longtemps que l’hypersécrétion de prolactine induit la suppression de la libération de GnRH hypothalamique (Bouchard et al., 1985 ; Lecomte et al., 1997). En accord avec cette idée, l’administration pulsatile de GnRH permet de stimuler la sécrétion de gonadotrophines chez les patientes atteintes d’hyperprolactinémie et est suffisante pour restaurer la fonction endocrinienne ovarienne et la fertilité (Sauder et al., 1984 ; Bouchard et al., 1985 ; Lecomte et al., 1997). Jusqu’à une date récente, la question se posait de savoir si l’hyperprolactinémie affectait directement ou indirectement la sécrétion des neurones à GnRH. En effet, des analyses imuno-histochimiques ont révélé que le PRLR n’était que très peu exprimé à la surface des neurones à GnRH (Grattan et al., 2007). En revanche ces neurones expriment le récepteur Kiss1R de la kisspeptine ; la sécrétion de GnRH est ainsi stimulée par les neurones à kisspeptine, qui, eux, expriment le PRLR (Li et al., 2011 ; Smith et al., 2011) (Figure 1). En 2012, une équipe française a démontré que l’expression de kisspeptine hypothalamique était abaissée dans un modèle de souris femelle hyperprolactinémique (Sonigo et al., 2012). L’administration de kisspeptine par injections intrapéritonéales permettait de restaurer la sécrétion de GnRH et des gonadotrophines hypophysaires ainsi que la cyclicité ovarienne des animaux, suggérant que les neurones à kisspeptine jouaient un rôle majeur dans l’anovulation hyperprolactinémique (Sonigo et al., 2012). Ces données ont ensuite été validées dans l’espèce humaine. En effet, chez deux patientes présentant une anovulation causée par un microadénome à PRL, l’administration de kisspeptine par perfusion intraveineuse a réactivé la sécrétion de gonadotrophines hypophysaires et de stéroïdes ovariens (Millar et al., 2017). Ce résultat a été reproduit par la suite chez 12 patientes après administration de kisspeptine par bolus intraveineux répétés (Hoskova et al., 2022). Ainsi, comme chez les rongeurs, l’hypogonadisme hypogonadotrope chez les femmes atteintes d’hyperprolactinémie apparaît comme la conséquence d’un déficit de sécrétion de kisspeptine hypothalamique. Cependant, la PRL pourrait également avoir des effets directs sur d’autres neurones afférents aux neurones à GnRH, et, par ailleurs, la possibilité que d’autres facteurs non neuronaux puissent agir sur les sécrétions neuronales de kisspeptine et de GnRH ne peut être exclue (Bernard et al., 2015) (Figure 1). Quoi qu’il en soit, ces études suggèrent que l’administration de kisspeptine pourrait être une approche thérapeutique viable pour restaurer la fertilité chez les patientes présentant une hyperprolactinémie résistante aux traitements usuels.
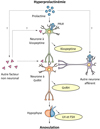 |
Figure 1 Mécanismes de l’anovulation induite par l’hyperprolactinémie. Le schéma montre que le PRLR est exprimé par les neurones à kisspeptine, mais pas par les neurones à GnRH. En situation d’hyperprolactinémie, il existe une diminution de la sécrétion de kisspeptine, ce qui induit en aval une baisse de la sécrétion de GnRH, la réduction de la sécrétion de LH et FSH par l’hypophyse, et donc l’anovulation. La prolactine pourrait également avoir des effets directs sur d’autres neurones afférents aux neurones à GnRH. De plus, l’implication d’autres facteurs non neuronaux affectant la sécrétion de kisspeptine ou de GnRH ne peut être exclue. (D’après Bernard et al., 2015). |
Rôle de la prolactine dans l’homéostasie des cellules lactotropes
Comme indiqué ci-dessus, la sécrétion de PRL et la prolifération des cellules lactotropes sont sous le contrôle de la dopamine via les récepteurs D2R exprimés à leur surface. Inversement, la PRL stimule la sécrétion de dopamine hypothalamique via le PRLR exprimé sur les neurones TIDA, exerçant ainsi un rétrocontrôle négatif sur sa propre sécrétion. Les deux modèles de souris D2r −/− et Prlr −/− développent une hyperprolactinémie et des prolactinomes, confirmant l’importance du tonus dopaminergique hypothalamique dans la régulation de l’homéostasie des cellules lactotropes (Kelly et al., 1997 ; Asa et al., 1999 : Schuff et al., 2002 ; Bernard et al., 2018a). Néanmoins, chez les animaux Prlr −/−, il y a des raisons de suspecter également un mécanisme de régulation indépendant de la dopamine pour favoriser la tumorigenèse. En effet, les souris Prlr −/− et doubles mutantes D2r −/−-Prlr −/− ont des taux de PRL plus élevés et développent des adénomes plus volumineux que les souris D2r −/−. Un tel mécanisme pourrait résulter d’une action directe de la prolactine sur la cellule lactotrope. En effet, le PRLR quasi ubiquitaire s’exprime dans les cellules lactotropes (Morel et al., 1994). Des études ex vivo ont montré que le traitement par PRL de cultures primaires d’hypophyses sauvages entraînait une diminution de 75 % de la prolifération cellulaire lactotrope (Schuff et al., 2002). D’autres études in vitro ont révélé que l’utilisation d’un antagoniste du PRLR était capable d’induire une augmentation de la prolifération et une inhibition de l’apoptose des cellules de la lignée lacto-somatotrope GH3 (Ferraris et al., 2012). La PRL agirait donc comme facteur anti-prolifératif et pro-apoptotique dans l’antéhypophyse. Pour évaluer l’effet direct de la PRL sur les cellules lactotropes in vivo, un modèle de souris invalidé spécifiquement pour le Prlr dans les cellules lactotropes a été développé et caractérisé (Bernard et al., 2018b). Les femelles présentaient des taux de PRL normaux et n’ont pas développé d’adénomes lactotropes hypophysaires, même à l’âge de 20 mois. Néanmoins, ces animaux avaient une augmentation du tonus inhibiteur dopaminergique par rapport aux souris témoins. Ces données ont confirmé la présence d’un rétrocontrôle autocrine ou paracrine de la PRL dans les cellules lactotropes in vivo, qui est néanmoins plus faible que le tonus inhibiteur dopaminergique (Bernard et al., 2018b, 2019). On peut émettre l’hypothèse selon laquelle, dans des situations physiologiques où la production de dopamine est altérée, comme pendant l’allaitement ou le vieillissement (MohanKumar et al., 2001 ; Hodson et al., 2012 ; Le Tissier et al., 2017), ce rétrocontrôle hypophysaire pourrait être augmenté au point de contribuer à prévenir la survenue d’adénomes lactotropes.
Les mécanismes de tumorigenèse lactotrope des animaux Prlr −/− restent cependant incomplètement compris et transposables à l’espèce humaine. En effet, en 2018, le premier cas de mutation bi-allélique perte de fonction du PRLR a été décrit chez l’Homme (Kobayashi et al., 2018). Il s’agissait d’une patiente de 35 ans ayant présenté une hyperprolactinémie idiopathique associée à une absence totale de lactation après chacun de ses deux accouchements, une description clinique en cohérence avec l’observation expérimentale de la perte de la lactation chez des souris déficientes en PRLR fonctionnel (Ormandy et al., 1997 ; Gallego et al., 2001). Cependant, en opposition au modèle murin, la patiente avait alors une IRM hypophysaire normale (Kobayashi et al., 2018). Il aurait été intéressant de la suivre cliniquement et de répéter les imageries hypophysaires afin de voir si, comme chez la souris, elle développait ultérieurement un prolactinome.
Conclusion
Au cours des 10 dernières années, des progrès majeurs dans nos connaissances des mécanismes d’action de la PRL et de ses rôles dans la santé humaine ont été réalisés. Il est maintenant démontré que la PRL exerce des actions autocrines ou paracrines sur les cellules lactotropes in vivo. Cependant, ce rétrocontrôle hormonal est moins puissant que le tonus inhibiteur exercé par la dopamine hypothalamique. Une des avancées majeures a été de mieux comprendre, à l’aide des modèles murins, l’impact de l’hyperprolactinémie sur l’axe gonadotrope. Il est maintenant admis que, comme chez les rongeurs, l’hypogonadisme hypogonadotrope chez les patientes atteintes d’hyperprolactinémie est médié par un déficit de sécrétion de kisspeptine hypothalamique, et que l’axe gonadotrope peut être restauré par l’administration intraveineuse de kisspeptine.
Références
- Asa, S.L., Kelly, M.A., Grandy, D.K., Low, M.J. (1999). Pituitary lactotroph adenomas develop after prolonged lactotroph hyperplasia in dopamine D2 receptor-deficient mice. Endocrinology, 140, 5348-5355. [CrossRef] [PubMed] [Google Scholar]
- Ben-Jonathan, N., Mershon, J.L., Allen, D.L., Steinmetz, R.W. (1996). Extrapituitary prolactin: Distribution, regulation, functions, and clinical aspects. Endocr Rev, 17, 639-669. [PubMed] [Google Scholar]
- Bernard, V., Young, J., Chanson, P., Binart, N. (2015). New insights in prolactin: Pathological implications. Nat Rev Endocrinol, 11, 265-275. [CrossRef] [PubMed] [Google Scholar]
- Bernard, V., Villa, C., Auguste, A., Lamothe, S., Guillou, A., Martin, A., Caburet, S., Young, J., Veitia, R.A., Binart, N. (2018a). Natural and molecular history of prolactinoma: Insights from a Prlr-/- mouse model. Oncotarget, 9, 6144-6155. [CrossRef] [PubMed] [Google Scholar]
- Bernard, V., Lamothe, S., Beau, I., Guillou, A., Martin, A., Le Tissier, P., Grattan, D., Young, J., Binart, N. (2018b). Autocrine actions of prolactin contribute to the regulation of lactotroph function in vivo. FASEB J, 32, 4791-4797. [CrossRef] [PubMed] [Google Scholar]
- Bernard, V., Young, J., Binart, N. (2019). Prolactin – A pleiotropic factor in health and disease. Nat Rev Endocrinol, 15, 356-365. [CrossRef] [PubMed] [Google Scholar]
- Bole-Feysot, C., Goffin, V., Edery, M., Binart, N., Kelly, P.A. (1998). Prolactin (PRL) and its receptor: Actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice. Endocr Rev, 19, 225-268. [CrossRef] [PubMed] [Google Scholar]
- Bouchard, P., Lagoguey, M., Brailly, S., Schaison, G. (1985). Gonadotropin-releasing hormone pulsatile administration restores luteinizing hormone pulsatility and normal testosterone levels in males with hyperprolactinemia. J Clin Endocrinol Metab, 60, 258-262. [CrossRef] [PubMed] [Google Scholar]
- Brue, T., Delemer, B., and French Society of Endocrinology (SFE) work group on the consensus on hyperprolactinemia. (2007). Diagnosis and management of hyperprolactinemia: Expert consensus – French Society of Endocrinology. Ann Endocrinol, 68, 58-64. [CrossRef] [PubMed] [Google Scholar]
- Fahie-Wilson, M., Smith, T.P. (2013). Determination of prolactin: The macroprolactin problem. Best Pract Res Clin Endocrinol Metab, 27, 725-742. [CrossRef] [PubMed] [Google Scholar]
- Ferraris, J., Boutillon, F., Bernadet, M., Seilicovich, A., Goffin, V., Pisera, D. (2012). Prolactin receptor antagonism in mouse anterior pituitary: Effects on cell turnover and prolactin receptor expression. Am J Physiol Endocrinol Metab, 302, E356-E364. [CrossRef] [PubMed] [Google Scholar]
- Freeman, M.E., Kanyicska, B., Lerant, A., Nagy, G. (2000). Prolactin: structure, function, and regulation of secretion. Physiol Rev, 80, 1523-1631. [CrossRef] [PubMed] [Google Scholar]
- Gadd, S.L., Clevenger, C.V. (2006). Ligand-independent dimerization of the human prolactin receptor isoforms: Functional implications. Mol Endocrinol, 20, 2734-2746. [CrossRef] [PubMed] [Google Scholar]
- Gallego, M. I., Binart, N., Robinson, G.W., Okagaki, R., Coschigano, K.T., Perry, J., Kopchick, J.J., Oka, T., Kelly, P.A., Hennighausen, L. (2001). Prolactin, growth hormone, and epidermal growth factor activate Stat5 in different compartments of mammary tissue and exert different and overlapping developmental effects. Dev Biol, 229, 163-175. [CrossRef] [PubMed] [Google Scholar]
- Gellersen, B., Kempf, R., Telgmann, R., DiMattia, G.E. (1994). Nonpituitary human prolactin gene transcription is independent of Pit-1 and differentially controlled in lymphocytes and in endometrial stroma. Mol Endocrinol, 8, 356-373. [PubMed] [Google Scholar]
- Grattan, D.R., Jasoni, C.L., Liu, X., Anderson, G.M., Herbison, A.E. (2007). Prolactin regulation of gonadotropin-releasing hormone neurons to suppress luteinizing hormone secretion in mice. Endocrinology, 148, 4344-4351. [CrossRef] [PubMed] [Google Scholar]
- Grattan, D.R. (2015). 60 years of neuroendocrinology: The Hypothalamo-prolactin axis. J Endocrinol, 226, T101– T122. [CrossRef] [PubMed] [Google Scholar]
- Hodson, D.J., Schaeffer, M., Romanò, N., Fontanaud, P., Lafont, C., Birkenstock, J., Molino F., Christian, H., Lockey, J., Carmignac, D., Fernandez-Fuente, M., Le Tissier, P., Mollard, P. (2012). Existence of long-lasting experience-dependent plasticity in endocrine cell networks. Nat Commun, 3, 605. [CrossRef] [PubMed] [Google Scholar]
- Hoskova, K., Bryant, N.K., Chen, M.E., Nachtigall, L.B., Lippincott, M.F., Balasubramanian, R., Seminara, S.B. (2022). Kisspeptin overcomes GnRH neuronal suppression secondary to hyperprolactinemia in humans. J Clin Endocrinol Metab, 107, e3515–e3525. [CrossRef] [PubMed] [Google Scholar]
- Kelly, M.A., Rubinstein, M., Asa S.L., Zhang, G., Saez, C., Bunzow, J.R., Allen, R.G., Hnasko, R., Ben-Jonathan, N., Grandy, D.K., Low, M.J. (1997). Pituitary lactotroph hyperplasia and chronic hyperprolactinemia in dopamine D2 receptor-deficient mice. Neuron, 19, 103-113. [CrossRef] [PubMed] [Google Scholar]
- Kobayashi, T., Usui, H., Tanaka, H., Shozu, M. (2018). Variant prolactin receptor in agalactia and hyperprolactinemia. New Engl J Med, 379, 2230-2236. [CrossRef] [PubMed] [Google Scholar]
- Le Tissier, P., Campos, P., Lafont, C., Romanò, N., Hodson, D.J., Mollard, P. (2017). An updated view of hypothalamic-vascular-pituitary unit function and plasticity. Nat Rev Endocrinol, 13, 257-267. [CrossRef] [PubMed] [Google Scholar]
- Lecomte, P., Lecomte, C., Lansac, J., Gallier, J., Sonier, C.B., Simonetta C. (1997). Pregnancy after intravenous pulsatile gonadotropin-releasing hormone in a hyperprolactinaemic woman resistant to treatment with dopamine agonists. Eur J Obst Gynecol Reprod Biol, 74, 219-221. [CrossRef] [Google Scholar]
- Li, Q., Rao, A., Pereira, A., Clarke, I.J., Smith, J.T. (2011). Kisspeptin cells in the ovine arcuate nucleus express prolactin receptor but not melatonin receptor. J Neuroendocrinol, 23, 871-882. [CrossRef] [PubMed] [Google Scholar]
- Marano, R.J., Ben-Jonathan, N. (2014). Minireview: Extrapituitary prolactin: An update on the distribution, regulation, and functions. Mol Endocrinol, 28, 622-633. [CrossRef] [PubMed] [Google Scholar]
- Millar, R.P., Sonigo, C., Anderson, R.A., George, J., Maione, L., Brailly-Tabard, S., Chanson, P., Binart, N., Young, J. (2017). Hypothalamic-pituitary-ovarian axis reactivation by kisspeptin-10 in hyperprolactinemic women with chronic amenorrhea. J Endocr Soc, 1, 1362-1371. [CrossRef] [PubMed] [Google Scholar]
- MohanKumar, P.S., MohanKumar, S.M., Quadri, S.K., Voogt J.L. (2001). Effects of chronic bromocriptine treatment on tyrosine hydroxylase (TH) mRNA expression, TH activity and median eminence dopamine concentrations in ageing rats. J Neuroendocrinol, 13, 261-269. [CrossRef] [PubMed] [Google Scholar]
- Morel, G., Ouhtit, A., Kelly P.A. (1994). Prolactin receptor immunoreactivity in rat anterior pituitary. Neuroendocrinology, 59, 78-84. [CrossRef] [PubMed] [Google Scholar]
- Ormandy, C.J., Camus, A., Barra, J., Damotte, D., Lucas, B., Buteau, H., Edery, M., Brousse, N., Babinet, C., Binart, N., Kelly P.A. (1997). Null mutation of the prolactin receptor gene produces multiple reproductive defects in the mouse. Genes Dev, 11, 167-178. [CrossRef] [PubMed] [Google Scholar]
- Peers, B., Voz, M.L., Monget, P., Mathy-Hartert, M., Berwaer, M., Belayew, A., Martial, J.A. (1990). Regulatory elements controlling pituitary-specific expression of the human prolactin gene. Mol Cell Biol, 10, 4690-4700. [PubMed] [Google Scholar]
- Postel-Vinay, M.C., Belair, L., Kayser, C., Kelly, P.A., Djiane, J. (1991). Identification of prolactin and growth hormone binding proteins in rabbit milk. Proc Natl Acad Sci USA, 88, 6687-6690. [CrossRef] [PubMed] [Google Scholar]
- Sauder, S.E., Frager, M., Case, G.D., Kelch, R.P., Marshall, J.C. (1984). Abnormal patterns of pulsatile luteinizing hormone secretion in women with hyperprolactinemia and amenorrhea: Responses to bromocriptine. J Clin Endocrinol Metab, 59, 941-948. [CrossRef] [PubMed] [Google Scholar]
- Schuff, K.G., Hentges S.T., Kelly, M.A., Binart, N., Kelly, P.A., Iuvone, P.M., Asa, S.L., Low, M.J. (2002). Lack of prolactin receptor signaling in mice results in lactotroph proliferation and prolactinomas by dopamine-dependent and -independent mechanisms. J Clin Invest, 11, 973-981. [CrossRef] [PubMed] [Google Scholar]
- Smith, J.T., Li, Q., Yap, K.S., Shahab, M., Roseweir, A.K., Millar, R.P., Clarke, I.J. (2011). Kisspeptin is essential for the full preovulatory LH surge and stimulates GnRH release from the isolated ovine median eminence. Endocrinology, 152, 1001-1012. [CrossRef] [PubMed] [Google Scholar]
- Sonigo, C., Bouilly, J., Carré, N., Tolle, V., Caraty, A., Tello, J., Simony-Conesa, F.-J., Millar, R., Young, J., Binart, N. (2012). Hyperprolactinemia-induced ovarian acyclicity is reversed by kisspeptin administration. J Clin Invest, 122, 3791-3795. [CrossRef] [PubMed] [Google Scholar]
- Vilar, L., Freitas, M.C., Naves, L.A., Casulari, L.A, Azevedo, M., Montenegro, R., Barros, A. I., Faria, M., Nascimento, G.C., Lima, J.G., Nóbrega, L.H., Cruz, T.P., Mota, A., Ramos, A., Violante, A., Lamounier Filho, A., Gadelha, M.R., Czepielewski, M.A., Glezer, A., Bronstein, M.D. (2008). Diagnosis and management of hyperprolactinemia: Results of a Brazilian multicenter study with 1234 patients. J Endocrinol Invest, 31, 436-444. [Google Scholar]
- Walker, A.M. (2007). S179D Prolactin: antagonistic agony! Mol Cell Endocrinol, 276, 1-9. [CrossRef] [PubMed] [Google Scholar]
- Waters, M.J., Brooks, A.J., Chhabra, Y. (2014). A new mechanism for growth hormone receptor activation of Jak2, and implications for related cytokine receptors. JAK-STAT, 3, e29569. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Begon, E. et Bernard, V. (2022). La prolactine et son récepteur : Des modèles animaux à la physiopathologie hypophysaire. Biologie Aujourd’hui, 216, 105-110
Liste des figures
 |
Figure 1 Mécanismes de l’anovulation induite par l’hyperprolactinémie. Le schéma montre que le PRLR est exprimé par les neurones à kisspeptine, mais pas par les neurones à GnRH. En situation d’hyperprolactinémie, il existe une diminution de la sécrétion de kisspeptine, ce qui induit en aval une baisse de la sécrétion de GnRH, la réduction de la sécrétion de LH et FSH par l’hypophyse, et donc l’anovulation. La prolactine pourrait également avoir des effets directs sur d’autres neurones afférents aux neurones à GnRH. De plus, l’implication d’autres facteurs non neuronaux affectant la sécrétion de kisspeptine ou de GnRH ne peut être exclue. (D’après Bernard et al., 2015). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


