| Numéro |
J. Soc. Biol.
Volume 202, Numéro 4, 2008
Os et cartilage - Structure, métabolisme, vieillissement
|
|
|---|---|---|
| Page(s) | 281 - 288 | |
| DOI | https://doi.org/10.1051/jbio:2008029 | |
| Publié en ligne | 19 décembre 2008 | |
L'agrécane et le cartilage articulaire : apport des glycosyltransférases dans la réparation du cartilage arthrosique
Agrecan and articular cartilage: assessment of glycosyltransferases for the restoration of cartilage matrix in osteoarthritis
UMR 7561 CNRS-Université Henri Poincaré-Nancy 1 "Physiopathologie
et Pharmacologie Articulaires", Faculté de Médecine, BP 184,
54505 Vandœuvre-lès-Nancy Cedex, France
Auteur de correspondance : Jacques.Magdalou@medecine.uhp-nancy.fr
Reçu :
25
Mars
2008
L'arthrose, la maladie la plus fréquente du système
musculo-squelettique, est la conséquence de processus mécaniques et
biologiques qui rompent l'homéostasie du cartilage, de la synoviale et
de l'os sous-chondral. Dans le but de développer de nouvelles
thérapeutiques efficaces, visant à restaurer la matrice
cartilagineuse, nous caractérisons les mécanismes moléculaires
et les protéines-clés responsables de l'initiation de la maladie. Un
des évènements les plus précoces est la dégradation de
l'agrécane qui est le protéoglycane matriciel le plus abondant. Les
chaînes de chondroïtine sulfate liées à la protéine
porteuse sont découpées en petits fragments. Le laboratoire
s'intéresse aux glycosyltransférases qui catalysent la formation des
chaînes polysaccharidiques, en particulier celles impliquées dans la
synthèse de l'amorce tétrasaccharidique commune de liaison à la
protéine porteuse, GlcA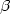 1,3Galβ1,3Gal
1,3Galβ1,3Gal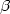 1,4Xyl-O-Sérine. La galactose β1,3-glucuronosyltransférase-I
(GlcAT-I), qui attache l'acide glucuronique terminal et qui est fortement
réprimée durant l'arthrose, est une cible potentiellement
intéressante. En effet, l'enzyme recombinante humaine joue un rôle
primordial dans la synthèse des glycosaminoglycanes (GAG). La surexpression de la GlcAT-I dans
des explants de cartilage traités par l'IL1
1,4Xyl-O-Sérine. La galactose β1,3-glucuronosyltransférase-I
(GlcAT-I), qui attache l'acide glucuronique terminal et qui est fortement
réprimée durant l'arthrose, est une cible potentiellement
intéressante. En effet, l'enzyme recombinante humaine joue un rôle
primordial dans la synthèse des glycosaminoglycanes (GAG). La surexpression de la GlcAT-I dans
des explants de cartilage traités par l'IL1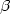 est capable de
s'opposer complètement à la déplétion en protéoglycanes
provoquées par cette cytokine pro-inflammatoire. Des études
structure/fonction/régulation de cette enzyme ont alors été
entreprises. Les résultats constituent les bases pour le
développement de plusieurs thérapeutiques basées sur la
vectorisation de gènes en intra-articulaire et la conception de
glycomimétiques capables de réparer le cartilage.
est capable de
s'opposer complètement à la déplétion en protéoglycanes
provoquées par cette cytokine pro-inflammatoire. Des études
structure/fonction/régulation de cette enzyme ont alors été
entreprises. Les résultats constituent les bases pour le
développement de plusieurs thérapeutiques basées sur la
vectorisation de gènes en intra-articulaire et la conception de
glycomimétiques capables de réparer le cartilage.
Abstract
Articular cartilage is a connective tissue containing a single type of
cells, chondrocytes, which synthesise a dense extracellular matrix, mainly
composed of collagens, hyaluronic acid and proteoglycans. These
macromolecules play a major role in the resistance and elastic properties of
the tissue. They also favour interactions with small active substances, such
as growth factors and cytokines. Chondrocytes have a low metabolic capacity
in relatively hypoxic conditions and absence of vascular supply. In
physiopathological conditions, such as osteoarthritis (OA), progressive and
irreversible degradation of matrix components is occurring. With the aim of
developing new and efficient therapies against OA, we investigated the
molecular mechanisms that initiate the disease, in order to identify
key-proteins. These targets should hopefully lead to the design of new drugs
able to stop degradation and restore cartilage. One of the earliest molecular events in
OA is the degradation of aggrecan, the most abundant proteoglycan. The
glycosaminoglycan (GAG) chains, chondroitin-sulfate, attached on the
core protein, are subjected to hydrolysis into smaller fragments. We were
interested in the glycosyltransferases that catalyse the formation of the
polysaccharidic chains, namely those involved in the common tetrasaccharidic
protein linkage region, GlcA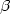 1,3Gal
1,3Gal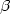 1,3Gal
1,3Gal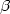 1,4Xyl-O-Serine. The galactose
1,4Xyl-O-Serine. The galactose 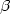 1,3-glucuronosyltransférase-I
(GlcAT-I) which catalyses the final step of this primer and which is
markedly repressed during OA is an attractive target in that respect.
Indeed, the human recombinant enzyme was found to play a pivotal role in GAG
synthesis. Moreover, overexpression of GlcAT-I in cartilage explants treated
with IL1
1,3-glucuronosyltransférase-I
(GlcAT-I) which catalyses the final step of this primer and which is
markedly repressed during OA is an attractive target in that respect.
Indeed, the human recombinant enzyme was found to play a pivotal role in GAG
synthesis. Moreover, overexpression of GlcAT-I in cartilage explants treated
with IL1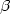 was able to fully counteract proteoglycan depletion induced
by the cytokine. These results prompted us to investigate the structure,
function and regulation of this enzyme. This study provides the basis for
several therapy approaches (gene delivery, design of glycomimetics able to
initiate GAG synthesis) to promote cartilage repair.
was able to fully counteract proteoglycan depletion induced
by the cytokine. These results prompted us to investigate the structure,
function and regulation of this enzyme. This study provides the basis for
several therapy approaches (gene delivery, design of glycomimetics able to
initiate GAG synthesis) to promote cartilage repair.
Mots clés : Cartilage / agrécane / glycosyltransférases / arthropathies
Key words: Cartilage / aggrecan / glycosyltransferases / arthropathies
© Société de Biologie, 2008
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


