| Numéro |
Biologie Aujourd'hui
Volume 211, Numéro 2, 2017
|
|
|---|---|---|
| Page(s) | 189 - 196 | |
| Section | Autour de Claude Bernard | |
| DOI | https://doi.org/10.1051/jbio/2017026 | |
| Publié en ligne | 13 décembre 2017 | |
Article
L'insulinorésistance chez l'homme : des mécanismes aux interventions nutritionnelles
Insulinoresistancy in Man: from mechanisms to nutritional interference
1
Équipe Nutrition-Diabète, CHU Montpellier,
Montpellier, France
2
PHYMEDEXP INSERM U1046, CNRS UMR9214, Université de Montpellier,
Montpellier, France
* Auteur correspondant : a-sultan@chu-montpellier.fr
Reçu :
16
Juin
2017
L’obésité est aujourd’hui considérée comme « la première épidémie non infectieuse de l’histoire de l’homme ». C’est une pathologie multifactorielle qui contribue à l’apparition de l’insulinorésistance (IR). Certains sujets obèses présentent une obésité dite métaboliquement saine, non associée à des anomalies métaboliques. Le présent article passe en revue les différents mécanismes possibles à l’origine de l’IR.
Abstract
Obesity is presently regarded as the “the first non-infectious epidemic outbreak” in the history of Humanity. It is a multifactorial pathology, that contributes to the emergence of insulinoresistancy. Some obese individuals display an obesity qualified as metabolically sound, i.e., non-associated with metabolical anomalies. The present paper reviews the different possible mechanisms responsible for insulin-resistancy.
Mots clés : obésité / insulinorésistance / anomalies métaboliques / muscle / tissu adipeux
Key words: obesity / insulinoresistancy / metabolical anomalies / muscle / adipose tissue
© Société de Biologie, 2017
Abréviations
HOMA-IR : Indice d'insulinorésistance
IMC : Indice de Masse Corporelle
MnSOD : Manganese-dependent superoxide
OIR : Sujets obèses insulinorésistants
OIS : Sujets obèses insulinosensibles
PAMP : Pathogen-Associated Molecular Patterns
PRR : Patterns Recognition Receptors
TRIF : TIR-domain-containing adapter-inducing interferon-β
Introduction
L'obésité est aujourd'hui considérée par la communauté scientifique comme « la première épidémie non infectieuse de l'histoire de l'homme ». L'Organisation mondiale de la Santé (OMS) la définit comme « une accumulation anormale ou excessive de la graisse corporelle qui peut nuire à la santé ». L'obésité est une pathologie multifactorielle dont l'environnement physiopathologique contribue à l'apparition de l'insulinorésistance (IR). Il est important de noter que, plus que l'IMC (indice de masse corporelle), utilisé en clinique pour porter le diagnostic d'obésité, c'est la nature du dépôt adipeux qui permet d'évaluer plus finement le risque métabolique associé à l'obésité (Gesta et al., 2007). Ainsi, les individus présentant une obésité dite gynoïde avec une accumulation préférentielle du tissu adipeux sous-cutané dans la partie basse du corps ont un risque faible, voire nul, d'apparition de maladies métaboliques. À l'inverse, l'autre type d'obésité dite androïde observé majoritairement chez l'homme et chez la femme ménopausée se caractérise par une distribution abdominale viscérale du tissu adipeux, et est associé à un risque élevé de survenue de troubles cardio-métaboliques (Vague, 1956 ; Krotkiewski et al., 1983 ; Karpe & Pinnick, 2015). De façon étonnante, certains sujets obèses vont présenter une obésité dite métaboliquement saine, c'est-à-dire non associée à des anomalies métaboliques (Stefan & Häring, 2013). Une récente revue systématique de la littérature estime cette prévalence entre 10 à 51 % dans la population générale avec une incidence plus importance chez les femmes que chez les hommes, et une diminution en fonction de l'âge (Rey-López et al., 2014), mais les critères diagnostiques ne sont pas consensuels. Cependant, des réserves sont émises par certains auteurs sur l'existence d'une obésité métaboliquement saine (Kramer et al., 2013 ; Chang et al., 2014).
De nombreux travaux se sont intéressés à l'étude de l'IR au cours de l'obésité. La plupart se sont focalisés soit sur des modèles animaux, soit chez des patients porteurs d'une obésité sévère (obésité grade 3) chez l'Homme. Cependant, certaines zones d'ombre subsistent concernant notamment les mécanismes et la dysfonction tissulaire à l'origine de l'IR.
D'une part, certaines études suggèrent que le défaut primaire à l'origine de l'IR se trouverait au niveau du tissu adipeux, qui sécréterait dans la circulation systémique des adipokines, des cytokines inflammatoires et des acides gras (AG), contribuant ainsi au développement d'une inflammation et d'une hyperlipidémie systémique (Galic et al., 2010 ; Poulos et al., 2010). Ces deux paramètres exercent des effets délétères sur la sensibilité à l'insuline des autres organes comme le muscle et le foie. D'autre part, le muscle étant l'organe gluco-régulateur par excellence en situation postprandiale, d'autres études le placent au cœur de la physiopathologie de l'IR (DeFronzo et al., 1981 ; Varma et al., 2009 ; Patsouris et al., 2014).
Malgré ces controverses, aucune étude n'a à ce jour exploré, chez l'Homme, de façon concomitante l'inflammation et l'IR systémique et tissulaire dans le muscle et le tissu adipeux chez un même sujet.
Étude des mécanismes impliqués dans l'IR au cours de l'obésité de grade 1
Dans ce contexte, notre premier objectif a été de mieux comprendre les mécanismes impliqués dans la mise en place de l'IR dans une population de femmes ménopausées présentant une obésité de grade 1 (IMC entre 30 et 35). Dans un premier temps, nous avons exploré la sensibilité à l'insuline et l'inflammation systémique et tissulaire dans le muscle et le tissu adipeux chez des femmes obèses de grade 1 et ménopausées. Ce travail de caractérisation, basé sur l'utilisation d'un modèle d'étude comparant des sujets minces (CT), des sujets obèses insulinosensibles (OIS) et de sujets obèses insulinorésistants (OIR), a permis d'identifier des dérèglements physiopathologiques qui pourraient être impliqués dans l'apparition de l'IR. Dans un second temps, nous avons étudié les mécanismes moléculaires associés aux différentes dysfonctions décelées, notamment, les mécanismes moléculaires en lien avec la lipotoxicité et l'activation des Toll-Like récepteurs (TLR).
Exploration de la sensibilité à l'insuline et de l'inflammation systémique et tissulaire dans le muscle et le tissu adipeux chez des femmes obèses de grade 1 et ménopausées
Notre objectif était de comparer les marqueurs d'inflammation systémiques et tissulaires en fonction de la présence d'une IR chez des femmes présentant une obésité modérée de grade 1. Ces volontaires ont été réparties en trois groupes suivant leur IMC et leur sensibilité à l'insuline déterminée par le HOMA-IR Indice d'insulinorésistance (Figure 1).
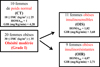 |
Figure 1 Distinction de 3 groupes en fonction du statut métabolique et pondéral. |
Analyse systémique
Les résultats de cette première étude montrent que les niveaux systémiques de lipides, d'adipokines, de cytokines inflammatoires, et des lipopolysaccharides (LPS) sont équivalents entre les sujets OIS et OIR (Figure 2).
 |
Figure 2 Concentrations plasmatiques des adipokines et cytokines en fonction du statut pondéral et métabolique. |
Analyse dans le tissu adipeux (TA) sous-cutané
Dans le TA, le nombre de macrophages anti-inflammatoires est plus élevé chez les OIR que chez les CT et les OIS et aucune fibrose n'a été détectée. En ce qui concerne la sensibilité à l'insuline dans le tissu adipeux (évaluée ex vivo, via le niveau d'induction par un traitement par l'insuline de la phosphorylation d'Akt ser473), elle est maintenue et est la même chez les CT, OIS et OIR (Figure 3).
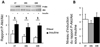 |
Figure 3 Évaluation de la sensibilité à l'insuline dans le tissu adipeux CT : contrôle, OIS : obèse insulinosensible, OIR : obèse insulinorequérant. |
Analyse musculaire (TM)
Dans le TM, nous n'observons aucune variation du niveau des marqueurs pro-inflammatoires (macrophages, cytokines), ni de fibrose entre les trois groupes même si une diminution de l'expression d'IκBα, qui marque l'activation de la voie pro-inflammatoire MyD88-dépendante, est observée chez les OIR par rapport aux CT (Figure 4). La réponse à l'insuline de ce tissu (évaluée également ex vivo) est quant à elle maintenue dans les CT et les OIS alors qu'elle est fortement diminuée chez les OIR (Figure 5).
D'après ces données, le défaut de réponse à l'insuline du muscle squelettique pourrait être l'une des principales caractéristiques de la pathogenèse de l'IR au cours de l'obésité. Cette étude est l'une des rares à avoir mis en évidence l'existence d'une IR en l'absence d'inflammation systémique et même tissulaire (dans le TA). Ainsi, chez les femmes ménopausées présentant une obésité modérée de grade 1, la diminution de la sensibilité à l'insuline musculaire est un événement précoce et central dans la mise en place de l'IR. Ces résultats ont fait l'objet d'une publication (Amouzou et al., 2016).
Une meilleure compréhension des mécanismes moléculaires qui sous-tendent cette IR musculaire pourrait être intéressante pour une meilleure prise en charge de désordres métaboliques associés à l'obésité et pour une prévention efficace contre l'apparition du diabète de type 2 (DT2).
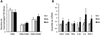 |
Figure 4 Inflammation musculaire (infiltration macrophagique et expression mRNA cytokines). |
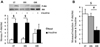 |
Figure 5 Évaluation de la sensibilité à l'insuline dans le muscle. |
Rôle des mécanismes régulateurs de l'inflammation dans l'insulinorésistance
La lipotoxicité
Nos résultats obtenus par l'analyse des paramètres moléculaires et métaboliques liés à la lipotoxicité ne nous permettent pas d'incriminer l'existence de mécanismes de lipotoxicité au sein du muscle squelettique des sujets OIR.
Implication des voies d'activation de TLR4
Le système immunitaire inné est la première ligne de défense contre les agents pathogènes (bactéries, virus, champignons, débris cellulaires) présents chez tous les organismes multicellulaires. Deux entités sont indispensables à la mise en place de cette réponse immunitaire innée. Il s'agit du système des Patterns Recognition Receptors (PRR) présents au niveau des cellules de l'hôte (membranaire et cytosolique) et des Pathogen-Associated Molecular Patterns (PAMP) qui sont des molécules de natures diverses. En plus de leurs implications actives dans les mécanismes de défense immunitaire, certains PRR comme les TLR exercent également un rôle de senseur du stress métabolique et sont impliqués dans la physiopathologie de l'obésité et de l'IR (Jin et al., 2013). D'une part, il a été démontré in vivo et in vitro que les acides gras libres activent TLR4 et induisent une inflammation dans les adipocytes et dans les macrophages résidents du tissu adipeux. La down-régulation de TLR4 abolit ces phénotypes et protège de l'IR musculaire (Shi et al., 2006). On observe une augmentation du niveau d'expression de TLR4, et du taux d'activation de NFκB dans le muscle squelettique de sujets obèses et insulinorésistants (Reyna et al., 2008). L'expression de TLR4 est également plus élevée dans le tissu adipeux viscéral (associé à des dysfonctions métaboliques) que dans le tissu adipeux sous-cutané chez des sujets obèses (Poulain-Godefroy et al., 2010).
Nous avons donc exploré le rôle de l'activation du récepteur TLR4 dans l'IR. L'activation de cette voie se fait par le biais de molécules circulantes telles que les AG libres et le LPS et se traduit par l'induction de deux voies de signalisation intracellulaire : la voie dite MyD88-dépendante qui a été largement impliquée dans les mécanismes moléculaires liés à l'IR et la voie dite TRIF-dépendante dont l'implication dans l'IR a été très peu explorée à ce jour.
L'activation de la voie MyD88-dépendante se traduit par une cascade de signalisation qui conduit à l'activation du facteur de transcription NFκB et des kinases inflammatoires IKK et JNK.
L'activation de la voie TRIF-dépendante se traduit par l'induction du facteur NFκB et de l'Interferon Regulatory Factor 3 (IRF3). La voie IRF3 est impliquée dans l'induction du système interféron qui conduit à la production d'interféron (IFN) de type I (IFN α/β). Ces cytokines sont connues pour leur implication dans les mécanismes de défense antiviraux et antimicrobiens et possèdent également des propriétés anti-tumorales, immuno-modulatrices et anti-inflammatoires.
Niveau d'expression du récepteur TLR4 dans le muscle et le tissu adipeux
Nous avons dans un premier temps évalué le niveau d'expression de TLR4 et montré que l'expression (mRNA et protéique) est augmentée dans le tissu adipeux de sujets obèses insulinorésistants mais non modifiée dans le muscle (Figure 6).
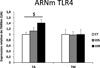 |
Figure 6 L'expression de TLR4 est augmentée dans le TA de sujets obèses insulinorésistants, et non dans le muscle. |
Voies induites par l'activation du récepteur TLR4 dans le muscle et tissu adipeux : MyD88 vs. TRIF
Alors que le niveau d'expression de la protéine IκB, indicateur de l'activation de la voie MyD88-dépendante, reste inchangé dans le TA, au niveau du TM on observe une diminution significative de ce niveau d'expression dans le groupe OIR par rapport aux CT et une tendance à la diminution entre les OIS et les OIR. Ces résultats suggèrent donc une activation de la voie MyD88-dépendante dans le TM des OIR et pas dans le TA (Figure 7).
En ce qui concerne la voie TRIF-dépendante, les résultats obtenus indiquent une absence de variation de la phosphorylation d'IRF3 dans le TM pour les trois groupes de volontaires alors que dans le TA, on observe une augmentation significative de cette phosphorylation chez les OIR par rapport au CT. Ce résultat montre une induction du système interféron dans le TA et non dans le TM.
Jusqu'ici, les résultats obtenus dans cette étude laissent suggérer une activation différentielle des voies MyD88-dépendante et TRIF-dépendante entre le TA et le TM, ce qui indique une régulation non identique de ces deux voies au niveau des deux tissus. Les activateurs et inhibiteurs endogènes de ces deux voies pourraient donc jouer un rôle important dans la régulation de la sensibilité à l'insuline. Dans ce contexte, nous avons quantifié le niveau d'expression en ARNm de plusieurs régulateurs des deux voies dans le TA et le TM des volontaires. Parmi tous ces régulateurs, seul RNF41 présente une variation de son niveau d'expression, avec une augmentation significative chez les OIR par rapport aux CT dans le TA. Dans le TM, son niveau d'expression reste inchangé (Figure 8).
De par la nature observationnelle de cette étude, nous ne pouvons établir que des liens d'association entre les différents acteurs des voies impliquées dans ces mécanismes. Seule une étude in vitro visant à valider le rôle fonctionnel de chacun des acteurs moléculaires identifiés pourrait permettre d'élucider le rôle réel de chacune des protéines-clés de cette voie.
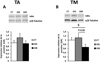 |
Figure 7 L'expression d'IkB est diminuée dans le muscle de sujets obèses insulinorésistants, et non dans le TA. |
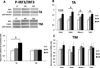 |
Figure 8 Activation de la voie TRIF dans le tissu adipeux de sujets obèses insulinorésistants et non dans le muscle. |
Étude in vitro d'une modification expression RNF41 sur la sensibilité à l'insuline
La précédente étude nous a permis d'émettre l'hypothèse selon laquelle la protéine RNF41 pourrait être l'une des protéines impliquées dans la sensibilité à l'insuline. Afin de vérifier cette hypothèse, nous avons choisi d'étudier in vitro l'effet :
-
d'une diminution de l'expression de cette protéine par transfection de siRNA (short interfering RNA) sur des myocytes humains isolés à partir des biopsies de sujets obèses insulinosensibles ;
-
d'un traitement par IFN sur des myocytes siRNA-RNF41 ;
-
d'un traitement par l'interféron sur des myocytes isolés à partir des biopsies de sujets obèses insulinorésistants.
Les résultats sont en faveur d'un rôle clé de RNF-41 dans la régulation de la sensibilité à l'insuline au niveau du muscle. Ces données sont actuellement soumises pour publication.
Quelles applications cliniques ?
Le défaut d'activation du système interféron et la diminution du niveau d'expression de la Manganese-dependent superoxide dismutase (MnSOD) sont les événements moléculaires clés qui sous-tendent la mise en place de l'IR au niveau du muscle squelettique chez les sujets OIR. Ces résultats sont autant d'arguments pour proposer deux approches thérapeutiques pour contrecarrer l'IR. La première approche est basée sur les interférons de type I.
L'autre approche envisageable est une approche nutritionnelle basée sur la stimulation des défenses anti-oxydantes. S'il s'avérait que le stress oxydant soit le défaut primaire à l'origine de l'IR observée dans le muscle squelettique des sujets OIR, une supplémentation à dose nutritionnelle en anti-oxydants pourrait être une alternative thérapeutique pour améliorer la sensibilité à l'insuline, d'autant plus que l'analyse de l'apport nutritionnel des volontaires de cette étude indique un déficit de consommation en polyphénols et plus précisément en acide phénolique (molécules présentes naturellement dans l'alimentation et ayant un fort potentiel antioxydant) chez les sujets OIR (Figure 9).
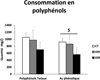 |
Figure 9 Apports nutritionnels en polyphénols en fonction du statut pondéral et métabolique. |
Prévention de l'insulinorésistance par une supplémentation nutritionnelle en polyphénols chez des sujets à risque d'IR
Nous avons pu montrer l'efficacité d'une supplémentation nutritionnelle en polyphénols de raisins rouges pour prévenir le stress oxydant et l'IR systémique induit par une charge alimentaire en fructose chez des sujets apparentés diabétiques (Hokayem et al., 2013). Ces observations suggèrent une efficacité des molécules anti-oxydantes dans la prévention de l'IR.
Modulation de l'insulinorésistance par une supplémentation nutritionnelle en polyphénols chez des sujets obèses insulinorésistants
Cette étude est actuellement en cours. La stratégie de l'étude est représentée sur la figure 10. Elle est basée sur une collaboration entre cliniciens et chercheurs (Figure 11).
L'objectif principal est de tester si la supplémentation en polyphénols (PP) de raisins rouges (3g/j) permet d'améliorer la sensibilité à l'insuline systémique (GIR : Glucose Infusion Rate) mesurée par clamp euglycémique-hyperinsulinémique (gold standard pour la mesure de l'insulinosensibilité) chez des sujets obèses insulinorésistants.
Les objectifs secondaires sont de :
-
tester si la supplémentation en PP permet d'améliorer la sensibilité à l'insuline tissulaire (tissu adipeux et muscle, mesure du rapport phosphoAKT/AKT) et de comparer la réponse à la supplémentation dans ces deux tissus ;
-
déterminer si la supplémentation en PP est associée à :
-
une réduction du stress oxydant tissulaire,
-
une modification du LPS plasmatique,
-
une modification du microbiote intestinal en lien avec une amélioration de la sensibilité à l'insuline ;
-
déterminer si la réponse au PP dépend du microbiote intestinal des sujets.
La faisabilité de ces protocoles de recherche translationnelle repose sur une collaboration étroite entre cliniciens (Équipe Diabétologie-Nutrition, Pr Sultan, CHRU Montpellier ; Département Biochimie, Pr Cristol et Médecine Nucléaire, Pr Mariano-Goulard ; Département de Pharmacie, Dr Castet) et chercheurs (expérimentations réalisées sur les tissus ainsi que les cultures cellulaires par les équipes INSERM PHYMEDEXP et l'équipe Immunité Innée, Pr Mercier, responsable Dr Bisbal). Les extraits de PP seront fournis par Grap'Sud.
En conclusion, notre recherche est basée sur des programmes translationnels, détermination de mécanismes physiopathologiques chez l'Homme et application par des études d'interventions nutritionnelles. L'objectif est d'améliorer la prise en charge des patients obèses et plus précisément de prévenir et/ou moduler l'insulinorésistance, mécanisme physiopathologique majeur du diabète de type 2.
 |
Figure 10 Design étude POLYGIR. Le score de Voorips est un score validé d'évaluation de l'activité physique. |
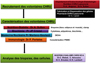 |
Figure 11 Collaboration chercheurs-cliniciens. |
Références
- Amouzou C., Breuker C., Fabre O., Bourret A., Lambert K., Birot O., Fédou C., Dupuy A.-M., Cristol J.-P., Sutra T., Molinari N., Maimoun L., Mariano-Goulart D., Galtier F., Avignon A., Stanke-Labesque F., Mercier J., Sultan A., Bisbal C. (2016). Skeletal muscle insulin resistance and absence of inflammation characterize insulin-resistant Grade I obese women. PLoS One, 11, e0154119. [CrossRef] [PubMed] [Google Scholar]
- Chang Y., Kim B.-K., Yun K.E., Cho J., Zhang Y., Rampal S., Zhao D., Jung H.-S., Choi Y., Ahn J., Lima J.A., Shin H., Guallar E., Ryu S. (2014). Metabolically-healthy obesity and coronary artery calcification. J Am Coll Cardiol, 63, 2679-2686. [CrossRef] [PubMed] [Google Scholar]
- DeFronzo R.A., Jacot E., Jequier E., Maeder E., Wahren J., Felber J.P. (1981). The effect of insulin on the disposal of intravenous glucose. Results from indirect calorimetry and hepatic and femoral venous catheterization. Diabetes, 30, 1000-1007. [CrossRef] [PubMed] [Google Scholar]
- Galic S., Oakhill J.S., Steinberg G.R. (2010). Adipose tissue as an endocrine organ. Mol Cell Endocrinol, 316, 129-139. [CrossRef] [PubMed] [Google Scholar]
- Gesta S., Tseng Y.-H., Kahn C.R. (2007). Developmental origin of fat: Tracking obesity to its source. Cell, 131, 242-256. [CrossRef] [PubMed] [Google Scholar]
- Hokayem M., Blond E., Vidal H., Lambert K., Meugnier E., Feillet-Coudray C., Coudray C., Pesenti S., Luyton C., Lambert-Porcheron S., Sauvinet V., Fedou C., Brun J.F., Rieusset J., Bisbal C., Sultan A., Mercier J., Goudable J., Dupuy A.M., Cristol J.P., Laville M., Avignon A. (2013). Grape polyphenols prevent fructose-induced oxidative stress and insulin resistance in first-degree relatives of type 2 diabetic patients. Diabetes Care, 36, 1454-1461. https://www.ncbi.nlm.nih.gov/pubmed/23275372. [Google Scholar]
- Jin C., Henao-Mejia J., Flavell R.A. (2013). Innate immune receptors: key regulators of metabolic disease progression. Cell Metab, 17, 873-882. [CrossRef] [PubMed] [Google Scholar]
- Karpe F., Pinnick K.E. (2015). Biology of upper-body and lower-body adipose tissue-link to whole-body phenotypes. Nat Rev Endocrinol, 11, 90-100. [CrossRef] [PubMed] [Google Scholar]
- Kramer C.K., Zinman B., Retnakaran R. (2013). Are metabolically healthy overweight and obesity benign conditions? A systematic review and meta-analysis. Ann Intern Med, 159, 758-769. [CrossRef] [PubMed] [Google Scholar]
- Krotkiewski M., Björntorp P., Sjöström L., Smith U. (1983). Impact of obesity on metabolism in men and women. Importance of regional adipose tissue distribution. J Clin Invest, 72, 1150-1162. [CrossRef] [PubMed] [Google Scholar]
- Patsouris D., Cao J.J., Vial G., Bravard A., Lefai E., Durand A., Durand C., Chauvin M.A., Laugerette F., Debard C., Michalski M.C., Laville M., Vidal H., Rieusset J. (2014). Insulin resistance is associated with MCP1-mediated macrophage accumulation in skeletal muscle in mice and humans. PLoS One, 9, e110653. [CrossRef] [PubMed] [Google Scholar]
- Poulain-Godefroy O., Le Bacquer O., Plancq P., Lecoeur C., Pattou F., Frühbeck G., Froguel P. (2010). Inflammatory role of Toll-Like receptors in human and murine adipose tissue. Mediators Inflamm, 2010, 823486. [CrossRef] [PubMed] [Google Scholar]
- Poulos S.P., Hausman D.B., Hausman G.J. (2010). The development and endocrine functions of adipose tissue. Mol Cell Endocrinol, 323, 20-34. [CrossRef] [PubMed] [Google Scholar]
- Rey-López J.P., de Rezende L.F., Pastor-Valero M., Tess B.H. (2014). The prevalence of metabolically healthy obesity: a systematic review and critical evaluation of the definitions used. Obes Rev, 15, 781-790. [CrossRef] [PubMed] [Google Scholar]
- Reyna S.M., Ghosh S., Tantiwong P., Meka C.S.R., Eagan P., Jenkinson C.P., Cersosimo E., DeFronzo R.A., Coletta D.K., Sriwijitkamol A., Musi N. (2008). Elevated toll-like receptor 4 expression and signaling in muscle from insulin-resistant subjects. Diabetes, 57, 2595-2602. [CrossRef] [PubMed] [Google Scholar]
- Shi H., Kokoeva M.V., Inouye K., Tzameli I., Yin H., Flier J.S. (2006). TLR4 links innate immunity and fatty acid-induced insulin resistance. J Clin Invest, 116, 3015-3025. [CrossRef] [PubMed] [Google Scholar]
- Stefan N., Häring H.-U. (2013). Circulating fetuin-A and free fatty acids interact to predict insulin resistance in humans. Nat Med, 19, 394-395. [CrossRef] [PubMed] [Google Scholar]
- Vague J. (1956). The degree of masculine differentiation of obesities: a factor determining predisposition to diabetes, atherosclerosis, gout, and uric calculous disease. Am J Clin Nutr, 4, 20-34. [CrossRef] [PubMed] [Google Scholar]
- Varma V., Yao-Borengasser A., Rasouli N., Nolen G.T., Phanavanh B., Starks T., Gurley C., Simpson P., McGehee R.E. Jr, Kern P.A., Peterson C.A. (2009) Muscle inflammatory response and insulin resistance: synergistic interaction between macrophages and fatty acids leads to impaired insulin action. Am J Physiol Endocrinol Metab, 296, E1300-10. [CrossRef] [PubMed] [Google Scholar]
Citation de l'article : Sultan, A. (2017). L'insulinorésistance chez l'homme : des mécanismes aux interventions nutritionnelles. Biologie Aujourd'hui, 211, 189-196
Liste des figures
 |
Figure 1 Distinction de 3 groupes en fonction du statut métabolique et pondéral. |
| Dans le texte | |
 |
Figure 2 Concentrations plasmatiques des adipokines et cytokines en fonction du statut pondéral et métabolique. |
| Dans le texte | |
 |
Figure 3 Évaluation de la sensibilité à l'insuline dans le tissu adipeux CT : contrôle, OIS : obèse insulinosensible, OIR : obèse insulinorequérant. |
| Dans le texte | |
 |
Figure 4 Inflammation musculaire (infiltration macrophagique et expression mRNA cytokines). |
| Dans le texte | |
 |
Figure 5 Évaluation de la sensibilité à l'insuline dans le muscle. |
| Dans le texte | |
 |
Figure 6 L'expression de TLR4 est augmentée dans le TA de sujets obèses insulinorésistants, et non dans le muscle. |
| Dans le texte | |
 |
Figure 7 L'expression d'IkB est diminuée dans le muscle de sujets obèses insulinorésistants, et non dans le TA. |
| Dans le texte | |
 |
Figure 8 Activation de la voie TRIF dans le tissu adipeux de sujets obèses insulinorésistants et non dans le muscle. |
| Dans le texte | |
 |
Figure 9 Apports nutritionnels en polyphénols en fonction du statut pondéral et métabolique. |
| Dans le texte | |
 |
Figure 10 Design étude POLYGIR. Le score de Voorips est un score validé d'évaluation de l'activité physique. |
| Dans le texte | |
 |
Figure 11 Collaboration chercheurs-cliniciens. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


