| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 1-2, 2022
|
|
|---|---|---|
| Page(s) | 55 - 61 | |
| DOI | https://doi.org/10.1051/jbio/2022010 | |
| Publié en ligne | 25 juillet 2022 | |
Article
Les maladies neurodégénératives et le vieillissement
Neurodegenerative diseases and brain aging
Ancien directeur de l'Institut de Biologie Physico-Chimique, Fondation Edmond de Rothschild, 13, rue Pierre et Marie Curie, 75005 Paris, France
* Auteur correspondant : jpierre.henry@orange.fr
Reçu :
12
Mai
2022
Les maladies neurodégénératives, maladies d’Alzheimer, de Parkinson et de Charcot, qui affectent principalement la population âgée, sont le plus souvent d’origine sporadique, c’est-à-dire sans causes identifiées. L’avancée des connaissances sur le vieillissement permet de préciser les rapports entre vieillissement physiologique et pathologique. Le vieillissement est un phénomène cellulaire, marqué par l’apparition de cellules à l’état de sénescence et d’une inflammation chronique. Les cellules gliales, astrocytes et microglie, mais aussi les neurones sont affectés, entraînant une diminution de la plasticité synaptique, à l’origine de la diminution des performances cognitives. Ce vieillissement affecte aussi le lavage glymphatique par lequel sont éliminés les déchets métaboliques. Les maladies neurodégénératives sont des protéinopathies dues à ces déchets et la dégradation du lavage glymphatique participe au développement des pathologies.
Abstract
Neurodegenerative diseases such as Alzheimer’s, Parkinson’s or Amyotrophic Lateral Sclerosis are generally of sporadic origin, but the risk of being affected increases dramatically with age. Progress in understanding brain aging contributes to define precisely the relationships between aging associated physiological and pathological processes. Aging is induced by various stresses, which turn somatic cells to a senescent state. Senescent cells cannot divide but acquire a typical phenotype and release chemicals that trigger inflammation. In the brain, glial cells such as astrocytes or microglia as well as neurons are affected. Dendritic branching declines, resulting in a decrease of synaptic plasticity and cognitive performances, associated with brain aging. Aging alters also glymphatic washing, the process by which brain catabolites are eliminated. The neurodegenerative diseases are proteinopathies resulting from pathological conformations of physiological proteins. Normally washed by the glymphatic flux, these proteins accumulate and aggregate in its absence and then trigger neuron death.
Mots clés : vieillissement / maladies neurodégénératives / cellules sénescentes / lavage glymphatique / protéinopathies
Key words: aging / neurodegenerative diseases / senescent cells / glymphatic washing / proteinopathies
© Société de Biologie, 2022
Introduction
Les maladies neurodégénératives constituent un ensemble de pathologies ciblant le système nerveux, principalement le cerveau, à développement lent et irréversible avec une issue fatale. Parmi les plus fréquentes, on peut citer des maladies où le déclin cognitif est dominant, comme la maladie d’Alzheimer ou la démence à corps de Lewy, des maladies où le déclin moteur est la manifestation essentielle, comme la maladie de Parkinson, la sclérose en plaques, la maladie de Charcot, et des maladies où les deux aspects coexistent comme la maladie de Creutzfeldt–Jakob et la maladie de Huntington. Ces maladies représentent un problème sociétal et social car les progrès thérapeutiques restent extrêmement lents. En France, plus de 1 million de personnes sont atteintes.
Leurs origines sont très mal connues. Dans un cas, la maladie de Creutzfeldt–Jakob, un petit pourcentage est infectieux, correspondant à la maladie de la « vache folle » (200 victimes en Europe) et à des formes iatrogéniques (transmission par du matériel humain contaminé utilisé à des fins thérapeutiques). Toutes ont des formes génétiques très minoritaires, mais de grande importance théorique, et la majorité des cas, toutes maladies confondues, est classée comme « sporadique », c’est-à-dire sans origine clairement identifiée. Du point de vue épidémiologique, l’association la plus nette est certainement avec le vieillissement. Ainsi, pour la maladie d’Alzheimer, 2 % de la population sont atteints avant 65 ans alors que ce chiffre monte à 15 % à 80 ans. L’allongement de la durée de vie augmente automatiquement le pourcentage des malades : en France, 900 000 personnes sont atteintes et les prévisions sont de plus de 2 millions en 2040 !
Comment le vieillissement intervient-il dans ces maladies ? Comment est-il impliqué dans les maladies neurodégénératives ?
Le vieillissement du cerveau chez les personnes non atteintes d’une maladie neurodégénérative
Le cerveau est, comme tous les organes, soumis au vieillissement. Même en l’absence de maladie neurodégénérative, les capacités cognitives déclinent. L’apprentissage, la mémoire, la rapidité de la prise de décision, la perception, la coordination motrice déclinent. L’imagerie cérébrale par I.R.M. montre ce déclin (Hedden & Gabrieli, 2004), par exemple lors de tâches requérant la mémoire d’une liste de mots (Figure 1). Très récemment a été publié dans Nature (Bethlehem et al., 2022) un suivi des modifications structurales mesurées par I.R.M. au cours de la vie (Figure 2). Au-delà de 60 ans, les principaux paramètres (volumes de la matière grise corticale et sous corticale, et de la matière blanche) déclinent plus ou moins rapidement tandis que le volume des ventricules augmente. C’est une diminution des connexions neuronales que révèle l’analyse morphologique et non une perte de neurones. L’arborisation dendritique s’appauvrit, particulièrement au niveau du cortex frontal et de l’hippocampe, indiquant une diminution de la plasticité synaptique, à la source des effets psychologiques. Il faut remarquer que certains adultes vieillissants obtiennent des performances mémorielles remarquables et l’imagerie I.R.M. montre la mise en place de nouveaux réseaux, indiquant que la plasticité est une arme dans le combat contre le vieillissement.
Le développement de ces troubles, parfois voisins des signes cliniques d’une maladie neurodégénérative, suggère un continuum entre le normal et le pathologique. Néanmoins, l’amélioration de la compréhension des deux processus aux niveaux cellulaire et moléculaire permet de les distinguer.
Le vieillissement est un phénomène complexe avec de nombreuses déficiences cellulaires dont la plus remarquable (Baker & Petersen, 2018) est le développement de l’état de sénescence (Figure 3). À la suite d’un stress, la cellule arrête de se diviser, change de morphologie, et prend un phénotype sécrétoire, libérant des facteurs inflammatoires (peptides, protéases, ARN) conduisant à son élimination par le système immunologique. Le stress peut être d’origines variées, physiologiques (c’est-à-dire causées par le fonctionnement de la cellule : érosion télomérique, stress oxydant) ou non (radiations ionisantes, chimiothérapie, activation d’oncogènes, altération de structures nucléaires). La sénescence peut être bénéfique et même programmée au cours du développement, mais avec l’âge, l’accumulation de cellules sénescentes et le ralentissement de leur élimination produisent un état de stress chronique et perturbent le fonctionnement des tissus.
La sénescence est actuellement reconnue comme un mécanisme responsable du vieillissement non pathologique du cerveau (Kritsilis et al., 2018), mais cette reconnaissance a pris du temps. Initialement, cette notion s’appliquait à des cellules susceptibles de division et la très grande majorité des neurones ne sont pas mitotiques. Toutefois, le tissu cérébral contient un nombre sensiblement égal de neurones et de cellules gliales qui, elles, sont mitotiques.
Parmi les cellules gliales, les astrocytes sont les plus abondants (20 % des cellules du cerveau) et leur rôle apparaît de plus en plus nettement. Ils participent au maintien de l’homéostasie (apport des nutriments, élimination des déchets), ainsi qu’au fonctionnement de la synapse glutamatergique tripartite. Les cultures cellulaires d’astrocytes vieillissants montrent des signes clairs de sénescence. Le peptide Aβ42, caractéristique de la maladie d’Alzheimer, active aussi leur sénescence.
Les cellules de la microglie représentent une autre catégorie de cellules gliales, importante dans la réponse immunitaire innée du système nerveux. Comme pour les précédentes, le vieillissement déclenche chez ces cellules le phénotype caractéristique de la sénescence.
Un état de type sénescence a été décrit dans les neurones de souris vieillissantes, incluant des dommages sévères de l’ADN, une forte production d’espèces activées de l’oxygène, une sécrétion d’interleukine 6, la formation d’hétérochromatine et une activité bêta galactosidase élevée, qui sont des caractéristiques des cellules sénescentes. Selon les auteurs, cet état est induit par des dommages affectant l’ADN. Cet état est retrouvé chez 40 à 80 % des cellules de Purkinje du cervelet et 20 à 40 % des neurones de l’hippocampe et du cortex.
Le mécanisme par lequel la cellule sénescente dégrade l’arborisation dendritique n’est pas connu, mais il est vraisemblable qu’il est provoqué par l’inflammation chronique associée à cet état.
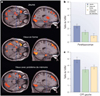 |
Figure 1 IRM fonctionnelle dans un test de mémoire. (a). Chez les sujets jeunes et les vieux « en forme », sans problèmes de mémoire, on observe une activation (couleurs chaudes) dans l’aire impliquée dans la mémoire (Parahippocampus, repéré par le réticule), qui n’est pas vue chez les vieux avec des troubles de la mémoire. (b). Quantification de l’effet. Chez les sujets âgés présentant des déficits mnésiques, l’activation est quasi absente dans l’aire parahippocampale, alors qu’elle est toujours présente dans le Cortex Pré-Frontal (CPF) (d’après Hedden & Gabrieli, 2004). |
 |
Figure 2 Évolution de paramètres structuraux du cerveau. Les données correspondent à l’agrégation de plus de 100 000 spectres obtenus par I.R.M. Elles sont exprimées en pourcentage du maximum en fonction de l’âge, en coordonnées semi-logarithmiques. Noter la diminution du volume des matières grise et blanche et de l’épaisseur du cortex chez le sujet âgé; au contraire, le volume des ventricules augmente à partir de 40 ans (d’après Bethlehem et al., 2022). |
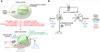 |
Figure 3 (A). Passage d’une cellule mitotique à la sénescence. En rouge, sont notés les différents stress capables d’induire la transformation. Outre le changement de forme, des différences apparaissent dans le fonctionnement de la cellule : l’arrêt du cycle cellulaire, une activité β-galactosidase cytoplasmique (SA β-gal), une augmentation des espèces activées de l’oxygène (ROS), une résistance à l’apoptose, l’apparition d’hétérochromatine, et surtout la sécrétion de facteurs inflammatoires (SASP : senescence-associated secretory phenotype). (B). Modifications liées à la sénescence dans les différents types cellulaires du cerveau. La sénescence peut toucher les cellules gliales (astrocytes et microglie), mais aussi les neurones et leurs progéniteurs (SCN : Stem Cell Neural) ; le phénomène reste à caractériser pour les oligodendrocytes (d’après Baker & Petersen, 2018). |
Le développement des maladies neurodégénératives
Pour l’ensemble des maladies citées plus haut, les signes biologiques précèdent les symptômes cliniques. En particulier, on observe l’apparition d’agrégats visibles en microscopie optique, dans ou hors des neurones.
Dans le cas de la maladie d’Alzheimer, deux sortes de structure sont caractéristiques : (i) entre les cellules, des plaques séniles formées par l’agrégation du peptide Aβ42, dérivé de la protéine amyloïde, un composant de la membrane des neurones et (ii) dans les cellules, des enchevêtrements de filaments, formés à partir d’un composant du cytosquelette tubulaire, la protéine tau.
La maladie de Parkinson est caractérisée par la disparition des neurones dopaminergiques de la substance noire, un noyau du mésencéphale contrôlant le mouvement. Dans les cellules malades, apparaissent des structures granulaires, les corps de Lewy, formés à partir d’une protéine cellulaire, l’α-synucléine, dont la fonction est inconnue.
Dans la maladie de Charcot (sclérose latérale amyotrophique), la situation est plus confuse. On observe une dégénérescence des motoneurones associée à des mutations (somatiques ou héréditaires) de protéines cellulaires qui forment alors des amas à l’intérieur des cellules.
L’étude de la maladie de Creutzfeldt–Jakob (encéphalopathie spongiforme subaiguë transmissible) a mis en évidence une protéine, le prion, qui est un composant physiologique des neurones, mais qui, dans sa forme pathogène, produit des agrégats amyloïdes insolubles.
Ainsi, de manière remarquable, les agents toxiques dérivent de protéines cellulaires et on parle de protéinopathies. Comment des protéines cellulaires deviennent-elles toxiques ? La réponse a été fournie par l’étude de la protéine prion (Brettschneider et al., 2015). Celle-ci existe sous deux conformations, c’est-à-dire qu’à une même séquence d’acides aminés correspondent deux organisations dans l’espace différentes, avec des propriétés différentes. La protéine cellulaire, PrPc, est riche en hélices alpha, soluble et sensible aux protéases tandis que la forme pathologique, PrPsc, comporte des feuillets bêta, formant des polymères amyloïdes insolubles et résistants aux protéases. De plus, la forme pathologique, lorsqu’elle contacte la forme cellulaire, déclenche sa conversion et sa participation aux polymères insolubles.
Les agrégats amyloïdes désorganisent la cellule et entraînent sa rupture, et ces polymères relâchés dans l’espace intercellulaire sont internalisés par le neurone voisin, permettant ainsi la propagation de la destruction neuronale. Ce phénomène de conformation anormale d’une protéine cellulaire est commun aux maladies que nous avons citées. Dans le schéma général, la maladie est induite par l’apparition de cette conformation anormale qui déclenche (i) l’accumulation de protéines non dégradées qui s’agrègent et (ii) la désorganisation des réseaux neuronaux.
À l’appui de cette théorie, la propagation de la dégénérescence suit des chemins constants, caractéristiques de la maladie (Figure 4).
 |
Figure 4 Envahissement du cerveau par différents agrégats toxiques pendant les maladies neurodégénératives. La progression des agrégats depuis les aires foncées vers les zones claires est indiquée par des flêches pour chaque maladie (d’après Brettschneider et al., 2015). |
Relations entre vieillissement et maladies neurodégénératives
Comment le vieillissement, comment l’état de sénescence favorisent-t-ils le développement des maladies neurodégénératives ? Dans les maladies que nous avons citées, l’espèce toxique dérive de protéines physiologiques. On peut donc raisonnablement conjecturer que la sénescence favorise la formation des espèces toxiques à partir de la forme physiologique, et que la maladie n’en est peut-être que la conséquence. Une alternative à cette hypothèse mécanistique fait intervenir une altération des mécanismes d’élimination des précurseurs des agrégats toxiques, par exemple le peptide Aβ42 dans la maladie d’Alzheimer. En l’occurrence, son accumulation favoriserait l’agrégation et donc la toxicité.
Hors du cerveau, l’élimination des catabolites (déchets) du métabolisme se fait par le passage dans le système lymphatique qui conduit au foie, où ces déchets sont traités. Il n’y a pas de vaisseaux lymphatiques dans le cerveau et, pendant longtemps, on a considéré que rien ne sortait et que c’était l’organe lui-même qui possédait la faculté de traiter les déchets. Cependant, des travaux récents (Nedergaard & Goldman, 2020) ont montré l’existence d’une circulation entre le cerveau et le système lymphatique par un intermédiaire, « le système glymphatique » (Figure 5). Le liquide cérébrospinal présent dans les espaces de la méninge arachnoïde circule dans des canaux formés par des astrocytes entourant de manière jointive les artérioles. Ces astrocytes comportent dans leur membrane de multiples pores de type aquaporine (une aquaporine est une protéine insérée dans la membrane de la cellule et permettant le passage de composés de petite taille moléculaire), qui permettent au liquide cérébrospinal de pénétrer dans le tissu nerveux, au niveau d’interstices intercellulaires. Ce liquide interstitiel, mu par la pulsatilité des artères cérébrales, va diffuser et emporter les déchets via des canaux d’astrocytes organisés symétriquement au niveau des veinules efférentes.
Le vieillissement affecte les astrocytes et, par là-même, le lavage glymphatique. Chez les rongeurs âgés, le transport de marqueur ajouté au liquide cérébrospinal est diminué de 85 % et, chez l’Homme, la clairance du tissu cérébral est inversement proportionnelle à l’âge. De plus, l’infusion du peptide Aβ42 dans le liquide cérébrospinal réduit fortement le flux glymphatique, suggérant que les agrégats eux-mêmes agissent comme des inhibiteurs du lavage.
À cette dégénérescence du système glymphatique s’ajoute un autre effet lié à la qualité du sommeil. Chez la souris, des expériences visant à mettre en évidence la circulation d’un colorant ajouté au liquide cérébrospinal ont montré que celle-ci ne se produisait que pendant le sommeil, dans les phases de sommeil profond (Xie et al., 2013). Le sommeil est propice à l’homéostasie, au bon équilibre de l’organisme. Dans le cas du cerveau, la circulation du liquide interstitiel pendant le lavage glymphatique affecterait l’équilibre ionique des neurones et donc leur fonctionnement : « les femmes de ménage passent lorsque les bureaux sont fermés ». Mais alors, il faut tenir compte de la qualité du sommeil. Le sommeil est une succession de phases depuis l’endormissement jusqu’au sommeil de phases 1, puis 2, puis 3, suivi de remontées en sens inverse vers des phases de sommeil paradoxal caractérisé par des mouvements oculaires rapides. Une nuit de sommeil est la succession de ces cycles et le lavage glymphatique est optimum en phase 3 du sommeil profond.
Toutefois, cette organisation du sommeil change avec le vieillissement (Nedergaard & Goldman, 2020), sans que la cause du changement n’ait été élucidée (Figure 6). On observe une diminution de la durée totale du sommeil (10 minutes par décennie de vie), une perte du sommeil profond (phase 3) et un fractionnement plus poussé des cycles. Le résultat est clairement une diminution du lavage glymphatique.
Ainsi, ces deux évolutions liées à l’âge s’ajoutent pour produire un déclin de l’élimination des métabolites susceptible de générer des agrégats toxiques. Les protéines amyloïde-β, tau et α-synucléine sont toutes présentes à plus forte concentration dans le liquide interstitiel et dans le liquide cérébrospinal durant la veille que durant le sommeil. La privation d’une seule nuit de sommeil produit une augmentation de la charge en protéines amyloïde-β détectable dans le thalamus et dans l’hippocampe par Tomographie par Emission de Positons (TEP).
L’ensemble de ces données est résumé dans le modèle (Figure 7) proposé par Nedergaard & Goldman (2020). La fonction glymphatique réside à l’intersection d’un ensemble de désordres qui, en l’affectant, vont favoriser l’agrégation des espèces toxiques et la neurodégénérescence.
 |
Figure 5 Le lavage glymphatique. (A). Dans le cerveau sain. Le liquide cérébrospinal (LCS) circule le long des artérioles dans un canal formé par les astrocytes (en jaune), puis il rentre dans les espaces entre les neurones en traversant la membrane des astrocytes par des aquaporines. Il circule alors dans les espaces interneuronaux puis sort de manière symétrique vers les veinules. (B). Dans le cerveau Alzheimer. Les aquaporines sont moins nombreuses, de nombreux neurones disparaissent, la microglie et les astrocytes activés participent à cette disparition, des plaques séniles encombrent l’espace. La circulation est moins efficace (d’après Nedergaard & Goldman, 2020). |
 |
Figure 6 La qualité du sommeil varie avec l’âge. Les différentes phases du sommeil au cours de la nuit sont représentées pour deux âges différents. REM : Rapid Eye Movement, Sommeil paradoxal ; NREM, sommeil lent (d’après Nedergaard & Goldman, 2020). |
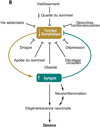 |
Figure 7 Importance fonctionnelle et inhibiteurs potentiels du lavage glymphatique. Le blocage du lavage glymphatique favorise la formation des agrégats toxiques, provoquant la maladie. Les agrégats sont eux-mêmes des inhibiteurs du lavage (d’après Nedergaard & Goldman, 2020). |
Conclusion
Ainsi les maladies neurodégénératives ont une pathophysiologie bien différente du vieillissement cérébral, même si la sénescence peut aussi conduire à la démence sénile. Dans le vieillissement, une inflammation chronique est certainement l’élément principal. Des traitements qui permettraient d’empêcher l’accumulation des cellules sénescentes amélioreraient les performances cognitives et des efforts de recherche vont dans ce sens, soit pour détruire les cellules sénescentes (traitement sénolytique) soit pour atténuer leurs effets. Des progrès dans cette voie auraient certainement un impact sur l’incidence des maladies neurodégénératives, pour lesquelles il n’existe pas actuellement de traitement efficace.
Le modèle proposé insiste aussi sur l’importance du sommeil. La fonction du sommeil reste mystérieuse. Cette activité occupe 30 % de notre vie et elle est indispensable. Un déficit en sommeil produit une « pression d’endormissement » le jour suivant. Chez le rongeur, la privation de sommeil conduit à la mort. Selon le modèle, une des raisons de cette exigence serait le lavage glymphatique. Celui-ci devient problématique avec le vieillissement et une publication très récente (Li et al., 2022) propose une durée optimale du sommeil de 7 heures pour éviter un déclin des capacités cognitives. L’analyse quantitative montre une association entre durée du sommeil, structure du cerveau, cognition et santé mentale.
Références
- Baker, D.J., Petersen, R.C. (2018). Cellular senescence in brain aging and neurodegenerative diseases: evidence and perspectives. J Clin Invest , 128, 1208-1216. [CrossRef] [PubMed] [Google Scholar]
- Bethlehem, R.A.I., et al. (208 co-authors). (2022). Brain charts for the human lifespan. Nature , 604, 525-533. [CrossRef] [PubMed] [Google Scholar]
- Brettschneider, J., Del Tredici, K., Lee, V.M., Trojanowski, J.Q. (2015). Spreading of pathology in neurodegenerative diseases: a focus on human studies. Nat Rev Neurosci , 16, 109-120. [CrossRef] [PubMed] [Google Scholar]
- Hedden, T., Gabrieli, J.D.E. (2004). Insights into the ageing mind: a view from cognitive neuroscience. Nat Rev Neurosci , 5, 87-96. [CrossRef] [PubMed] [Google Scholar]
- Kritsilis, M., Rizou, S.V., Koutsoudaki, P.N., Evangelou, K., Gorgoulis, V.G., Papadopoulos, D. (2018). Ageing, cellular senescence and neurodegenerative disease. Int J Mol Sci , 19, 2937. [CrossRef] [Google Scholar]
- Li, Y., Sahakian, B.J., Kang, J., Langley, C., Zhang, W., Xie, C., Xiang, S., Yu, J., Cheng, W. (2022). The brain structure and genetic mechanisms underlying the nonlinear association between sleep duration, cognition and mental health. Nat Aging , 2, 425-437. [CrossRef] [Google Scholar]
- Nedergaard, M., Goldman, S.A. (2020). Glymphatic failure as a final common pathway to dementia. Science , 370, 50-56. [CrossRef] [PubMed] [Google Scholar]
- Xie, L., Kang, H., Xu, Q., Chen, J., Liao, Y., Thiyagarajan, M., O’Donnell, J., Christensen, D.J., Nicholson, C., Nedergaard, M. (2013). Sleep drives metabolite clearance from the adult brain. Science , 342, 373-377. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Henry, J.-P. (2022). Les maladies neurodégénératives et le vieillissement. Biologie Aujourd’hui, 216, 55-61
Liste des figures
 |
Figure 1 IRM fonctionnelle dans un test de mémoire. (a). Chez les sujets jeunes et les vieux « en forme », sans problèmes de mémoire, on observe une activation (couleurs chaudes) dans l’aire impliquée dans la mémoire (Parahippocampus, repéré par le réticule), qui n’est pas vue chez les vieux avec des troubles de la mémoire. (b). Quantification de l’effet. Chez les sujets âgés présentant des déficits mnésiques, l’activation est quasi absente dans l’aire parahippocampale, alors qu’elle est toujours présente dans le Cortex Pré-Frontal (CPF) (d’après Hedden & Gabrieli, 2004). |
| Dans le texte | |
 |
Figure 2 Évolution de paramètres structuraux du cerveau. Les données correspondent à l’agrégation de plus de 100 000 spectres obtenus par I.R.M. Elles sont exprimées en pourcentage du maximum en fonction de l’âge, en coordonnées semi-logarithmiques. Noter la diminution du volume des matières grise et blanche et de l’épaisseur du cortex chez le sujet âgé; au contraire, le volume des ventricules augmente à partir de 40 ans (d’après Bethlehem et al., 2022). |
| Dans le texte | |
 |
Figure 3 (A). Passage d’une cellule mitotique à la sénescence. En rouge, sont notés les différents stress capables d’induire la transformation. Outre le changement de forme, des différences apparaissent dans le fonctionnement de la cellule : l’arrêt du cycle cellulaire, une activité β-galactosidase cytoplasmique (SA β-gal), une augmentation des espèces activées de l’oxygène (ROS), une résistance à l’apoptose, l’apparition d’hétérochromatine, et surtout la sécrétion de facteurs inflammatoires (SASP : senescence-associated secretory phenotype). (B). Modifications liées à la sénescence dans les différents types cellulaires du cerveau. La sénescence peut toucher les cellules gliales (astrocytes et microglie), mais aussi les neurones et leurs progéniteurs (SCN : Stem Cell Neural) ; le phénomène reste à caractériser pour les oligodendrocytes (d’après Baker & Petersen, 2018). |
| Dans le texte | |
 |
Figure 4 Envahissement du cerveau par différents agrégats toxiques pendant les maladies neurodégénératives. La progression des agrégats depuis les aires foncées vers les zones claires est indiquée par des flêches pour chaque maladie (d’après Brettschneider et al., 2015). |
| Dans le texte | |
 |
Figure 5 Le lavage glymphatique. (A). Dans le cerveau sain. Le liquide cérébrospinal (LCS) circule le long des artérioles dans un canal formé par les astrocytes (en jaune), puis il rentre dans les espaces entre les neurones en traversant la membrane des astrocytes par des aquaporines. Il circule alors dans les espaces interneuronaux puis sort de manière symétrique vers les veinules. (B). Dans le cerveau Alzheimer. Les aquaporines sont moins nombreuses, de nombreux neurones disparaissent, la microglie et les astrocytes activés participent à cette disparition, des plaques séniles encombrent l’espace. La circulation est moins efficace (d’après Nedergaard & Goldman, 2020). |
| Dans le texte | |
 |
Figure 6 La qualité du sommeil varie avec l’âge. Les différentes phases du sommeil au cours de la nuit sont représentées pour deux âges différents. REM : Rapid Eye Movement, Sommeil paradoxal ; NREM, sommeil lent (d’après Nedergaard & Goldman, 2020). |
| Dans le texte | |
 |
Figure 7 Importance fonctionnelle et inhibiteurs potentiels du lavage glymphatique. Le blocage du lavage glymphatique favorise la formation des agrégats toxiques, provoquant la maladie. Les agrégats sont eux-mêmes des inhibiteurs du lavage (d’après Nedergaard & Goldman, 2020). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


