| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 1-2, 2022
|
|
|---|---|---|
| Page(s) | 49 - 53 | |
| DOI | https://doi.org/10.1051/jbio/2022011 | |
| Publié en ligne | 25 juillet 2022 | |
Article
La boîte à outils de l’évolution développementale ou comment les poissons cavernicoles mexicains ont perdu leurs yeux
The toolbox of developmental evolution or how Mexican cave fishes lost their eyes
Institut de neurosciences Paris-Saclay, CNRS et Université Paris-Saclay, 91400 Saclay, France
* Auteur correspondant : sylvie.retaux@cnrs.fr
Reçu :
26
Avril
2022
Le poisson Astyanax mexicanus se présente sous deux formes très différentes : un morphe de rivière « normal », et un morphe cavernicole, aveugle et dépigmenté, vivant dans l’obscurité totale et permanente de grottes mexicaines. Cette espèce est en passe de devenir un modèle de choix en biologie évolutive et comparée, tant pour l’étude de l’évolution des comportements, de la physiologie ou de la morphologie, que pour la génétique moléculaire ou la génétique des populations. Je présente ici l’avancée des connaissances dans le domaine de l’évolution développementale de l’œil du morphe cavernicole. En remontant dans le temps son développement « à l’envers » depuis l’œil de la larve jusqu’au champ rétinien en fin de gastrulation, l’embryon d’Astyanax cavernicole révèle des mécanismes et processus susceptibles de contribuer aux variations évolutives entre espèces et aux variations pathologiques de la morphogenèse de la région optique.
Abstract
The fish Astyanax mexicanus comes in two very different forms: a “normal” river morph, and a blind, depigmented cave morph, living in the total and permanent darkness of Mexican caves. This species is on the way to becoming a model of choice in evolutionary and comparative biology, both for the study of the evolution of behavior, physiology or morphology, and for molecular genetics or population genetics. Here, I present the advancement of knowledge in the field of the developmental evolution of the eye of the cave morph. By rewinding back in time its development from the eye of the larva to the retinal field at the end of gastrulation, the cave-dwelling Astyanax embryo reveals mechanisms and processes likely to contribute to evolutionary variations between species, but also to pathological variations in the morphogenesis of the optic region.
Mots clés : dégénérescence / morphogenèse / plaque neurale / facteurs de transcription / signalisation embryonnaire
Key words: degeneration / morphogenesis / neural plate / transcription factors / embryonic signaling
© Société de Biologie, 2022
Introduction
Évolution développementale, ou évo-dévo : de quoi s’agit-il ? C’est une discipline à la croisée de la biologie de l’évolution et de celle du développement, qui recherche dans les processus développementaux l’origine de l’extraordinaire diversité morphologique des êtres vivants, ainsi que des grandes transitions ou innovations évolutives. Faire apparaître un nouveau trait ou perdre une structure, en changer l’organisation, la taille, la forme, la couleur ou les modalités fonctionnelles, tels sont les pouvoirs des mécanismes étudiés en évo-dévo. Souvent, pour étudier l’évolution développementale, les chercheurs n’utilisent pas les souris de laboratoire, les mouches du vinaigre ou l’arabette des dames. Ils ont recours à des modèles plus originaux qui présentent des traits particuliers, choisis pour poser des questions spécifiques, mais qui doivent néanmoins répondre à un certain nombre de critères techniques pour être de bons modèles de laboratoire.
Il existe en Amérique centrale un poisson nommé Astyanax mexicanus, qui a la particularité et l’avantage de se présenter sous deux éco-morphotypes très différents (Figure 1A). L’un, joliment coloré, est endémique dans les mares et les cours d’eau. L’autre, aveugle et dépigmenté, peuple une trentaine de grottes creusées dans les montagnes karstiques du nord-est du Mexique (Mitchell et al., 1977 ; Elliott, 2018). Pendant son évolution et son adaptation dans l’obscurité totale et permanente, le morphe cavernicole a changé tant d’un point de vue morphologique, que physiologique ou comportemental. Et cela s’est produit très rapidement, probablement en moins de 20 000 ans (Fumey et al., 2018 ; Policarpo et al., 2021). Il s’agit donc d’un modèle particulièrement remarquable de « micro évo-dévo », à très courte échelle évolutive.
Les deux formes de ce poisson sont très différentes et avaient d’ailleurs été considérées initialement comme deux espèces distinctes (Anoptichtys jordani pour la forme aveugle, du nom de son découvreur Basil Jordan) (Jordan, 1936). Pourtant, il s’agit bien de la même espèce, selon la définition biologique du terme : les deux formes se croisent et donnent une descendance fertile, dans la nature comme au laboratoire, nous offrant un outil génétique précieux pour comprendre les mécanismes moléculaires de cette évolution spectaculaire. Le déterminisme génétique de l’albinisme de l’Astyanax cavernicole a d’ailleurs été découvert en croisant les deux formes. Des études de génétique quantitative sur des hybrides de deuxième génération ont révélé des mutations sur le gène oca2, pour ocular and cutaneous albinism 2, le même gène qui, chez l’Homme, perturbe la production de mélanine chez les albinos (Protas et al., 2006). D’un point de vue génétique, le phénotype anophtalme du morphe cavernicole adulte est un trait beaucoup plus complexe, puisqu’il implique entre 12 et 15 loci, aucun n’étant encore identifié pour le moment.
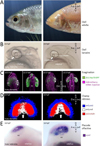 |
Figure 1 Développement comparé de l’œil chez les deux morphes de l’espèce Astyanax mexicanus . Sur toute la figure, la colonne de gauche montre le morphe de surface et la colonne de droite montre le morphe cavernicole. Les stades et l’orientation des photographies sont indiqués. A : photographies de la tête chez l’adulte. B : photographies de la tête chez des larves de 24 hpf (juste écloses). Noter les différences de taille et de forme de l’œil, et le colobome cavernicole. C : images extraites de films réalisés in vivo sous un microscope à feuille de lumière sur des lignées transgéniques Zic1:hsp70:GFP (fluorescence verte permettant de suivre le tissu présomptif de la rétine et du télencéphale qui expriment le facteur de transcription zic1) et après injection, au stade une cellule, d’ARN H2B-mCherry (fluorescence rose qui permet de visualiser les noyaux de toutes les cellules de l’embryon). vo : vésicule optique ; tn :tube neural. Les flèches indiquent les mouvements des cellules et du tissu optique lors de l’évagination (photo de gauche) et lors de l’élongation des vésicules optiques (photo de droite). Noter les différences de taille. D : images après segmentation de doubles hybridations in situ fluorescentes pour les facteurs de transcription rx3 et zic1. Le code couleur pour la co-expression est indiqué à droite. Noter les différences de tailles et de formes du domaine d’expression de rx3 (pointillé blanc) ainsi que des deux sous-domaines définis au sein du domaine rx3 par la combinatoire avec le gène zic1 (flèche blanche). E : photographies après hybridation in situ pour le facteur de transcription eya2, marqueur de la placode olfactive (olf). Noter la différence de taille de l’épithélium olfactif présomptif. |
Un œil dégénéré
Ayons donc recours à l’évo-dévo et la biologie comparée pour comparer le système visuel chez les deux morphes d’Astyanax. La première surprise est que le primordium oculaire se développe quasi-normalement chez l’embryon cavernicole. L’œil est un peu plus petit et sa partie ventrale est affectée – on parle de colobome –, mais il est bien là (Figure 1B). En fait, à partir d’environ 30 heures post-fécondation (hpf), le cristallin entre en apoptose de manière massive (Yamamoto et Jeffery, 2000 ; Alunni et al., 2007), ce qui va déclencher la perte progressive et totale de l’œil par dégénérescence. Chez l’adulte, le kyste résiduel est recouvert de peau, invisible et non fonctionnel (Figure 1A). Le rôle « instructif » du cristallin dans le déclenchement de cette dégénérescence a été montré par d’élégantes expériences de transplantation embryonnaire : un cristallin cavernicole transplanté à 24 hpf au centre de la coupe optique d’un embryon de surface provoque sa dégénérescence, alors qu’un cristallin de surface transplanté à 24 hpf au centre la coupe optique d’un embryon cavernicole « sauve » l’œil cavernicole (Yamamoto et Jeffery, 2000). Le défaut génétique qui provoque l’apoptose du cristallin est inconnu, mais il semble qu’une dérégulation et un défaut d’expression de la cristalline alpha-A, petite chaperonne anti-apoptotique, participent au processus (Ma et al., 2014 ; Hinaux et al., 2015, 2017).
Un œil malformé
Avant de dégénérer, l’œil cavernicole est tout de même un peu défectueux (Figure 1B) : il est microphtalme (petit) et colobomateux : il lui manque une partie du tissu rétinien au niveau de la fissure ventrale qui n’est pas bien fermée, comme dans le colobome humain (du grec κολοβομα, mutilé, tronqué) (Pottin et al., 2011). Voyons donc ce que l’évo-dévo peut nous dire sur ce dernier défaut de morphogenèse de l’œil cavernicole. Les embryons d’Astyanax – à l’instar de ceux de poisson zèbre – présentent un avantage majeur, celui d’être transparents. Il est donc possible de réaliser des expériences d’imagerie « live » in vivo, sur des lignées transgéniques exprimant des protéines reportrices fluorescentes, pour suivre les mouvements des cellules et des tissus pendant la formation de structures complexes comme celles de l’œil (Figure 1C). La comparaison de ces processus chez les embryons des deux morphes a montré que les cellules du primordium optique cavernicole se comportent de manière aberrante (Devos et al., 2021). D’abord, au moment de l’évagination des vésicules optiques (mouvement vers l’extérieur à partir du tube neural), les cellules cavernicoles ont des trajectoires zigzagantes et parcourent de plus petits trajets dans l’espace en 3D, et les vésicules optiques qui en résultent sont de petite taille (Figure 1C). Ceci se produit malgré une vitesse de migration équivalente à celle des cellules d’embryons de surface, ce qui suggère que les cellules cavernicoles possèdent un appareil migratoire fonctionnel, mais manquent d’informations d’orientation. Ensuite, pendant l’étape d’invagination (repliement de la vésicule optique pour former une cupule autour du cristallin), les mouvements du tissu optique cavernicole sont à nouveau défectueux, ce qui est pour partie responsable de la malformation ventrale au niveau de la fissure optique et du phénotype colobomateux.
Un œil tronqué
Rebroussons encore le chemin du développement de l’œil jusqu’au stade le plus précoce où l’on puisse identifier le tissu optique présomptif : la fin de la gastrulation, lorsque l’ectoderme neural a été spécifié, et que la plaque neurale (le futur cerveau, dont la rétine de l’œil fait partie) est formée, avec son aspect caractéristique en fer à cheval (Figure 1D). Chez tous les vertébrés, une grande partie de cette plaque neurale antérieure correspond au « champ rétinien » (eyefield). Si l’on compare à ce stade les destins présomptifs des cellules individuelles situées en position homologue sur une plaque neurale d’embryon cavernicole et d’embryon de surface, la « fate map » obtenue est sensiblement différente : les cellules du champ rétinien médian sont bien destinées à la rétine chez les embryons de surface, mais chez les embryons cavernicoles, elles sont plutôt destinées à rester dans le tube neural, au niveau de la zone pré-optique/hypothalamique (Pottin et al., 2011). Cela suggère que la régionalisation et l’acquisition de l’identité des cellules du champ rétinien sont affectées chez le morphe cavernicole. De fait, si l’on compare maintenant les patrons d’expression détaillés d’une série de facteurs de transcription qui confèrent son identité au primordium optique, l’on est assez surpris (Agnès et al., 2022). D’abord, l’expression combinatoire de ces facteurs de transcription révèle une régionalisation et une sub-régionalisation du champ rétinien qui étaient totalement insoupçonnées à un stade si précoce. Ensuite, la comparaison surface/cavernicole révèle une multitude de différences, tant au niveau de la taille et de la forme en 3D des sous-parties du champ rétinien, qu’au niveau des taux d’expression de ces facteurs de transcription à l’échelle tissulaire et cellulaire, ou encore au niveau de l’identité des cellules en bordure ou à la frontière du champ rétinien (Figure 1D). Le facteur de transcription rx3 illustre à lui seul une sorte de concentré des défauts du champ rétinien cavernicole en comparaison du champ rétinien « normal » (de surface) : son domaine d’expression est plus petit en volume et de forme différente ; son niveau d’expression cellulaire est faible et inhomogène ; et il est exprimé de façon ectopique ou inappropriée par des cellules n’appartenant pas au champ rétinien. Ces phénotypes sont particulièrement frappants et concourent probablement à l’origine de la petite taille de la vésicule optique et de l’œil subséquent, au comportement aberrant des cellules lors de la morphogenèse des vésicules et de la coupe optique, et à la malformation ventrale ou colobome de l’œil cavernicole.
Un œil échangé
En remontant encore le fil du développement, la question qui se pose naturellement est celle de l’origine de ces modifications de taille et de patterning du champ rétinien. C’est là que les voies de signalisation responsables de l’établissement des axes embryonnaires entrent en jeu. On sait que, chez l’embryon cavernicole, les signalisations Hedgehog, Fgf, Wnt et Bmp se déploient toutes de façon subtilement différente, dans le temps, dans l’espace et en intensité (Yamamoto et al., 2004 ; Pottin et al., 2011 ; Hinaux et al., 2016 ; Torres-Paz et al., 2019). De telles variations sont susceptibles d’avoir des conséquences importantes. Et, en effet, les manipulations pharmacologiques de ces voies, pendant la gastrulation, chez l’embryon d’un morphe pour mimer la situation de l’autre, donnent les résultats attendus. Par exemple, une inhibition de la signalisation Fgf chez l’embryon cavernicole (chez qui fgf8 est exprimé un peu plus tôt que chez l’embryon de surface) restaure la partie ventrale de l’œil et le colobome (Pottin et al., 2011). À l’inverse, l’activation de la voie Wnt-βcaténine chez des embryons de surface (chez qui la voie est plus fortement réprimée que chez l’embryon cavernicole) induit un colobome (Torres-Paz et al., 2019).
Et ce n’est pas tout. Les subtiles modulations de voies de signalisation pendant la gastrulation et la neurulation des embryons cavernicoles affectent certes les tissus optiques présomptifs en faisant varier leurs bordures et frontières, mais elles affectent aussi les tissus adjacents. Par exemple, la signalisation Hedgehog, plus forte chez les embryons cavernicoles que chez ceux de surface, est en partie responsable de la petite taille du cristallin cavernicole (Figure 1B). Mais le corollaire est que le tissu adjacent au cristallin présomptif, le futur épithélium olfactif tapissant la narine, voit son domaine présomptif s’élargir à la suite d’une sorte d’échange ou trade-off entre les deux destins sensoriels – visuel ou olfactif – dans la placode antérieure (Hinaux et al., 2016) (Figure 1E). Ainsi, l’embryon cavernicole va finir par perdre son œil qui souffre de multiples défauts développementaux, mais la pléiotropie des voies de signalisation va aussi affecter le développement d’autres organes, avec des conséquences adaptatives potentiellement majeures pour la survie en l’absence de lumière. En effet, les alevins et les adultes cavernicoles possèdent des capacités olfactives bien supérieures à celles de leurs con-spécifiques de rivières (Hinaux et al., 2016 ; Blin et al., 2018, 2020).
Conclusions
L’étude du développement de l’œil chez l’A. mexicanus cavernicole a révélé bien des surprises.
Tout d’abord, il est surprenant qu’un œil se développe avant de dégénérer, ce qui semble énergiquement coûteux et apparaît comme un investissement à perte pour l’embryon. Ce phénomène est une parfaite illustration de contrainte développementale à l’évolution morphologique : les mouvements de morphogenèse de l’œil sont absolument nécessaires à la formation du système nerveux et l’embryon ne peut donc pas en faire l’économie.
Ensuite, il est étonnant de constater qu’en étudiant l’organisation de la plaque neurale antérieure en fin de gastrulation, on puisse quasiment prédire quelles seront la taille et la forme des organes sensoriels chez l’adulte. Montre-moi ta plaque neurale, et je te dirai quelle morphologie tu auras ! Ces variations observées entre les deux morphes d’Astyanax procèdent probablement des mêmes principes développementaux que les variations morphologiques observées entre espèces de vertébrés.
Enfin, il est remarquable que de subtiles variations de signalisation pendant la gastrulation puissent, par pléiotropie et tout en restant viables, occasionner des échanges sensoriels qui se révèlent être parfaitement adaptatifs. Ces observations suggèrent que des phénomènes de sélection indirecte sont certainement à l’œuvre pour l’évolution du poisson cavernicole dans l’obscurité permanente. L’œil serait ainsi perdu comme une sorte de dégât collatéral, à la suite des changements touchant d’autres organes, et qui sont, eux, sélectionnés car avantageux pour la vie dans l’obscurité.
Remerciements
Je tiens à remercier très sincèrement l’ensemble des membres de l’équipe DECA qui ont participé à l’aventure Astyanax depuis 2004. Le travail présenté lors de mon séminaire à la Société de Biologie concernait le développement de l’œil, c’est-à-dire le travail principal – par ordre chronologique d’arrivée dans l’équipe – de Karen Pottin, Hélène Hinaux, Lucie Devos, Jorge Torres-Paz, Julien Leclercq, François Agnès. Je remercie aussi le soutien financier apporté au fil des années par deux contrats ANR, deux labellisations (Équipes) FRM, Retina France et Aviesan/Unadev.
Références
- Agnès, F., Torres-Paz, J. Rétaux, S. (2022). A 3D molecular map of the cavefish neural plate illuminates eye-field organization and its borders in vertebrates. Development , 149, dev199966. [CrossRef] [PubMed] [Google Scholar]
- Alunni, A., Menuet, A., Candal, E., Penigault, J.B., Jeffery, W., Rétaux, S. (2007). Developmental mechanisms for retinal degeneration in the blind cavefish Astyanax mexicanus . J Comp Neurol , 505, 221-233. [CrossRef] [PubMed] [Google Scholar]
- Blin, M., Tine, E., Meister, L., Elipot, Y., Bibliowicz, J., Espinasa, L., Rétaux, S. (2018). Developmental evolution and developmental plasticity of the olfactory epithelium and olfactory skills in Mexican cavefish. Dev Biol , 441, 242-251. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Blin, M., Fumey, J., Lejeune, C., Policarpo, M., Leclercq, J., Père, S., Torres-Paz, J., Pierre, C., Imarazene, B., Rétaux, S. (2020). Diversity of olfactory responses and skills in Astyanax mexicanus cavefish populations inhabiting different caves. Diversity , 12, 1-21. [Google Scholar]
- Devos, L., Agnès, F., Edouard, J., Simon, V., Legendre, L., Elkhallouki, N., Barbachou, S., Sohm, F., Rétaux, S. (2021). Eye morphogenesis in the blind Mexican cavefish. Biology Open , 15, 10, bio059031. [CrossRef] [PubMed] [Google Scholar]
- Elliott, W.R. (2018). The Astyanax caves of Mexico: cavefishes of Tamaulipas, San Luis Potosi, and Guerrero. Association for Mexican cave studies, Bulletin, 26. [Google Scholar]
- Fumey, J., Hinaux, H., Noirot, C., Thermes, C., Rétaux, S., Casane, D. (2018). Evidence for late Pleistocene origin of Astyanax mexicanus cavefish. BMC Evol Biol , 18, 43. [CrossRef] [PubMed] [Google Scholar]
- Hinaux, H., Blin, M., Fumey, J., Legendre, L., Heuze, A., Casane, D., Rétaux, S. (2015). Lens defects in Astyanax mexicanus cavefish: evolution of crystallins and a role for alphaA-crystallin. Dev Neurobiol , 75, 505-521. [CrossRef] [PubMed] [Google Scholar]
- Hinaux, H., Devos, L., Bibliowicz, J., Elipot, Y., Alié, A., Blin, M., Rétaux, S. (2016). Sensory evolution in blind cavefish is driven by early events during gastrulation and neurulation. Development , 143, 4521-4532. [CrossRef] [PubMed] [Google Scholar]
- Hinaux, H., Recher, G., Alié, A., Legendre, L., Blin, M., Rétaux, S. (2017). Lens apoptosis in the Astyanax blind cavefish is not triggered by its small size or defects in morphogenesis. PLoS One , 12, e0172302. [CrossRef] [PubMed] [Google Scholar]
- Jordan, B.C. (1936). Bringing in the new cavefish, Anoptichthys jordani . Aquarium , 15, 203-204. [Google Scholar]
- Ma, L., Parkhurst, A., Jeffery, W.R. (2014). The role of a lens survival pathway including sox2 and alphaA-crystallin in the evolution of cavefish eye degeneration. Evodevo , 5, 28. [CrossRef] [PubMed] [Google Scholar]
- Mitchell, R.W., Russell, W.H., Elliott, W.R. (1977). Mexican eyeless characin fishes, genus Astyanax: environment, distribution, and evolution. Spec Publ Mus Texas Tech Univ , 12, 1-89. [Google Scholar]
- Policarpo, M., Fumey, J., Lafargeas, P., Naquin, D., Thermes, C., Naville, M., Dechaud, C., Volff, J.N., Cabau, C., Klopp, C., Møller P.R., Bernatchez L, García-Machado E., Rétaux S., Casane D. (2021). Contrasting gene decay in subterranean vertebrates: insights from cavefishes and fossorial mammals. Mol Biol Evol , 38, 589-605. [CrossRef] [PubMed] [Google Scholar]
- Pottin, K., Hinaux, H., Rétaux, S. (2011). Restoring eye size in Astyanax mexicanus blind cavefish embryos through modulation of the Shh and Fgf8 forebrain organising centres. Development , 138, 2467-2476. [CrossRef] [PubMed] [Google Scholar]
- Protas, M.E., Hersey, C., Kochanek, D., Zhou, Y., Wilkens, H., Jeffery, W.R., Zon, L.I., Borowsky, R., Tabin, C.J. (2006). Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nat Genet , 38, 107-111. [CrossRef] [PubMed] [Google Scholar]
- Torres-Paz, J., Leclercq, J., Rétaux, S. (2019). Maternally regulated gastrulation as a source of variation contributing to cavefish forebrain evolution. Elife , 8, e50160. [CrossRef] [PubMed] [Google Scholar]
- Yamamoto, Y., Jeffery, W.R. (2000). Central role for the lens in cave fish eye degeneration. Science , 289, 631-633. [CrossRef] [PubMed] [Google Scholar]
- Yamamoto, Y., Stock, D.W., Jeffery, W.R. (2004). Hedgehog signalling controls eye degeneration in blind cavefish. Nature , 431, 844-847. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Rétaux, S. (2022). La boîte à outils de l’évolution développementale ou comment les poissons cavernicoles mexicains ont perdu leurs yeux. Biologie Aujourd’hui, 216, 49-53
Liste des figures
 |
Figure 1 Développement comparé de l’œil chez les deux morphes de l’espèce Astyanax mexicanus . Sur toute la figure, la colonne de gauche montre le morphe de surface et la colonne de droite montre le morphe cavernicole. Les stades et l’orientation des photographies sont indiqués. A : photographies de la tête chez l’adulte. B : photographies de la tête chez des larves de 24 hpf (juste écloses). Noter les différences de taille et de forme de l’œil, et le colobome cavernicole. C : images extraites de films réalisés in vivo sous un microscope à feuille de lumière sur des lignées transgéniques Zic1:hsp70:GFP (fluorescence verte permettant de suivre le tissu présomptif de la rétine et du télencéphale qui expriment le facteur de transcription zic1) et après injection, au stade une cellule, d’ARN H2B-mCherry (fluorescence rose qui permet de visualiser les noyaux de toutes les cellules de l’embryon). vo : vésicule optique ; tn :tube neural. Les flèches indiquent les mouvements des cellules et du tissu optique lors de l’évagination (photo de gauche) et lors de l’élongation des vésicules optiques (photo de droite). Noter les différences de taille. D : images après segmentation de doubles hybridations in situ fluorescentes pour les facteurs de transcription rx3 et zic1. Le code couleur pour la co-expression est indiqué à droite. Noter les différences de tailles et de formes du domaine d’expression de rx3 (pointillé blanc) ainsi que des deux sous-domaines définis au sein du domaine rx3 par la combinatoire avec le gène zic1 (flèche blanche). E : photographies après hybridation in situ pour le facteur de transcription eya2, marqueur de la placode olfactive (olf). Noter la différence de taille de l’épithélium olfactif présomptif. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


