| Numéro |
Biologie Aujourd’hui
Volume 217, Numéro 1-2, 2023
|
|
|---|---|---|
| Page(s) | 27 - 33 | |
| DOI | https://doi.org/10.1051/jbio/2023013 | |
| Publié en ligne | 6 juillet 2023 | |
Article
Plongée avec Françoise Dieterlen dans l’origine des cellules souches hématopoïétiques
Exploring together with Françoise Dieterlen the origin of hematopoietic stem cells
Sorbonne Université, CNRS, Inserm U1156, Institut de Biologie Paris Seine, Laboratoire de Biologie du Développement/UMR7622, 9 Quai St-Bernard, 75005 Paris, France
* Auteur correspondant : thierry.jaffredo@upmc.fr
Reçu :
13
Février
2023
Cet article récapitule les principales découvertes scientifiques réalisées par Françoise Dieterlen sur le système hématopoïétique et endothélial au cours de sa carrière qui s’est déroulée sur plus de 40 années. Ses contributions, toutes majeures, portent notamment sur la démonstration d’une source intra-embryonnaire de cellules souches hématopoïetiques impliquant la polarisation de l’aorte et la formation d’un endothélium homogénique, la mise en évidence de l’allantoïde comme organe d’amplification hématopoïétique chez l’embryon de souris et la démonstration de l’existence d’un endothélium hémogénique capable de générer des cellules souches hématopoïétiques dans la moelle osseuse de l’embryon de poulet et de souris. Cette dernière découverte, bien que n’ayant pas été réalisée directement par Françoise Dieterlen, a été inspirée par les nombreuses discussions que j’ai pu avoir avec elle et les enseignements qu’elle m’a prodigués au début de ma carrière. Les avancées remarquables accomplies par Françoise Dieterlen dans le champ du développement hématopoïétique sont unanimement reconnues par tous les spécialistes pour qui elle reste à jamais l’une des fondatrices de ce domaine de recherche.
Abstract
This article summarizes Françoise Dieterlen’s major scientific discoveries about the hematopoietic and endothelial systems during her 40 years’ career. Her most remarkable achievements include notably the demonstration of an intraembryonic source of hematopoietic stem cells, the characterization of the polarization of the aorta, the identification of a hemogenic endothelium as well as that of the allantois as an organ of hematopoietic amplification in the mouse embryo, and the demonstration of the existence of a hemogenic endothelium capable of generating hematopoietic stem cells in the bone marrow of the chicken and mouse embryo. While this last discovery was not made directly by Françoise Dieterlen, it was inspired by the many conversations I have had with her and the lessons she has taught me throughout my career. Her rich career will forever shape the field of hematopoietic development, in which she will remain a guiding figure.
Mots clés : développement hématopoïétique / chimère caille-poulet / aorte / endothélium hémogénique / allantoïde
Key words: hematopoietic development / quail-chicken chimera / aorta / hemogenic endothelium / allantois
© Société de Biologie, 2023
Abréviations
AcLDL : Lipoprotéine acétylée de basse densité
CH : Cellules hématopoïétiques
CSH : Cellules souches hématopoïétiques
DiI : Marqueur lipophilique fluorescent
Introduction
Les cellules souches hématopoïétiques (CSH) sont à l’origine de la production continue de toutes les cellules sanguines au cours de la vie. Elles sont rares et localisées dans la moelle osseuse, en étroite association avec d’autres cellules souches appelées cellules souches mésenchymateuses, qui donnent naissance au microenvironnement de la moelle osseuse.
À l’aube de l’embryologie, les scientifiques ont décrit l’émergence apparemment coïncidente de cellules endothéliales et hématopoïétiques dans le sac vitellin (SV) de l’embryon d’oiseau, donnant naissance au concept d’hémangioblaste (Murray, 1932). Il n’est pas difficile d’imaginer pourquoi le SV a été le premier site hématopoïétique à être étudié. En effet, il montre les premiers signes d’hématopoïèse attestés par la présence d’îlots sanguins hémoglobinisés et a été naturellement proposé comme le site de production des CSH. Au milieu et à la fin des années 1960, Moore et Owen ont proposé que le SV soit le site d’où émergent les CSH lors d’un événement unique et précoce du développement pour coloniser ensuite les organes hématopoïétiques définitifs (rate, thymus, bourse de Fabricius) (Moore & Owen, 1967a). Le schéma expérimental a utilisé une série de greffes et de parabioses reposant sur l’identification des chromosomes sexuels. En outre, ils ont également montré que les CSH étaient d’origine extrinsèque (Moore & Owen, 1967b). Ces deux piliers ont constitué le noyau de la théorie hématogène. Au cours des années 1970, la pertinence de cette hypothèse a été étudiée chez les mammifères en cultivant soit l’embryon de souris entier à sept jours de développement, soit le SV et/ou l’embryon séparés. La conclusion était que le SV était le seul site où les CSH étaient formées, ce qui renforçait le rôle central de ce tissu dans leur production (Moore & Metcalf, 1970). Sur la base de cette étude et d’autres rapports (Weissman et al., 1977), la théorie hématogène est devenue un dogme et a été largement acceptée par la communauté scientifique.
Démonstration d’une source intra-embryonnaire de CSH
En 1972, une technique chirurgicale permettant de construire un type unique de chimère caille/poulet a été mise au point par Claude Martin (Martin, 1972). La forme plate de l’embryon d’oiseau à la surface du SV facilite sa dissection et permet de le remplacer par l’embryon d’une autre espèce d’oiseau in ovo, ici la caille japonaise. La chimère caille/poulet dite « complémentaire » consistait à greffer un embryon de caille sur un SV de poulet à un stade de développement très précoce (Figure 1), avant l’apparition des battements cardiaques. Après cette manipulation, les vaisseaux sanguins se réanastomosent rapidement entre le corps de l’embryon greffé et le SV de l’hôte et la libre circulation des cellules sanguines s’établit entre le SV et l’embryon, sans aucune perturbation du développement normal chez les embryons chimères. Ces embryons possédaient des organes hématopoïétiques dans lesquels les cellules appartenant aux lignées sanguines dans le thymus, la rate, la bourse de Fabricius et la moelle osseuse étaient toutes d’origine caille, tandis que les cellules stromales étaient de poulet (Dieterlen-Lièvre, 1975 : Martin et al., 1978). Le sang circulant était initialement d’origine poulet (dérivé de progéniteurs du SV) jusqu’à cinq jours de développement, puis devenait de plus en plus riche en érythrocytes de caille (Beaupain et al., 1979). Le remplacement de l’hématopoïèse dérivée du SV par l’hématopoïèse intra-embryonnaire a été confirmé de façon frappante lorsque les chimères ont été construites entre des souches congéniques de poulets, différant par leurs allotypes d’immunoglobulines ou par leurs antigènes du complexe majeur d’histocompatibilité (Lassila et al., 1978). Ces résultats ont conduit à la conclusion indiscutable que les progéniteurs du SV donnent naissance à une hématopoïèse de courte durée et qu’une source intra-embryonnaire était responsable de la production à la fois des progéniteurs hématopoïétiques et des CSH qui ensemencent les organes hématopoïétiques.
De quelle partie de l’embryon venaient ces CSH ? Des amas hématopoïétiques intra-aortiques ont été décrits dès le début du 20e siècle chez les espèces aviaires et mammifères comme des groupes de cellules hématopoïétiques, situés sur le plancher aortique, faisant saillie dans la lumière du vaisseau (Dieterlen-Lièvre et al., 2006). Cette région aortique est donc apparue comme un candidat intéressant pour produire les cellules qui ensemencent les organes hématopoïétiques définitifs. Dans les chimères caille/poulet, ces amas intra-aortiques sont dérivés de la caille, c’est-à-dire qu’ils ont une origine intra-embryonnaire in situ (Dieterlen-Lièvre & Martin, 1981). De plus, la région péri-aortique de l’embryon de poulet, dissociée en cellules uniques et ensemencée dans un milieu semi-solide, donne naissance à 3–4 fois plus de colonies (érythroïdes ou macrophages) que la moelle osseuse d’un animal nouvellement éclos, ce qui atteste de la richesse hématopoïétique de l’aorte (Cormier & Dieterlen-Lièvre, 1988).
Ainsi, grâce aux travaux de Françoise Dieterlen, il est devenu clair que les CSH naissaient dans l’embryon et plus particulièrement au sein de l’aorte, un des vaisseaux majeurs de l’embryon, battant en brèche la théorie hématogène.
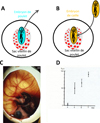 |
Figure 1 A–D : Principe de création d’une chimère complémentaire et analyse de la composition caille/poulet du sang circulant en fonction de l’âge post-opération. A. Embryon de poulet entre 8 et 10 somites (bleu) qui repose sur son sac vitellin. B. L’embryon de poulet est ôté et remplacé par un embryon de caille du même âge (orange). C. Chimère complémentaire vers 16 jours de développement. L’embryon de caille est bien visible sur le sac vitellin de poulet dans l’œuf de poule. D. Évolution du pourcentage de cellules hématopoïétiques de caille circulantes en fonction de l’âge de développement des chimères complémentaires. |
Tracer l’origine des CSH dans l’aorte
L’étape suivante a consisté à démontrer l’origine de ces amas hématopoïétiques au sein de l’aorte.
L’hypothèse longtemps proposée, selon laquelle les cellules endothéliales (CE) de l’aorte donnent naissance aux cellules hématopoïétiques, a été étudiée dans le modèle aviaire in vivo (Figure 2). Le devenir des CE aortiques a été suivi en marquant l’endothélium vasculaire avec deux types de traceurs vitaux inoculés dans la circulation sanguine via le cœur, assurant un contact direct avec l’endothélium tapissant les vaisseaux. Ces traceurs sont soit la lipoprotéine acétylée de basse densité (AcLDL) couplée à un marqueur lipophilique fluorescent (DiI) (Jaffredo et al., 1998), soit un vecteur rétroviral non réplicatif portant un gène rapporteur (Jaffredo et al., 2000). La première méthode de marquage présente deux avantages majeurs : (1) le tag AcLDL-DiI est endocytosé via un récepteur spécifique sur les CE et les macrophages (ces derniers étant absents au stade de l’inoculation) et (2) il a une demi-vie courte et disparaît rapidement de la circulation s’il n’est pas endocytosé. La seconde méthode permet une expression stable du gène rapporteur du vecteur pendant une période prolongée et donc l’identification de clones puisque l’intégration se produit dans des populations cellulaires éparses. L’identification des cellules est réalisée en utilisant les anticorps anti-VEGF-R2 et anti-CD45 comme marqueurs respectifs spécifiques des CE et des CH.
Dès 2 h après l’inoculation d’AcLDL-DiI, l’ensemble de l’arbre vasculaire est marqué. Les aortes, encore appariées à ce moment, sont entièrement tapissées de CE AcLDL-DiI+, alors qu’aucune cellule hématopoïétique, reconnue par un anticorps anti CD45, n’est encore présente autour de l’aorte ni dans la circulation. Un jour après l’inoculation, lorsque les clusters hématopoïétiques émergent, toutes les cellules qui s’y trouvent sont AcLDL-DiI+ /CD45+. En revanche, les clones marqués par un rétrovirus sont composés de CE ou de cellules hématopoïétiques mais jamais des deux (Jaffredo et al., 2000).
Des cellules doublement positives AcLDL-DiI+/CD45+ sont également observées dans le mésenchyme ventral sous l’aorte dorsale, suggérant qu’un sous-ensemble de cellules hématopoïétiques a pénétré dans cette région à partir de l’endothélium ventral (Jaffredo et al., 1998). De plus, après marquage rétroviral, les foyers hématopoïétiques, qui se développent dans le mésenchyme ventral de l’aorte (Toivanen et al., 1979), contiennent de nombreuses cellules lacZ+. Ainsi, ces foyers sont ensemencés par des progéniteurs dérivés du plancher aortique à trois jours de développement. Donc, pendant la première semaine du développement de l’embryon d’oiseau, des progéniteurs hématopoïétiques intra-embryonnaires sont dérivés du plancher aortique par un processus unique qui change le destin des CE en leur faisant adopter un destin hématopoïétique. Cette caractéristique a été appelée transition endothélio-hématopoïétique (Kissa & Herbomel, 2010).
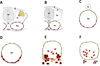 |
Figure 2 Remodelage endothélial au cours de la production hématopoïétique de l’aorte. A. Fusion des aortes – Les CE aortiques (rouge) dérivent du mésoderme splanchnopleural. Le quadrant dorsolatéral du somite présente une population de CE (jaune). B. Immédiatement avant la fusion des aortes, le toit endothélial initial d’origine splanchnopleurale (rouge) a été remplacé par des CE provenant du somite (jaune). C. Après la fusion, le toit est d’origine somitique, les côtés et le plancher restent d’origine splanchnopleurale. D. Pendant l’hématopoïèse précoce, le plancher commence à perdre ses marqueurs endothéliaux et acquiert des caractéristiques hématopoïétiques (Jaffredo et al., 1998). E. Les clusters hématopoïétiques bourgeonnent dans la lumière, tandis que certaines cellules hématopoïétiques pénètrent dans le mésentère. En même temps, les CE somitiques remplacent le plancher initial, alors que de nombreuses CE somitiques sont localisées dans le plancher sous les clusters. F. Achèvement de l’hématopoïèse. Le plancher aortique a disparu et est remplacé par des CE somitiques. Les CE aortiques sont, à ce stade, entièrement d’origine somitique. Ao : aorte ; D : dermomyotome ; E : endothélium ; En : endoderme ; N : notochorde ; NT : tube neural ; S : somite ; Sc : sclérotome. |
Une origine double pour l’endothélium de l’aorte
Comment expliquer que les clusters hématopoïétiques soient restreints à la partie ventrale de l’aorte ? Les expériences de greffe de Pardanaud et al. (1996) ont permis de montrer que les angioblastes (CE immatures) dérivés du somite et ceux dérivés du mésoderme splanchnopleural (mésoderme ventral) ont des potentiels de localisation distincts dans l’aorte. Les angioblastes dérivés du somite intègrent le toit et les côtés de l’endothélium aortique. Fait important, ils ne pénètrent jamais dans les organes viscéraux et n’intègrent pas le plancher aortique. En revanche, les angioblastes dérivés du mésoderme splanchnopleural envahissent le plancher de l’aorte et les organes viscéraux. Cette intégration dans le plancher de l’aorte s’accompagne d’une participation aux clusters intra-aortiques. Ainsi, le site d’origine est une deuxième condition pour l’émergence des clusters. En résumé, la paroi du corps (somatopleure), incapable par elle-même de fabriquer des vaisseaux sanguins, se vascularise grâce aux angioblastes émigrant des somites, tandis que le mésoderme splanchnopleural donne naissance à la fois aux angioblastes et aux CSH.
Nous avons obtenu une image dynamique de l’évolution aortique en utilisant une version modifiée de la même approche expérimentale, bien que différant sur deux aspects cruciaux (Pouget et al., 2006). Premièrement, le matériel greffé concernait la totalité de la plaque segmentaire (environ 10 futurs somites) plus le dernier somite segmenté (Figure 2) ; deuxièmement, les embryons hôtes ont été examinés à différents moments. Les cellules somitiques de caille ont envahi le toit de l’aorte de poulet environ quinze heures après la greffe. À vingt-quatre heures, seul le plancher de l’aorte ainsi que les clusters hématopoïétiques provenaient du poulet (c’est-à-dire qu’elles étaient dérivées du mésoderme splanchnopleural). Au fur et à mesure que les clusters hématopoïétiques disparaissaient, le plancher se peuplait de CE de caille (c’est-à-dire dérivées des somites greffés). En d’autres termes, les CE splanchnopleurales formant des clusters via la transition endothélio-hématopoïétique disparaissent après la production hématopoïétique. Par conséquent, l’endothélium de l’aorte définitive est entièrement composé de cellules dérivées de somites à 4–4,5 jours de développement. L’incapacité des angioblastes somitiques à pénétrer dans les viscères a été confirmée par cette méthode modifiée, malgré le remplacement de bandes beaucoup plus longues de matériel somitique.
Ces expériences projettent une lumière intéressante sur le problème des relations développementales entre l’endothélium et les CSH, en montrant que l’endothélium du plancher aortique est une structure transitoire qui s’épuise et se remplace lorsque l’hématopoïèse se termine. En outre, elles fournissent une explication à la brièveté de la production de CSH, une caractéristique observée chez toutes les espèces étudiées jusqu’à présent ; la production hématopoïétique dans ce site dépend d’un pool limité et non renouvelable de CE hématogènes qui donnent ensuite naissance aux foyers para-aortiques.
Les cellules endothéliales de la moelle osseuse naissante subissent une transition endothélio-hématopoïétique et produisent une hématopoïèse multilignage
Pouget et al. (2006) avaient démontré le rôle central du somite dans la vascularisation de la paroi corporelle et des membres. Yvernogeau et al. (2019) ont identifié le somite comme étant la source de la vascularisation de la moelle osseuse en traçant les CE formant la moelle par des approches d’embryologie expérimentale, de marquage génétique et d’imagerie en direct, puis en analysant leur descendance hématopoïétique à la fin de l’embryogenèse et chez l’adulte. Nous avons, de plus, pu démontrer que la moelle osseuse du fœtus tardif et du jeune adulte contient des CE hématogènes capables de produire des CSH et des cellules hématopoïétiques qui sont libérées dans la circulation sanguine avant de coloniser les organes hématopoïétiques secondaires (Figure 3). Le schéma expérimental chez l’oiseau a utilisé des embryons de poulet transgéniques exprimant la protéine fluorescente verte GFP dans le cytoplasme de toutes les cellules comme donneurs et des embryons de poulet « sauvages », non transgéniques, comme receveurs. Comme décrit par Pouget et al. (2006), le schéma expérimental a consisté à greffer la plaque segmentaire plus le dernier somite formé. Des analyses phénotypiques et fonctionnelles ont montré que les cellules endothéliales issues des somites colonisaient la moelle osseuse pour y former le réseau vasculaire et que ces cellules endothéliales acquéraient un potentiel hémogénique et formaient des cellules hématopoïétiques, principalement des progéniteurs multipotents et quelques CSH.
L’analyse à long terme des embryons de poulet greffés a révélé que les organes hématopoïétiques secondaires étaient colonisés par des cellules GFP+ originaires des somites greffés. Ces cellules étaient visibles dans les lobules thymiques des receveurs de greffe à 16/17 jours de développement. Une population de cellules B assez petite mais clairement identifiée était également présente dans la rate et la bourse de Fabricius, ce qui confirme la contribution multi-lignage de la population hématopoïétique dérivée de l’endothélium de la moelle.
Les chimères ont également été examinées à différents moments après l’éclosion et analysées pour la présence de cellules GFP+ associées aux lignées endothéliales et hématopoïétiques de la moelle jusqu’à 41 semaines. Nous avons observé une présence continue de cellules GFP+ dans la moelle osseuse et une distribution assez similaire de la GFP parmi les fractions endothéliales et hématopoïétiques par rapport aux embryons de 16/17 jours de développement. Par conséquent, nos données démontrent que les CE hémogéniques de la moelle osseuse de poulet produisent des progéniteurs multi-lignage et/ou des CSH capables de coloniser les tissus hématopoïétiques secondaires à long terme. De plus, l’analyse phénotypique et fonctionnelle chez la souris a montré que cette production est conservée entre les espèces (Yvernogeau et al., 2019).
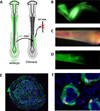 |
Figure 3 A. Schéma décrivant la greffe isotopique et isochronique du mésoderme pré-somitique d’un embryon de poulet transgénique GFP ubiquitaire dans un embryon de poulet de type sauvage. Les greffes de mésoderme pré-somitique ont été réalisées à deux jours de développement, au niveau des somites 14–21. B. Membre à 16–17 jours de développement colonisé par des cellules GFP+ dérivées du somite qui ont formé des masses musculaires visibles en vert. C, D. Radius isolé montrant des signes évidents d’hématopoïèse dans la moelle osseuse observée sous lumière visible (C) ou UV (D). Des structures tubulaires GFP sont observées dans la moelle osseuse. E. Coupe transversale représentative à travers l’os coloré avec, d’une part, le DAPI (bleu) marquant les noyaux cellulaires et, d’autre part, la GFP (vert) montrant des cellules GFP+ formant des sinusoïdes. F. Fort grossissement de sinusoïdes de la coupe E. |
Découverte de l’allantoïde
Chez les oiseaux, l’apparition des amas intra-aortiques et des foyers para-aortiques et l’ensemencement du thymus et de la bourse de Fabricius sont concomitants. Il a été démontré que les cellules des foyers para-aortiques ont un potentiel lymphoïde B et T (Lassila et al., 1980). Cependant, l’ensemencement de la moelle osseuse commence à E10,5 chez l’embryon de poulet et se poursuit jusqu’à la naissance. À ce moment, l’activité des foyers para-aortiques a cessé. La possibilité pour les cellules des foyers para-aortiques de rester dans un état indifférencié quelque part dans l’embryon semblait peu probable. Nous avons donc cherché un autre site de production de progéniteurs et avons identifié l’allantoïde. Cet organe possède la composition tissulaire appropriée pour produire de l’hémopoïèse, c’est-à-dire un endoderme associé à un mésoderme. C’est sur la base de cette observation apparemment simple que Françoise Dieterlen a ouvert la porte au rôle de l’allantoïde et du placenta dans la construction du système hématopoïétique. En utilisant des microangiographies à l’encre de Chine ou à l’AcLDL-Di, nous avons d’abord établi que l’allantoïde se vascularisait au bout de 75 à 80 h d’incubation. Il présentait cependant des cellules rouges bien visibles même avant cette période, ce qui indique que l’hématopoïèse s’était produite indépendamment du reste de l’embryon dans ce site (Caprioli et al., 1998, 2001). L’allantoïde subit un programme caractérisé par l’expression de plusieurs gènes « hémangioblastiques » dans le mésoderme, accompagnée de l’expression d’autres gènes dans l’endoderme associé. Le VEGF-R2 (récepteur 2 du facteur de croissance vasculaire VEGF) est exprimé au moins à partir du début du troisième jour d’incubation, et est suivi de peu par les facteurs de transcription GATA-2, SCL/Tal-1 et GATA-1. Des structures ressemblant à des îlots sanguins se différencient et contiennent à la fois des cellules hématopoïétiques CD45+ et des cellules accumulant de l’hémoglobine ; ces structures ressemblent exactement aux îlots sanguins du SV. Ce processus hématopoïétique a lieu avant l’établissement d’un réseau vasculaire reliant l’allantoïde à l’embryon. En utilisant des cultures in vitro, nous avons montré que les bourgeons allantoïdiens, disséqués avant l’établissement de la circulation entre le bourgeon et le reste de l’embryon, produisaient des érythrocytes de la lignée définitive. De plus, en utilisant des greffes hétérospécifiques entre des embryons de poulet et de caille, nous avons démontré que le réseau vasculaire allantoïdien se développe à partir de progéniteurs intrinsèques (Caprioli et al., 2001). Dans l’ensemble, ces résultats prolongent les découvertes antérieures sur l’engagement du mésoderme dans les lignées endothéliales et hématopoïétiques de l’allantoïde.
Références
- Beaupain, D., Martin, C., Dieterlen-Lièvre, F. (1979). Are developmental hemoglobin changes related to the origin of stem cells and site of erythropoiesis? Blood, 53, 212-225. [CrossRef] [PubMed] [Google Scholar]
- Caprioli, A., Jaffredo, T., Gautier, R., Dubourg, C., Dieterlen-Lièvre, F. (1998). Blood-borne seeding by hematopoietic and endothelial precursors from the allantois. Proc Natl Acad Sci USA, 95, 1641-1646. [CrossRef] [PubMed] [Google Scholar]
- Caprioli, A., Minko, K., Drevon, C., Eichmann, A., Dieterlen-Lièvre, F., Jaffredo, T. (2001). Hemangioblast commitment in the avian allantois: cellular and molecular aspects. Dev Biol, 238, 64-78. [CrossRef] [PubMed] [Google Scholar]
- Cormier, F., Dieterlen-Lièvre, F. (1988). The wall of the chick embryo aorta harbours M-CFC, G-CFC, GM-CFC and BFU-E. Development, 102, 279-285. [CrossRef] [PubMed] [Google Scholar]
- Dieterlen-Lièvre, F. (1975). On the origin of haemopoietic stem cells in the avian embryo: an experimental approach. J Embryol Exp Morphol, 33, 607-619. [PubMed] [Google Scholar]
- Dieterlen-Lièvre, F., Martin, C. (1981). Diffuse intraembryonic hemopoiesis in normal and chimeric avian development. Dev Biol, 88, 180-191. [CrossRef] [PubMed] [Google Scholar]
- Dieterlen-Lièvre, F., Pouget, C., Bollerot, K., Jaffredo, T. (2006). Are intra-aortic hemopoietic cells derived from endothelial cells during ontogeny? Trends Cardiovasc Med, 16, 128-139. [CrossRef] [PubMed] [Google Scholar]
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. (1998). Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development, 125, 4575-4583. [CrossRef] [PubMed] [Google Scholar]
- Jaffredo, T., Gautier, R., Brajeul, V., Dieterlen-Lièvre, F. (2000). Tracing the progeny of the aortic hemangioblast in the avian embryo. Dev Biol, 224, 204-214. [CrossRef] [PubMed] [Google Scholar]
- Kissa, K., Herbomel, P. (2010). Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature, 464, 112-115. [CrossRef] [PubMed] [Google Scholar]
- Lassila, O., Eskola, J., Toivanen, P., Martin, C., Dieterlen-Lièvre, F. (1978). The origin of lymphoid stem cells studied in chick yolk sac-embryo chimaeras. Nature, 272, 353-354. [CrossRef] [PubMed] [Google Scholar]
- Lassila, O., Eskola, J., Toivanen, P., Dieterlen-Lièvre, F. (1980). Lymphoid stem cells in the intraembryonic mesenchyme of the chicken. Scand J Immunol, 11, 445-448. [CrossRef] [PubMed] [Google Scholar]
- Martin, C. (1972). Method of explantation in ovo of the blastoderm of bird embryos. C R Séances Soc Biol Fil, 166, 283-285. [Google Scholar]
- Martin, C., Beaupain, D., Dieterlen-Lièvre, F. (1978). Developmental relationships between vitelline and intra-embryonic haemopoiesis studied in avian “yolk sac chimaeras”. Cell Differ, 7, 115-130. [CrossRef] [PubMed] [Google Scholar]
- Moore, M.A., Metcalf, D. (1970). Ontogeny of the haemopoietic system: yolk sac origin of in vivo and in vitro colony forming cells in the developing mouse embryo. Br J Haematol, 18, 279-296. [CrossRef] [PubMed] [Google Scholar]
- Moore, M.A., Owen, J.J. (1967a). Chromosome marker studies in the irradiated chick embryo. Nature, 215, 1081-1082. [CrossRef] [PubMed] [Google Scholar]
- Moore, M.A., Owen, J.J. (1967b). Experimental studies on the development of the thymus. J Exp Med, 126, 715-726. [CrossRef] [PubMed] [Google Scholar]
- Murray, P.D.F. (1932). The development “in vitro” of blood of the early chick embryo. Proc R Soc Lond B, 111, 497-521. [CrossRef] [Google Scholar]
- Pardanaud, L., Luton, D., Prigent, M., Bourcheix, L.-M., Catala, M., Dieterlen-Lièvre, F. (1996). Two distinct endothelial lineages in ontogeny, one of them related to hemopoiesis. Development, 122, 1363-1371. [CrossRef] [PubMed] [Google Scholar]
- Pouget, C., Gautier, R., Teillet, M.A., Jaffredo, T. (2006). Somite-derived cells replace ventral aortic hemangioblasts and provide aortic smooth muscle cells of the trunk. Development, 133, 1013-1022. [CrossRef] [PubMed] [Google Scholar]
- Toivanen, P., Lassila, O., Martin, C., Dieterlen-Lièvre, F., Nurmi, T., Eskola, J. (1979). Intraembryonic mesenchyme as a source of lymphoid stem cells [proceedings]. Folia Biol (Praha), 25, 299-300. [PubMed] [Google Scholar]
- Weissman, I.L., Papaioannou, V.E., Gardner, R.L. (1977). Fetal hematopoietic origins of the adult hematolymphoid system. Cold Spring Harbor, 5, 33-43. [Google Scholar]
- Yvernogeau, L., Gautier, R., Petit, L., Khoury, H., Relaix, F., Ribes, V., Sang, H., Charbord, P., Souyri, M., Robin, C., Jaffredo, T. (2019). In vivo generation of haematopoietic stem/progenitor cells from bone marrow-derived haemogenic endothelium. Nat Cell Biol, 21, 1334-1345. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Jaffredo, T. (2023). Plongée avec Françoise Dieterlen dans l’origine des cellules souches hématopoïétiques. Biologie Aujourd’hui, 217, 27-33
Liste des figures
 |
Figure 1 A–D : Principe de création d’une chimère complémentaire et analyse de la composition caille/poulet du sang circulant en fonction de l’âge post-opération. A. Embryon de poulet entre 8 et 10 somites (bleu) qui repose sur son sac vitellin. B. L’embryon de poulet est ôté et remplacé par un embryon de caille du même âge (orange). C. Chimère complémentaire vers 16 jours de développement. L’embryon de caille est bien visible sur le sac vitellin de poulet dans l’œuf de poule. D. Évolution du pourcentage de cellules hématopoïétiques de caille circulantes en fonction de l’âge de développement des chimères complémentaires. |
| Dans le texte | |
 |
Figure 2 Remodelage endothélial au cours de la production hématopoïétique de l’aorte. A. Fusion des aortes – Les CE aortiques (rouge) dérivent du mésoderme splanchnopleural. Le quadrant dorsolatéral du somite présente une population de CE (jaune). B. Immédiatement avant la fusion des aortes, le toit endothélial initial d’origine splanchnopleurale (rouge) a été remplacé par des CE provenant du somite (jaune). C. Après la fusion, le toit est d’origine somitique, les côtés et le plancher restent d’origine splanchnopleurale. D. Pendant l’hématopoïèse précoce, le plancher commence à perdre ses marqueurs endothéliaux et acquiert des caractéristiques hématopoïétiques (Jaffredo et al., 1998). E. Les clusters hématopoïétiques bourgeonnent dans la lumière, tandis que certaines cellules hématopoïétiques pénètrent dans le mésentère. En même temps, les CE somitiques remplacent le plancher initial, alors que de nombreuses CE somitiques sont localisées dans le plancher sous les clusters. F. Achèvement de l’hématopoïèse. Le plancher aortique a disparu et est remplacé par des CE somitiques. Les CE aortiques sont, à ce stade, entièrement d’origine somitique. Ao : aorte ; D : dermomyotome ; E : endothélium ; En : endoderme ; N : notochorde ; NT : tube neural ; S : somite ; Sc : sclérotome. |
| Dans le texte | |
 |
Figure 3 A. Schéma décrivant la greffe isotopique et isochronique du mésoderme pré-somitique d’un embryon de poulet transgénique GFP ubiquitaire dans un embryon de poulet de type sauvage. Les greffes de mésoderme pré-somitique ont été réalisées à deux jours de développement, au niveau des somites 14–21. B. Membre à 16–17 jours de développement colonisé par des cellules GFP+ dérivées du somite qui ont formé des masses musculaires visibles en vert. C, D. Radius isolé montrant des signes évidents d’hématopoïèse dans la moelle osseuse observée sous lumière visible (C) ou UV (D). Des structures tubulaires GFP sont observées dans la moelle osseuse. E. Coupe transversale représentative à travers l’os coloré avec, d’une part, le DAPI (bleu) marquant les noyaux cellulaires et, d’autre part, la GFP (vert) montrant des cellules GFP+ formant des sinusoïdes. F. Fort grossissement de sinusoïdes de la coupe E. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


