| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 3-4, 2022
|
|
|---|---|---|
| Page(s) | 131 - 143 | |
| DOI | https://doi.org/10.1051/jbio/2022017 | |
| Publié en ligne | 6 février 2023 | |
Article
L’ocytocine, dès la naissance, conditionne le comportement alimentaire et social d’un individu
As early as birth, oxytocin plays a key role in both food and social behavior
INMED (Institut de Neurobiologie de la Méditerranée), INSERM, Aix Marseille Univ, Marseille, France
* Auteur correspondant : francoise.muscatelli@inserm.fr
Reçu :
19
Septembre
2022
L’ocytocine (OT) est une neurohormone qui, dans le cerveau, régule ce que l’on appelle le « cerveau social » et dont l’étude est principalement conduite chez l’adulte. Au cours du développement postnatal, les mécanismes par lesquels le système OT structure divers comportements sont peu explorés. Nous présentons ici le processus dynamique du développement postnatal du système OT ainsi que ses rôles fonctionnels, en période périnatale, qui sont essentiels pour façonner les comportements sociaux. Nous abordons spécifiquement le rôle de l’OT chez le nouveau-né, qui permet d’intégrer et d’adapter des réponses aux premières stimulations sensorielles et qui stimule aussi l’activité de succion. Ce dialogue sensoriel et la tétée sont impliqués dans les liens mère-enfant et structurent les futures interactions sociales. Chez les rongeurs et chez l’homme, des maladies neuro-développementales avec des troubles du spectre autistique, comme les syndromes de Prader-Willi et de Schaaf-Yang, sont associées à des déficiences sensorielles, alimentaires et comportementales dans la petite enfance. Nous proposons qu’au début de la vie postnatale, l’OT joue un rôle clé dans la maturation des réseaux neuronaux contrôlant le comportement alimentaire et les premières interactions sociales. Une administration d’OT chez le nouveau-né améliore l’intégration sensorielle des facteurs environnementaux et la relation avec la mère ainsi que l’activité de succion comme nous l’avons montré chez des modèles de souris ainsi que chez des bébés atteints du syndrome de Prader-Willi. Des effets à long terme ont aussi été observés sur le comportement social et cognitif. Par conséquent, les difficultés précoces d’alimentation peuvent être un marqueur prédictif précoce des cas de troubles du spectre autistique (TSA) et l’administration exogène d’OT pourrait améliorer le comportement alimentaire et, à plus long terme, les troubles du comportement social.
Abstract
Oxytocin (OT) is a neurohormone that regulates the so-called “social brain” and is mainly studied in adulthood. During postnatal development, the mechanisms by which the OT system structures various behaviors are little studied. Here we present the dynamic process of postnatal development of the OT system as well as the OT functions in the perinatal period that are essential for shaping social behaviors. Specifically, we discuss the role of OT, in the newborn, in integrating and adapting responses to early sensory stimuli and in stimulating suckling activity. Sensory dialogue and suckling are involved in mother-infant bonds and structure future social interactions. In rodents and humans, neurodevelopmental diseases with autism spectrum disorders (ASD), such as Prader-Willi and Schaaf-Yang syndromes, are associated with sensory, feeding and behavioral deficits in infancy. We propose that in early postnatal life, OT plays a key role in stimulating the maturation of neural networks controlling feeding behavior and early social interactions from birth. Administration of OT at birth improves sensory integration of environmental factors and the relationship with the mother as well as sucking activity as we have shown in mouse models and in babies with Prader-Willi syndrome. Long-term effects have also been observed on social and cognitive behavior. Therefore, early feeding difficulties might be an early predictive marker of ASD, and OT treatment a promising option to improve feeding behavior and, in the longer term, social behavioral problems.
Mots clés : ocytocine / neuro-développement / nutrition / interactions sociales / syndromes de Prader-Willi et de Schaaf-Yang
Key words: oxytocin / neurodevelopment / feeding / social interaction / Prader-Willi and Schaaf-Yang syndromes
© Société de Biologie, 2023
Abréviations
ALPO : Zone préoptique antéro-latérale
NDD : Maladies neurodéveloppementales
OTR : Récepteur de l’ocytocine
PvPO : Noyau périventriculaire préoptique
PWS : Syndrome de Prader-Willi
TSA : Troubles du spectre autistique
V1AR : Récepteur 1A de la vasopressine
Introduction
La période périnatale semble être critique pour les pathologies liées aux troubles de l’alimentation ou à la sociabilité. Un facteur important à prendre en compte durant cette période est le système neuroendocrinien (Lesage et al., 1996). L’ocytocine (OT) des neurones hypothalamiques projetant vers les zones limbiques et d’autres zones centrales du cerveau semble être un régulateur clé de l’évolution et de l’expression de différents types de systèmes sociaux chez de nombreuses espèces (pour revues voir : Choleris et al., 2009 ; Heinrichs et al., 2009 ; Insel, 2010). Il est actuellement admis que l’OT module le couplage entre les réseaux neuronaux centraux qui traitent les entrées sensorielles activées pendant les interactions sociales (Johnson & Young, 2017). Plus généralement, l’OT est considérée comme une hormone allostatique, agissant dans le cerveau ou dans les organes périphériques, qui modulerait le comportement vital social et non social en maintenant une certaine stabilité dans des environnements changeants (Quintana & Guastella, 2020). Cependant, toutes ces attributions sont appliquées au rôle de l’OT à l’âge adulte et restent encore à vérifier chez l’enfant.
Dans la dernière décennie, la communauté scientifique a réalisé que la façon et le moment où le circuit neuronal du système OT est mis en place au cours du développement précoce pourraient avoir des conséquences importantes sur le comportement, notamment au travers de ses effets organisationnels (Eaton et al., 2012 ; Miller & Caldwell, 2015). Des études révèlent l’importance de ce système OT dans des conditions normales et pathologiques, en relation avec les expériences vécues en début de vie (Onaka & Takayanagi, 2021). En outre, il est frappant de constater que la distribution des récepteurs OT (OTR) dans le cerveau subit des changements dynamiques d’expression tout au long du développement postnatal avec un pic d’expression dans la petite enfance (chez les rongeurs et les humains) et que cette distribution est fonctionnellement liée aux régions du cerveau contrôlant les modalités sensorielles principalement utilisées pour initier des interactions sociales chez les mammifères (Hammock & Levitt, 2013 ; Tamborski et al., 2016).
Ici, nous discuterons du rôle de l’OT au début de la vie postnatale, façonnant les entrées sensorielles et stimulant la tétée, les deux contribuant aux premiers comportements sociaux via le lien affectif du nourrisson avec sa mère. Nous rapporterons également les effets positifs, en particulier les effets à long terme, de l’administration d’OT au début de la vie dans les maladies neurodéveloppementales (NDD) telles que les syndromes de Schaaf-Yang et de Prader-Willi.
Dynamique du système ocytocinergique au cours du développement post-natal
Le système OT est défini par les cellules qui synthétisent l’OT et les cellules qui expriment les OTR, déterminant les caractéristiques qualitatives et quantitatives des réponses à l’OT. L’action de l’OT dépend de son taux de libération, de la densité et de l’expression spatio-temporelle de ses sites de liaison (OTR et récepteurs de la vasopressine) et des voies de signalisation intracellulaires déclenchées par leur activation. De nombreuses revues ont décrit la source de production de l’OT (Althammer & Grinevich, 2017), les mécanismes de sa libération (Johnson & Young, 2017 ; Brown et al., 2020), et les voies de signalisation cellulaire en aval de ses récepteurs (Busnelli & Chini, 2018 ; Jurek & Neumann, 2018). Nous nous concentrerons ici sur la mise en place développementale du système OT.
Cellules OT
L’OT est produite par les neurones hypothalamiques de plusieurs régions (Figure 1A) : le noyau supraoptique (SON), le noyau périventriculaire préoptique (PvPO), le noyau paraventriculaire (PVN), les noyaux accessoires (AN) et aussi dans une région récemment identifiée, appelée zone préoptique antéro-latérale (ALPO) (Soumier et al., 2022).
Récemment, une carte complète des neurones OT et vasopressinergiques (AVP) et de leurs projections a été générée chez la souris depuis le stade fœtal (jour embryonnaire E16,5) jusque chez l’adulte (Madrigal & Jurado, 2021) (https://kimlab.io/brain-map/ot_wiring). L’expression de l’OT et de l’AVP présente une dynamique de développement distincte dans le cerveau de la souris. En général, la maturation de l’AVP précède celle de l’OT (Madrigal & Jurado, 2021). Le nombre de cellules OT augmente sélectivement pendant une fenêtre critique du développement postnatal dans différentes régions hypothalamiques (Figure 1A) : dans le PvPO et le PVN, ainsi que dans l’ALPO (Soumier et al., 2022) alors que les cellules exprimant l’AVP dans les différents noyaux hypothalamiques (PVN, SON, le noyau préoptique médial), ainsi que dans les régions extra-hypothalamiques, telles que le noyau médian de l’amygdale (MEA), le tubercule olfactif (TU) et le noyau du lit de la stria terminalis (BNST), restent stables dans le temps, de la naissance à l’âge adulte (Soumier et al., 2022). Il est intéressant de noter que dans la plupart des noyaux hypothalamiques, il existe un pourcentage élevé de neurones coexprimant l’OT et l’AVP, mais qui diminue à l’âge adulte (Madrigal & Jurado, 2021).
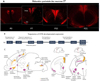 |
Figure 1 Dynamique du développement du système ocytocinergique chez la souris. (A). Maturation postnatale des neurones OT du jour de la naissance (P0) au jour 21, dans le noyau paraventriculaire (PVN) ou supraoptique (SO). (B). Développement des récepteurs OTR dans le cerveau aux stades embryonnaires (E) ou post-nataux (PN). (C). Expression des OTR dans le cerveau de souris. En jaune, les régions avec une expression transitoire des OTR ; en violet, les régions qui expriment les OTR tout au long de la vie (adapté de Grinevich et al., 2016). |
Récepteurs de l’OT
L’OTR est un récepteur couplé aux protéines G (RCPG) à sept segments transmembranaires. À ce jour, un seul sous-type d’OTR a été décrit, qui est étroitement lié aux trois récepteurs de la vasopressine (AVPR). L’OT se lie également au récepteur AVPR-1a avec une affinité moindre. La cartographie des OTR a été difficile à établir car il n’existe pas d’anticorps spécifique de ces récepteurs. De ce fait, la distribution de l’expression de l’OTR a été examinée à l’aide de diverses méthodes moins résolutives que l’immunohistochimie : hybridation in situ pour localiser les transcrits des récepteurs, autoradiographie en utilisant de l’ocytocine radio-marquée, visualisation d’un marqueur fluorescent exprimé sous le contrôle du promoteur OTR chez des souris transgéniques.
L’analyse comparative de la distribution cérébrale des OTR chez les rongeurs (campagnols des prairies, rats et souris) a révélé des différences liées à l’espèce, au sexe, aux expériences vécues dans l’enfance, et au développement (Vaidyanathan & Hammock, 2017). Chez la souris, tout au long du développement embryonnaire (à partir de E14,5) et des premiers jours postnataux, les OTR apparaissent progressivement dans plusieurs régions du cerveau, étant d’abord détectés dans la région embryonnaire présomptive du noyau moteur vagal, pour atteindre un patron de distribution « infantile » bien défini vers le jour postnatal 10. L’expression de l’OTR suit ensuite un cours temporel différentiel selon la structure cérébrale considérée, avec une expression transitoire observée dans plusieurs régions cérébrales pendant la période postnatale précoce chez la souris et le rat (Tribollet et al., 1989, 1991 ; Yoshimura et al., 1996). Après les deux premières semaines de vie, un déclin abrupt de la densité des OTR est observé dans plusieurs régions, accompagné d’une expression dans de nouvelles régions cérébrales ; cette phase définit la première transition vers le patron adulte et est pratiquement achevée trois semaines après la naissance. Au moment du sevrage, une deuxième transition se produit, caractérisée par un remodelage de l’expression de l’OTR, qui disparaît lentement de certaines zones et augmente dans d’autres. Enfin, le patron adulte d’expression de l’OTR est atteint à 2–3 mois (Vaidyanathan & Hammock, 2017 ; Muscatelli et al., 2018).
Egalement chez la souris, la quantification autoradiographique de la liaison d’un ligand radiomarqué sur coupes de cerveau a permis d’établir la première cartographie de sites de liaison de l’OT dès E16 (Tamborski et al., 2016). Un pic de densité de ces sites est observé autour de deux semaines après la naissance, une diminution intervenant ensuite dans toutes les régions du cerveau (Hammock & Levitt, 2013). Une forte expression transitoire de l’OTR est particulièrement détectée dans différentes zones corticales au cours du développement postnatal. Chez les campagnols des prairies, des études ont également montré un profil d’expression dynamique de l’OTR.
Enfin, le laboratoire de Yongsoo Kim a utilisé un modèle de souris transgénique exprimant un rapporteur fluorescent contrôlé par le promoteur OTR (souris OTR Vénus) et a établi une carte publique de l’OTR à l’échelle du cerveau pendant le développement postnatal (https://kimlab.io/brain-map/OTR/) (Newmaster et al., 2020). Toutefois, cette carte ne permet pas de visualiser l’expression transitoire des OTR.
En résumé (Figure 1B et 1C), chez tous les rongeurs examinés (souris, rats, campagnols des prairies), l’ARNm Otr et les sites de liaison de l’OT sont détectés dans les embryons, même si la forme mature de l’OT n’est pas produite à ce stade, l’expression la plus forte des OTR se situant environ deux semaines après la naissance. La distribution des OTR dans le cerveau en développement semble différente de celle des cerveaux adultes avec trois profils d’expression : 1) des groupes de neurones où l’expression de l’OTR commence à être détectée pendant le développement fœtal et se maintient au même niveau tout au long de la vie, 2) des sites avec des expressions transitoires où l’OTR n’est observé que pendant une période de développement restreinte après laquelle son expression diminue au-dessous du seuil de détection, et 3) enfin, un autre groupe de neurones où l’expression de l’OTR commence à être détectée pendant la puberté et se maintient tout au long de la vie (Vaidyanathan & Hammock, 2017). L’expression de l’OTR est sexuellement dimorphique dès les premiers stades embryonnaires, comme le montre la plus forte concentration cérébrale de l’ARNm du récepteur chez les femelles que chez les mâles (Tamborski et al., 2016).
Chez l’Homme, tout comme chez les rongeurs, l’expression cérébrale de l’OTR commence à s’accélérer juste avant la naissance, pour atteindre un niveau maximal pendant la petite enfance (Rokicki et al., 2022). Le pic d’expression de l’OTR est plus fort chez les hommes pendant la petite enfance et la différenciation au sein des régions du cerveau est plus prononcée. Chez les femmes, l’expression de l’OTR est maximale autour de la naissance, elle diminue ensuite pendant l’enfance et présente un creux pendant l’adolescence (Rokicki et al., 2022).
Le système OT intègre les expériences sensorielles dès la naissance et façonne les circuits neuronaux du développement
À l’âge adulte, le rôle de l’OT comme intégrateur/modulateur de l’information sensorielle en relation avec le comportement social a été clairement démontré pour l’olfaction (Oettl et al., 2016 ; Oettl & Kelsch, 2018) et le toucher social (Tang et al., 2020 ; Yu et al., 2022). L’OT module également la perception de la douleur (Poisbeau et al., 2018). Chez les femelles, l’OT permet aux mères de reconnaître les vocalisations de leurs petits et induit un comportement maternel adapté (Schiavo et al., 2020).
Au cours du développement postnatal, de nombreuses données montrent un rôle du système OT comme intégrateur et modulateur des entrées sensorielles, permettant de façonner les circuits et la connectivité du cerveau. Les neurones OT (mais aussi AVP) des PVN et SON de l’hypothalamus sont spécifiquement activés dans les 30 minutes suivant la naissance chez les souris et les rats (Hoffiz et al., 2021). Certaines des études pionnières ont montré que, chez le rat (Nelson & Alberts, 1997 ; Lenz & Sengelaub, 2010), le lapin (Caba et al., 2003) ou les petits des campagnols des prairies (Barrett et al., 2015), le léchage parental stimule l’activité des neurones OT hypothalamiques. Chez le rat, cette stimulation induit également une augmentation de la concentration d’OT dans la moelle épinière, suggérant que le léchage maternel peut affecter la maturation des centres sensoriels et autonomes (Lenz & Sengelaub, 2010). Les stimuli tactiles doux des petits pendant la période de développement activent également les neurones OT (Walker et al., 2017). Les soins maternels (contacts peau à peau) stimulent la production d’OT des souriceaux, créant les conditions pour induire une préférence pour l’odeur maternelle et établir une affiliation sociale favorisant le blotissement des petits dans le nid (Kojima & Alberts, 2011a; Kojima et al., 2012). Chez les ratons également, le contact avec la mère augmente l’OT et facilite le développement du comportement de recherche de chaleur par le blotissement (Kojima & Alberts, 2011b).
L’une des démonstrations les plus convaincantes de la libération d’OT dans le cerveau d’un nouveau-né en réponse à des signaux sensoriels a été obtenue par la privation des premières expériences sensorielles. Ainsi, la privation de moustaches juste après la naissance (jusqu’au 14e jour postnatal) entraîne une réduction de l’excitation des neurones du PVN et une libération plus faible de l’OT dans le cerveau des souris juvéniles (Zheng et al., 2014). Cette privation affecte également d’autres régions cérébrales entraînant notamment une réduction de la transmission synaptique excitatrice à travers les cortex sensoriels. Ces observations démontrent que l’OT favorise le développement cortical cross-modal et dépendant de l’expérience. Des résultats similaires sont obtenus lorsque les souriceaux sont maintenus dans l’obscurité. Dans ce cas, l’injection d’OT dans le cerveau leur permet de surmonter ce déficit et d’améliorer les réponses neuronales aux autres entrées sensorielles. Inversement, une stimulation sensorielle accrue par un enrichissement environnemental dès la naissance augmente au bout de deux semaines le niveau d’OT, la transmission synaptique excitatrice dans de multiples cortex sensoriels et annule les effets de la privation sensorielle. Ces observations démontrent donc que, pendant la période de synaptogenèse, l’OT favorise la transmission synaptique excitatrice et sert de médiateur à la plasticité multimodale précoce dépendant de l’expérience dans les cortex sensoriels. Il est intéressant de noter que cette action de l’expérience sensorielle et de l’OT, qui régule la transmission synaptique excitatrice des neurones pyramidaux des cortex sensoriels, atteint un pic vers JPN 14 et se termine vers JPN 18, révélant une période critique (Zhang et al., 2021). De manière logique, l’expérience sensorielle régule l’expression de l’OT avec une évolution temporelle similaire : une élévation à JPN 14, et essentiellement aucun changement à JPN 18. De même, l’expression des OTR dans les cortex sensoriels atteint un pic autour de JPN 14 et chute de manière significative à JPN 21 et 28 (Hammock & Levitt, 2013 ; Mitre et al., 2016 ; Newmaster et al., 2020). Ainsi, une réduction de l’expression des OTR peut contribuer à la fermeture de la période sensible/critique (Zhang et al., 2021).
De manière similaire, il a été démontré que l’OT affecte les activités spontanées dans le cortex visuel en développement chez la souris, en recrutant des interneurones à somatostatine, ce qui permet d’affiner les connexions synaptiques dans cette région corticale avant l’ouverture des yeux (Maldonado et al., 2021). L’OT est également nécessaire chez les souriceaux pour déterminer une mémoire olfactive « positive », cette empreinte de la mémoire étant ensuite associée à un état mental agréable chez les nouveau-nés allaités. Il est important de noter qu’il existe une période critique (première semaine postnatale) pendant laquelle l’OT est nécessaire pour ensuite établir des interactions sociales « harmonieuses » à l’âge adulte, en particulier en imposant une valeur positive à l’empreinte de la mémoire olfactive (Inoue et al., 2021).
Dans notre équipe, nous avons montré un rôle de l’OT dans la réactivité thermo-sensorielle des nouveau-nés. En effet, dans un environnement frais, les souris nouveau-nés émettent des vocalisations ultra-sonores qui déclenchent un comportement de « récupération des petits » par leur mère, et l’inactivation des neurones OT empêche cette réactivité thermo-sensorielle (Da Prato et al., 2022).
Dans l’ensemble, ces données révèlent une stimulation du système OT en réponse à tous les types d’entrées sensorielles (tactiles, visuelles, olfactives, thermiques) dans une période critique de l’enfance, qui débute à la naissance. L’expérience sensorielle influence la production d’OT et celle-ci façonne les circuits neuronaux en modulant l’activité spontanée et évoquée.
Il est à noter que, autour de la naissance, la forte expression orofaciale transitoire des OTR suggère également un effet du système OT dans le contrôle périphérique des entrées sensorielles.
Le système OT et les expériences sensorielles vécues dans la petite enfance façonnent les premiers liens entre le nouveau-né et la mère, fondement des interactions sociales
Chez tous les mammifères, le lien mère-nourrisson est le premier comportement social de la vie. De nombreuses études rapportent le rôle de l’OT dans le lien mère-nourrisson en stimulant la lactation et le comportement maternel (Nagasawa et al., 2012 ; Okabe et al., 2012). Un effet important de l’OT produite par la mère au moment de la naissance pourrait être de protéger le cerveau néonatal du stress de la naissance en diminuant l’activité neuronale périnatale (Tyzio et al., 2014). En revanche, le rôle de l’OT produite par le nouveau-né dans la stimulation du lien avec sa mère est moins bien connu. Le système OT du nouveau-né est activé par les soins parentaux qui induisent toutes les entrées sensorielles décrites ci-dessus ; les déficiences de ces soins parentaux, comme la séparation maternelle, ont un impact sur le système OT et altèrent les comportements sociaux et émotionnels jusqu’à l’âge adulte (Onaka & Takayanagi, 2021).
L’OT produite chez les nouveau-nés façonne les premiers comportements sociaux via les liens entre le nourrisson et sa mère
Le lien mère-nourrisson est non seulement un facteur favorisant la survie du nouveau-né (Nowak et al., 2000), mais intervient également dans la formation de circuits neuronaux fonctionnels par le biais d’expériences de stimulations sensorielles (Sur & Rubenstein, 2005). Dès la naissance, les nouveau-nés de mammifères doivent interagir efficacement avec leur mère pour obtenir des soins et de la nourriture (Schaal et al., 2009). Les signaux olfactifs, tactiles et thermiques provenant de l’environnement ou du corps de la mère favorisent les stimulations sensorielles qui incitent les nouveau-nés à adopter des comportements actifs, souvent stéréotypés, tels que la recherche du mamelon, la succion ou les vocalisations ultrasoniques, qui sont des appels pour réussir à se nourrir et à se réchauffer (Nowak et al., 2000 ; Grimsley et al., 2011). Comme décrit ci-dessus, le système OT est actif dès la naissance et réagit à la stimulation sensorielle produite par la mère. La production et la libération de l’OT chez le nouveau-né sont nécessaires pour façonner ces premières fonctions sensori-motrices et pour établir une relation forte avec la mère.
L’OT chez les nouveau-nés et le comportement alimentaire précoce/la tétée
Les nouveau-nés de souris trouvent les mamelons de leur mère et tètent le lait par eux-mêmes. Le système olfactif est essentiel pour le comportement de recherche du mamelon et la succion du lait, le système tactile impliquant les moustaches et le nerf trijumeau n’étant pas suffisant pour induire ce comportement (Hongo et al., 2000). Cependant, il pourrait y participer puisque le système olfactif et le nerf trijumeau interagissent ; en effet, les odeurs stimulent le bulbe olfactif mais aussi le nerf trijumeau qui contrôle la force des muscles masséters dans la succion (Frasnelli et al., 2007). Alberts & Ronca (2012) ont proposé que, chez le rat nouveau-né, la stimulation sensorielle mécanique et thermique in utero et pendant la naissance établit les conditions suffisantes pour l’apprentissage des odeurs maternelles qui guident les réponses de succion Ainsi, on peut penser que les stimuli des odeurs apprises avant la naissance sont renforcés par les stimuli de la naissance, et deviennent des stimuli conditionnés pour la fixation du mamelon (Pedersen et al., 1982 ; Alberts & Ronca, 2012), et une période sensible pour apprendre la préférence olfactive (pour la mère) a même été proposée. Le circuit neuronal sous-jacent impliquerait le bulbe olfactif, le cortex piriforme, l’amygdale et le locus cœruleus, qui produit la noradrénaline (nécessaire pour promouvoir la préférence olfactive dans cette période sensible : Sullivan, 2003). Cependant, des études doivent encore être menées pour évaluer un rôle de l’OT dans l’apprentissage des odeurs de la mère. Les neurones de l’OT sont activés juste après la naissance (Hoffiz et al., 2021) et il y a une expression transitoire mais forte de l’OTR autour de la naissance dans plusieurs régions périphériques orofaciales liées au comportement pour se nourrir (Greenwood & Hammock, 2017), suggérant un rôle de l’OT dans l’intégration des entrées sensorielles associées à la tétée. Il est intéressant de noter que les petits lapins sont allaités et nourris une fois toutes les 24 heures (ce qui est inhabituel chez les mammifères) et que les neurones OT du SON et du PVN sont activés de manière différentielle soit par la succion du lait soit par des léchages de la zone anogénitale, effectués par la mère, qui stimulent le comportement de succion chez les petits (Caba et al., 2003). De plus, l’OT présente dans le lait et le colostrum pourrait réguler le développement intestinal du nouveau-né et protéger son intestin de l’inflammation (Klein et al., 2017).
Plusieurs publications suggèrent que l’OT intervient dans les commandes motrices impliquées dans la succion. Les motoneurones hypoglosses (noyau XII) innervent les muscles extrinsèques et intrinsèques de la langue et sont nécessaires à la succion. Utilisant des tranches de tronc cérébral de ratons âgés de 5 à 9 jours pour l’enregistrement par patch clamp, Wrobel et al. (2010) ont montré que l’AVP et l’OT fonctionnent comme des neuromodulateurs des motoneurones du noyau hypoglosse (XII), pouvant ainsi agir sur les réseaux neuronaux qui sous-tendent les mouvements rythmiques de la langue. Leurs effets sont médiés par les récepteurs V1AR et OTR présents dans les motoneurones du XII ainsi que dans les interneurones et les neurones prémoteurs, établissant un contact synaptique avec les motoneurones.
La démonstration la plus solide du rôle de l’OT dans le comportement alimentaire du nouveau-né provient peut-être des études menées dans notre laboratoire, initialement consacrées à la caractérisation du phénotype des souris KO n’exprimant pas le gène Magel2. Des déficiences du système OT sont impliquées dans des maladies neuropsychiatriques présentant un syndrome autistique, notamment les syndromes de Prader-Willi (SPW) et de Schaaf-Yang (SYS), caractérisés par une altération de la tétée à la naissance, nécessitant une alimentation par intubation (Fountain & Schaaf, 2016) (Figure 2). Ces deux syndromes sont associés à des mutations du gène MAGEL2: soit des mutations ponctuelles dans le SYS, soit dans une grande région chromosomique incluant MAGEL2 pour ce qui concerne le SPW (Figure 2). Chez les souris Magel2 KO, nous avons observé la mort d’environ 50 % des souris mutantes au cours du premier jour postnatal en raison d’une déficience de l’activité de succion, associée à de faibles niveaux d’OT dans l’hypothalamus des nouveau-nés (Schaller et al., 2010). Cette observation nous a suggéré que la déficience en OT pourrait participer à l’altération du comportement alimentaire des souriceaux Magel2 KO, ce qui a pu être confirmé par d’autres expériences. En effet, l’injection d’un antagoniste spécifique de l’OTR à des souriceaux sauvages 1–1,5 heure après la naissance a empêché la succion chez environ 50 % d’entre eux, qui ont été retrouvés morts le jour de l’injection (Schaller et al., 2010). Il est intéressant de noter que la même injection effectuée 12 à 24 heures après la naissance n’a eu aucun effet sur les souriceaux. En outre, une seule injection sous-cutanée d’OT 3 à 5 heures après la naissance chez des souriceaux Magel2 KO a restauré une activité de tétée normale (Schaller et al., 2010). Dans une étude clinique de phase 2 faisant suite à nos travaux précliniques, nous avons montré que l’administration intranasale d’OT (pendant une semaine) à 18 nourrissons Prader-Willi (âgés de 4 semaines à 5 mois) améliorait et même normalisait la succion (évaluée par la Neonatal Oro-Motor Scale) chez 88 % d’entre eux. De plus, la vidéofluoroscopie a confirmé une grande amélioration des fonctions motrices impliquées dans la succion-déglutition (Tauber et al., 2017). L’ensemble de ces résultats indique que la manipulation du système OT très tôt après la naissance pourrait avoir un impact important sur l’initiation de l’activité de succion chez les souris nouveau-nées Magel2 KO et les bébés Prader-Willi (Figure 3).
Il convient de noter que le rôle de l’OT dans le comportement alimentaire change au cours du développement, puisqu’elle stimule la production de lait chez la mère, stimule le comportement alimentaire chez le nouveau-né et inhibe la prise alimentaire chez l’adulte. Les mécanismes sous-jacents qui pourraient rendre compte de ces changements au cours du développement sont actuellement inconnus, mais il est évident que les rôles respectifs de l’OT sécrétée par la mère et par l’enfant vont permettre un tuilage progressif au cours de la période de lactation.
 |
Figure 2 MAGEL2 est impliqué dans le syndrome de Prader-Willi (SPW) et est responsable du syndrome de Schaaf-Yang (SYS). (A). Symptômes des patients atteints du SPW ou du SYS. (B). Anomalies génétiques associées au SPW ou au SYS. |
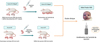 |
Figure 3 Ocytocine (OT) et activité de succion. L’administration sous-cutanée d’OT rétablit une activité de succion normale chez des souriceaux Magel2 KO alors que l’injection d’un antagoniste de l’OT induit un déficit de succion chez des souriceaux sauvages. Une étude clinique (Phase I/II) montre une amélioration de l’activité de succion des bébés Prader-Willi à la suite d’une administration intranasale d’OT. |
Effets à long terme de l’ocytocine produite chez le nouveau-né
Le système OT est perturbé dans des maladies neurodéveloppementales associées aux Troubles du Spectre Autistique chez les rongeurs et chez l’Homme
Le système OT est perturbé dans plusieurs modèles animaux de troubles neurodéveloppementaux caractérisés par des phénotypes associés à l’autisme (Muscatelli et al., 2018 ; Wagner & Harony-Nicolas, 2018 ; Althammer et al., 2022). En effet, les modèles de souris KO des gènes codant l’OT (Winslow et al., 2000 ; Ferguson et al., 2001), l’OTR (Takayanagi et al., 2005 ; Sala et al., 2011, 2013), ou l’ADP-ribosyl cyclase (CD38) (Jin et al., 2007 ; Liu et al., 2008) montrent des changements dans le comportement social qui rappellent les troubles du spectre autistique (TSA). D’autre part, plusieurs modèles rongeurs de TSA, dus soit à l’inactivation de gènes tels que Fmr1, Cntnap2, Oprm1, Shank3 (Harony-Nicolas et al., 2017), et Nlgn-3 (Hornberg et al., 2020) ou à l’exposition environnementale à l’acide valproïque, présentent indirectement un déficit du système OT cérébral (Wagner & Harony-Nicolas, 2018). Bien que la plupart des études sur les comportements sociaux dépendant de l’OT aient été menées à l’âge adulte, des données convaincantes sont en faveur de l’idée que l’OT joue des rôles clés dans le façonnement de divers comportements et traits sociaux dans la petite enfance (Bosch & Neumann, 2008 ; Eaton et al., 2012 ; Miller & Caldwell, 2015 ; Lefevre & Sirigu, 2016 ; Muscatelli et al., 2018). Lukas et al. (2010) ont montré que l’exposition à un stress en début de vie tel que la séparation maternelle interfère avec le développement normal de la liaison de l’OT aux récepteurs OTR et V1AR dans des régions spécifiques du cerveau antérieur. De telles modifications pourraient contribuer à l’agressivité (Veenema et al., 2006 ; Veenema & Neumann, 2009) et à d’autres altérations de comportements sociaux dont les comportements sexuels ou la cognition sociale à l’âge adulte. Chez l’Homme, des études récentes ont tenté d’établir un lien entre la maltraitance des enfants (Smearman et al., 2016) ou les soins parentaux (Unternaehrer et al., 2015) et les niveaux d’expression d’OTR via le statut de méthylation du promoteur du gène codant ce récepteur.
Un rapport déséquilibré entre le taux d’excitation/inhibition (E/I) et une plasticité synaptique altérée a été associé à la plupart de ces pathologies. Il a été montré que l’OT, via ses récepteurs OTR, contrôle d’une part le rapport E/I dépendant du GABA (Lopatina et al., 2018 ; Bertoni et al., 2021) et, d’autre part, la plasticité synaptique via l’expression de molécules synaptiques (Reichova et al., 2021). D’autres études suggèrent par ailleurs que l’OT est un dénominateur commun dans les mécanismes pathogènes responsables des déficiences sociales et couvrant l’ensemble des étiologies de l’autisme (Hornberg et al., 2020 ; Lewis et al., 2020).
Il est bien établi que les expériences négatives vécues au début de la vie altèrent les comportements sociaux et ont des effets à long terme, qui dépendent du sexe, sur le système OT, en particulier sur l’expression des OTR (Bales & Perkeybile, 2012 ; Veenema, 2012 ; Perkeybile et al., 2019 ; Lapp et al., 2020). Dans la même ligne, il a également été démontré que, chez les souriceaux, l’expérience sensorielle influence la production d’OT et que celle-ci façonne les circuits neuronaux en modulant l’activité spontanée et évoquée (cf. ci-dessus). Ainsi, la section du nerf infraorbitaire à JPN3, un modèle bien connu de privation de moustaches, compromet la mémoire sociale et la mémoire spatiale chez les souris adultes (Zhang et al., 2016). Le déficit de mémoire sociale chez l’adulte est associé à une réduction des niveaux d’OT dans l’hypothalamus et peut être partiellement restauré par l’administration intranasale de la neurohormone.
Collectivement, ces études confirment un rôle pour le système OT dans le développement postnatal précoce de diverses régions du cerveau, en particulier le cortex et l’hippocampe. Le système OT est à la fois une cible et un médiateur des fonctions sensorielles précoces ; il contrôle la quantité d’OTR dans le cerveau en développement et adulte et le rapport E/I via, en partie, l’activité GABAergique et la plasticité synaptique.
Effets à long terme du traitement à l’ocytocine dans la petite enfance
Une autre façon d’examiner les effets précoces du système OT est d’administrer l’OT aux nouveau-nés à la naissance ; un tel traitement produit des effets durables sur le système OT et sur le comportement social chez les campagnols sauvages (Bales & Carter, 2003a, b: Cushing & Kramer, 2005 ; Bales et al., 2007). En outre, les effets de l’administration d’OT à la mère sur la progéniture du campagnol des prairies ont également été caractérisés (Bales & Carter, 2003a: Kenkel et al., 2019) ; ils consistent à l’âge adulte en une augmentation des soins alloparentaux envers les petits et aussi des contacts sociaux étroits avec d’autres adultes. De plus, une élévation de la densité des OTR a été observée dans le cerveau des mâles adultes dont la mère avait été traitée à l’OT. Il est intéressant de noter que l’administration intranasale d’OT à des nouveau-nés macaques rhésus a augmenté les gestes de communication affiliative des nourrissons et diminué le cortisol salivaire ; à un âge plus tardif, des niveaux d’OT plus élevés étaient aussi associés à un plus grand intérêt social. Les nourrissons ayant les capacités d’imitation les plus grandes étaient ceux qui avaient le plus réagi à l’administration d’OT, laissant à penser que la sensibilité à l’OT peut sous-tendre la motivation sociale précoce (Simpson et al., 2014).
Parmi les TSA causés par une mutation génétique, le SYS et le PWS sont des maladies neurodéveloppementales qui se manifestent par des difficultés d’alimentation dès la naissance, un retard de développement et une déficience intellectuelle (Figure 2). Le modèle de souris Magel2 KO est un exemple intéressant montrant un déficit de succion à la naissance (voir ci-dessus) et des altérations de la cognition et du comportement social aux stades juvénile et adulte chez les mutants survivants (Meziane et al., 2014 ; Bertoni et al., 2021). Les souris Magel2 KO présentent une diminution de la libération d’OT mature à la naissance, qui est corrélée à des altérations du comportement alimentaire (Schaller et al., 2010). Chez les mutants adultes, une altération de l’innervation OT et de l’expression des OTR a également été rapportée (Meziane et al., 2014). Les effets à long terme du traitement par OT pendant la première semaine de vie (une administration sous-cutanée chaque jour, commençant juste après la naissance) ont également été évalués. Pour étudier, de manière plus approfondie, ces effets à long terme sur le comportement adulte, nous nous sommes concentrés sur la mémoire sociale qui est altérée chez les souris Magel2-KO mâles. Nous avons établi que les transcrits de Magel2 et Otr sont co-exprimés dans le gyrus denté et les régions hippocampiques CA2/CA3 impliquées dans les circuits qui sous-tendent la mémoire sociale. Chez les souris mutantes Magel2-KO, nous avons démontré une plus forte activité GABAergique des cellules pyramidales CA3 associée à une augmentation de la quantité de cellules exprimant l’OTR, principalement des interneurones à somatostatine, dans des régions hippocampiques et à des stades spécifiques du développement. Nous avons également révélé un retard dans la séquence du développement GABAergique chez les souriceaux déficients en Magel2. Surtout, nous avons démontré les effets positifs de l’administration sous-cutanée d’OT chez les nouveau-nés mutants, corrigeant les altérations neuroanatomiques de l’hippocampe et celles de la mémoire sociale à l’âge adulte (Bertoni et al., 2021).
En conclusion, bien que les mécanismes moléculaires et les circuits neuronaux impliqués restent largement à explorer, nous avons démontré que le traitement par OT chez les nouveau-nés ou pendant la petite enfance a un effet déterminant pour façonner le comportement social des nourrissons en contrôlant le développement des structures cérébrales, avec des conséquences sur le comportement adulte.
Les difficultés d’alimentation précoce : un comportement pertinent des troubles neurodéveloppementaux
L’association d’un dysfonctionnement du comportement social à des troubles de l’alimentation est décrite dans de nombreuses pathologies au point que l’altération du comportement alimentaire peut être considérée comme une facette de la pathologie. En effet, la prévalence des troubles de l’alimentation chez les enfants présentant des déficits intellectuels de développement ou des TSA est estimée à 90 % (Kodak & Piazza, 2008 ; Gal et al., 2011).
En 1943, Leo Kanner avait déjà publié ses premières observations sur des enfants autistes présentant des problèmes d’alimentation dans la petite enfance. Cette corrélation a été étudiée plus en détail 60 ans plus tard. En ce qui concerne les très jeunes enfants, Keen (2008) a suggéré une association entre l’apparition précoce de problèmes d’alimentation avec le « Failure To Thrive » et une série d’anomalies de la réactivité sociale, y compris les TSA. Ravi et al. (2016) ont signalé l’absence d’allaitement maternel dans la demi-heure suivant la naissance et, plus tard, l’absence d’allaitement maternel exclusif au cours des premiers mois chez 33 enfants atteints de TSA. Pour leur part, Al-Farsi et al. (2012) ont rapporté des cas de TSA (102 patients) souvent caractérisés par une initiation tardive de l’allaitement après la naissance. Enfin Lucas & Cutler (2015) ont décrit des problèmes d’activité de succion chez 19 enfants nés à terme qui ont été diagnostiqués ultérieurement comme autistes.
En conclusion, nous proposons la prise en compte des problèmes d’alimentation précoces et leur étude plus approfondie dans des cohortes de patients atteints de TSA afin de disposer dans la population pédiatrique générale d’un marqueur précoce des TSA.
Les problèmes d’alimentation précoces corrélés à un « phénotype TSA » ultérieur n’ont pas souvent été signalés chez les souris mutantes, probablement pour deux raisons principales. Premièrement, un certain nombre de souris mutantes présentant des altérations précoces de l’alimentation meurent dans un délai de 12 à 24 heures après la naissance, ce qui rend impossible la poursuite des études (Wainai et al., 2001 ; Takehara et al., 2004). Deuxièmement, bien que de nombreux modèles génétiques murins des TSA aient été décrits, ils ont été principalement étudiés au stade adulte et il existe peu de travaux sur la naissance et le comportement alimentaire précoce.
Conclusion
Les premiers comportements sensorimoteurs et sociaux d’un mammifère nouveau-né sont d’identifier sa mère, de trouver le mamelon et de téter le lait. Il n’est donc pas surprenant que l’OT, en intégrant les entrées sensorielles chez les nouveau-nés, joue un rôle important dans ces processus. Le système OT est impliqué, dès la naissance, dans les premières interactions sociales associées au comportement alimentaire du côté de la mère (lactation) et du côté du bébé (succion, tétée) permettant de créer un lien fort mère-nourrisson (Figure 4). Ainsi, en plus de favoriser le développement du système sensori-moteur, l’OT a une action concertée entre la mère et le bébé, probablement en favorisant l’initiation d’un comportement alimentaire. La façon dont ces deux types de comportements sont liés et dépendent des circuits de l’OT est éclairée par les pathologies dans lesquelles les deux comportements sont affectés.
On peut supposer que les troubles de l’alimentation dans la petite enfance puissent conduire à des altérations du comportement social plus tard dans la vie. Les troubles alimentaires précoces pourraient être un marqueur précoce de troubles neuro-développementaux tels que les TSA et constituer une indication pour un traitement OT précoce de ces patients. Des études supplémentaires permettraient de valider cette hypothèse.
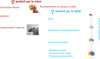 |
Figure 4 L’ocytocine produite par la mère ( |
Références
- Al-Farsi, Y.M., Al-Sharbati, M.M., Waly, M.I., Al-Farsi, O.A., Al-Shafaee, M.A., Al-Khaduri, M.M., Trivedi, M.S., Deth, R.C. (2012). Effect of suboptimal breast-feeding on occurrence of autism: a case-control study. Nutrition, 28, e27-32. [CrossRef] [PubMed] [Google Scholar]
- Alberts, J.R., Ronca, A.E. (2012). The experience of being born: a natural context for learning to suckle. Int J Pediatr, 2012, 129328. [PubMed] [Google Scholar]
- Althammer, F., Grinevich, V. (2017). Diversity of oxytocin neurons: beyond magno- and parvocellular cell types? J Neuroendocrinol. https://doi.org/10.1111/jne.12549. [PubMed] [Google Scholar]
- Althammer, F., Muscatelli, F., Grinevich, V., Schaaf, C.P. (2022). Oxytocin-based therapies for treatment of Prader-Willi and Schaaf-Yang syndromes: evidence, disappointments, and future research strategies. Transl Psychiatry, 12, 318. [CrossRef] [PubMed] [Google Scholar]
- Bales, K.L., Carter, C.S. (2003a). Developmental exposure to oxytocin facilitates partner preferences in male prairie voles (Microtus ochrogaster). Behav Neurosci, 117, 854-859. [CrossRef] [PubMed] [Google Scholar]
- Bales, K.L., Carter, C.S. (2003b). Sex differences and developmental effects of oxytocin on aggression and social behavior in prairie voles (Microtus ochrogaster). Horm Behav, 44, 178-184. [CrossRef] [PubMed] [Google Scholar]
- Bales, K.L., Perkeybile, A.M. (2012). Developmental experiences and the oxytocin receptor system. Horm Behav, 61, 313-319. [CrossRef] [PubMed] [Google Scholar]
- Bales, K.L., Plotsky, P.M., Young, L.J., Lim, M.M., Grotte, N., Ferrer, E., Carter, C.S. (2007). Neonatal oxytocin manipulations have long-lasting, sexually dimorphic effects on vasopressin receptors. Neuroscience, 144, 38-45. [CrossRef] [MathSciNet] [Google Scholar]
- Barrett, C.E., Arambula, S.E., Young, L.J. (2015). The oxytocin system promotes resilience to the effects of neonatal isolation on adult social attachment in female prairie voles. Transl Psychiatry, 5, e606. [CrossRef] [PubMed] [Google Scholar]
- Bertoni, A., Schaller, F., Tyzio, R., Gaillard, S., Santini, F., Xolin, M., Diabira, D., Vaidyanathan, R., Matarazzo, V., Medina, I., Hammock, E., Zhang, J., Chini, B., Gaiarsa, J.L., Muscatelli, F. (2021). Oxytocin administration in neonates shapes hippocampal circuitry and restores social behavior in a mouse model of autism. Mol Psychiatry, 12, 7582-7585. [CrossRef] [PubMed] [Google Scholar]
- Bosch, O.J., Neumann, I.D. (2008). Brain vasopressin is an important regulator of maternal behavior independent of dams’ trait anxiety. Proc Natl Acad Sci USA, 105, 17139-17144. [CrossRef] [PubMed] [Google Scholar]
- Brown, C.H., Ludwig, M., Tasker, J.G., Stern, J.E. (2020). Somato-dendritic vasopressin and oxytocin secretion in endocrine and autonomic regulation. J Neuroendocrinol, 32, e12856. [CrossRef] [PubMed] [Google Scholar]
- Busnelli, M., Chini, B. (2018). Molecular basis of oxytocin receptor signalling in the brain: What we know and what we need to know. Curr Top Behav Neurosci, 35, 3-29. [CrossRef] [PubMed] [Google Scholar]
- Caba, M., Rovirosa, M.J., Silver, R. (2003). Suckling and genital stroking induces Fos expression in hypothalamic oxytocinergic neurons of rabbit pups. Brain Res Dev Brain Res, 143, 119-128. [CrossRef] [PubMed] [Google Scholar]
- Choleris, E., Clipperton-Allen, A.E., Phan, A., Kavaliers, M. (2009). Neuroendocrinology of social information processing in rats and mice. Front Neuroendocrinol, 30, 442-459. [CrossRef] [PubMed] [Google Scholar]
- Cushing, B.S., Kramer, K.M. (2005). Mechanisms underlying epigenetic effects of early social experience: the role of neuropeptides and steroids. Neurosci Biobehav Rev, 29, 1089-1105. [Google Scholar]
- Da Prato, L.C., Zayan, U., Abdallah, D., Point, V., Schaller, F., Pallesi-Pocachard, E., Montheil, A., Canaan, S., Gaiarsa, J.L., Muscatelli, F., Matarazzo, V. (2022). Early life oxytocin treatment improves thermo-sensory reactivity and maternal behavior in neonates lacking the autism-associated gene Magel2. Neuropsychopharmacology, 47, 1901-1912. [CrossRef] [PubMed] [Google Scholar]
- Eaton, J.L., Roache, L., Nguyen, K.N., Cushing, B.S., Troyer, E., Papademetriou, E., Raghanti, M.A. (2012). Organizational effects of oxytocin on serotonin innervation. Dev Psychobiol, 54, 92-97. [CrossRef] [PubMed] [Google Scholar]
- Ferguson, J.N., Aldag, J.M., Insel, T.R., Young, L.J. (2001). Oxytocin in the medial amygdala is essential for social recognition in the mouse. J Neurosci, 21, 8278-8285. [CrossRef] [PubMed] [Google Scholar]
- Fountain, M.D., Schaaf, C.P. (2016). Prader-Willi syndrome and Schaaf-Yang syndrome: Neurodevelopmental diseases intersecting at the MAGEL2 gene. Diseases, 4, 2. https://doi.org/10.3390/diseases4010002. [CrossRef] [PubMed] [Google Scholar]
- Frasnelli, J., Schuster, B., Hummel, T. (2007). Interactions between olfaction and the trigeminal system: what can be learned from olfactory loss. Cereb Cortex, 17, 2268-2275. [CrossRef] [PubMed] [Google Scholar]
- Gal, E., Hardal-Nasser, R., Engel-Yeger, B. (2011). The relationship between the severity of eating problems and intellectual developmental deficit level. Res Dev Disabil, 32, 1464-1469. [CrossRef] [PubMed] [Google Scholar]
- Greenwood, M.A., Hammock, E.A. (2017). Oxytocin receptor binding sites in the periphery of the neonatal mouse. PLoS One, 12, e0172904. [PubMed] [Google Scholar]
- Grinevich, V., Desarménien, M.G., Tauber, M., Muscatelli, F. (2016). Ontogenesis of oxytocin in the mammalian brain: late maturation and psychoscial disorders. Front Neuroanat, 8, 164. [Google Scholar]
- Grimsley, J.M., Monaghan, J.J., Wenstrup, J.J. (2011). Development of social vocalizations in mice. PLoS One, 6, e17460. [CrossRef] [PubMed] [Google Scholar]
- Hammock, E.A., Levitt, P. (2013). Oxytocin receptor ligand binding in embryonic tissue and postnatal brain development of the C57BL/6J mouse. Front Behav Neurosci, 7, 195. [CrossRef] [PubMed] [Google Scholar]
- Harony-Nicolas, H., Kay, M., du Hoffmann, J., Klein, M.E., Bozdagi-Gunal, O., Riad, M., Daskalakis, N.P., Sonar, S., Castillo, P.E., Hof, P.R., Shapiro, M.L., Baxter, M.G., Wagner, S., Buxbaum, J.D. (2017). Oxytocin improves behavioral and electrophysiological deficits in a novel Shank3-deficient rat. Elife, 6, e18904. [CrossRef] [PubMed] [Google Scholar]
- Heinrichs, M., von Dawans, B., Domes, G. (2009). Oxytocin, vasopressin, and human social behavior. Front Neuroendocrinol, 30, 548-557. [CrossRef] [PubMed] [Google Scholar]
- Hoffiz, Y.C., Castillo-Ruiz, A., Hall, M.A.L., Hite, T.A., Gray, J.M., Cisternas, C.D., Cortes, L.R., Jacobs, A.J., Forger, N.G. (2021). Birth elicits a conserved neuroendocrine response with implications for perinatal osmoregulation and neuronal cell death. Sci Rep, 11, 2335. [CrossRef] [PubMed] [Google Scholar]
- Hongo, T., Hakuba, A., Shiota, K., Naruse, I. (2000). Suckling dysfunction caused by defects in the olfactory system in genetic arhinencephaly mice. Biol Neonate, 78, 293-299. [CrossRef] [Google Scholar]
- Hornberg, H., Perez-Garci, E., Schreiner, D., Hatstatt-Burkle, L., Magara, F., Baudouin, S., Matter, A., Nacro, K., Pecho-Vrieseling, E., Scheiffele, P. (2020). Rescue of oxytocin response and social behaviour in a mouse model of autism. Nature, 584, 252-256. [CrossRef] [PubMed] [Google Scholar]
- Inoue, N., Nishizumi, H., Ooyama, R., Mogi, K., Nishimori, K., Kikusui, T., Sakano, H. (2021). The olfactory critical period is determined by activity-dependent Sema7A/PlxnC1 signaling within glomeruli. Elife, 10, e65078. https://doi.org/10.7554/eLife.65078. [PubMed] [Google Scholar]
- Insel, T.R. (2010). The challenge of translation in social neuroscience: a review of oxytocin, vasopressin, and affiliative behavior. Neuron, 65, 768-779. [CrossRef] [PubMed] [Google Scholar]
- Jin, D., Liu, H.X., Hirai, H., Torashima, T., Nagai, T., Lopatina, O., Shnayder, N.A., Yamada, K., Noda, M., Seike, T., Fujita, K., Takasawa, S., Yokoyama, S., Koizumi, K., Shiraishi, Y., Tanaka, S., Hashii, M., Yoshihara, T., Higashida, K., Islam, M.S., Yamada, N., Hayashi, K., Noguchi, N., Kato, I., Okamoto, H., Matsushima, A., Salmina, A., Munesue, T., Shimizu, N., Mochida, S., Asano, M., Higashida, H. (2007). CD38 is critical for social behaviour by regulating oxytocin secretion. Nature, 446, 41-45. [CrossRef] [PubMed] [Google Scholar]
- Johnson, Z.V., Young, L.J. (2017). Oxytocin and vasopressin neural networks: Implications for social behavioral diversity and translational neuroscience. Neurosci Biobehav Rev, 76, 87-98. [CrossRef] [PubMed] [Google Scholar]
- Jurek, B., Neumann, I.D. (2018). The oxytocin receptor: From intracellular signaling to behavior. Physiol Rev, 98, 1805-1908. [CrossRef] [PubMed] [Google Scholar]
- Keen, D.V. (2008). Childhood autism, feeding problems and failure to thrive in early infancy. Seven case studies. Eur Child Adolesc Psychiatry, 17, 209-216. [CrossRef] [PubMed] [Google Scholar]
- Kenkel, W.M., Perkeybile, A.M., Yee, J.R., Pournajafi-Nazarloo, H., Lillard, T.S., Ferguson, E.F., Wroblewski, K.L., Ferris, C.F., Carter, C.S., Connelly, J.J. (2019). Behavioral and epigenetic consequences of oxytocin treatment at birth. Sci Adv, 5, eaav2244. [CrossRef] [PubMed] [Google Scholar]
- Klein, B.Y., Tamir, H., Ludwig, R.J., Glickstein, S.B., Welch, M.G. (2017). Colostrum oxytocin modulates cellular stress response, inflammation, and autophagy markers in newborn rat gut villi. Biochem Biophys Res Commun, 487, 47-53. [CrossRef] [PubMed] [Google Scholar]
- Kodak, T., Piazza, C.C. (2008). Assessment and behavioral treatment of feeding and sleeping disorders in children with autism spectrum disorders. Child Adolesc Psychiatr Clin N Am, 17, 887-905. [CrossRef] [PubMed] [Google Scholar]
- Kojima, S., Alberts, J.R. (2011a). Oxytocin mediates the acquisition of filial, odor-guided huddling for maternally-associated odor in preweanling rats. Horm Behav, 60, 549-558. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Kojima, S., Alberts, J.R. (2011b). Warmth from skin-to-skin contact with mother is essential for the acquisition of filial huddling preference in preweanling rats. Dev Psychobiol, 53, 813-827. [CrossRef] [PubMed] [Google Scholar]
- Kojima, S., Stewart, R.A., Demas, G.E., Alberts, J.R. (2012). Maternal contact differentially modulates central and peripheral oxytocin in rat pups during a brief regime of mother-pup interaction that induces a filial huddling preference. J Neuroendocrinol, 24, 831-840. [Google Scholar]
- Lapp, H.E., Bartlett, A.A., Zup, S.L., Hunter, R.G., Moore, C.L. (2020). Early experience alters developmental trajectory of central oxytocin systems involved in hypothalamic-pituitary-adrenal axis regulation in Long-Evans rats. Horm Behav, 126, 104822. [CrossRef] [PubMed] [Google Scholar]
- Lefevre, A., Sirigu, A. (2016). The two fold role of oxytocin in social developmental disorders: A cause and a remedy? Neurosci Biobehav Rev, 63, 168-176. [CrossRef] [PubMed] [Google Scholar]
- Lenz, K.M., Sengelaub, D.R. (2010). Maternal care effects on the development of a sexually dimorphic motor system: the role of spinal oxytocin. Horm Behav, 58, 575-581. [CrossRef] [PubMed] [Google Scholar]
- Lesage, J., Bernet, F., Montel, V., Dupouy, J.P. (1996). Hypothalamic metabolism of neurotransmitters (serotonin, norepinephrine, dopamine) and NPY, and gonadal and adrenal activities, during the early postnatal period in the rat. Neurochem Res, 21, 87-96. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Lewis, E.M., Stein-O’Brien, G.L., Patino, A.V., Nardou, R., Grossman, C.D., Brown, M., Bangamwabo, B., Ndiaye, N., Giovinazzo, D., Dardani, I., Jiang, C., Goff, L.A., Dölen, G. (2020). Parallel cocial information processing circuits are differentially impacted in autism. Neuron, 108, 659-675. [CrossRef] [PubMed] [Google Scholar]
- Liu, H.X., Lopatina, O., Higashida, C., Tsuji, T., Kato, I., Takasawa, S., Okamoto, H., Yokoyama, S., Higashida, H. (2008). Locomotor activity, ultrasonic vocalization and oxytocin levels in infant CD38 knockout mice. Neurosci Lett, 448, 67-70. [CrossRef] [PubMed] [Google Scholar]
- Lopatina, O.L., Komleva, Y.K., Gorina, Y.V., Olovyannikova, R.Y., Trufanova, L.V., Hashimoto, T., Takahashi, T., Kikuchi, M., Minabe, Y., Higashida, H., Lopatina, O.L., Komleva, Y.K., Gorina, Y.V., Olovyannikova, R.Y., Trufanova, L.V., Hashimoto, T., Takahashi, T., Kikuchi, M., Minabe, Y., Higashida, H., Salmina, A.B. (2018). Oxytocin and excitation/inhibition balance in social recognition. Neuropeptides, 72, 1-11. [CrossRef] [PubMed] [Google Scholar]
- Lucas, R.F., Cutler, A. (2015). Dysregulated breastfeeding behaviors in children later diagnosed with autism. J Perinat Educ, 24, 171-180. [CrossRef] [PubMed] [Google Scholar]
- Lukas, M., Bredewold, R., Neumann, I.D., Veenema, A.H. (2010). Maternal separation interferes with developmental changes in brain vasopressin and oxytocin receptor binding in male rats. Neuropharmacology, 58, 78-87. [CrossRef] [PubMed] [Google Scholar]
- Madrigal, M.P., Jurado, S. (2021). Specification of oxytocinergic and vasopressinergic circuits in the developing mouse brain. Commun Biol, 4, 586. [CrossRef] [PubMed] [Google Scholar]
- Maldonado, P.P., Nuno-Perez, A., Kirchner, J.H., Hammock, E., Gjorgjieva, J., Lohmann, C. (2021). Oxytocin shapes spontaneous activity patterns in the developing visual cortex by activating somatostatin interneurons. Curr Biol, 31, 322-333. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Meziane, H., Schaller, F., Bauer, S., Villard, C., Matarazzo, V., Riet, F., Guillon, G., Lafitte, D., Desarmenien, M.G., Tauber, M., Muscatelli, F. (2014). An early postnatal oxytocin treatment prevents social and learning deficits in adult mice deficient for Magel2, a gene involved in Prader-Willi syndrome and autism. Biol Psychiatry, 78, 85-94. [Google Scholar]
- Miller, T.V., Caldwell, H.K. (2015). Oxytocin during development: Possible organizational effects on behavior. Front Endocrinol (Lausanne), 6, 76. [CrossRef] [PubMed] [Google Scholar]
- Mitre, M., Marlin, B.J., Schiavo, J.K., Morina, E., Norden, S.E., Hackett, T.A., Aoki, C.J., Chao, M.V., Froemke, R.C. (2016). A distributed network for social cognition enriched for oxytocin receptors. J Neurosci, 36, 2517-2535. [CrossRef] [PubMed] [Google Scholar]
- Muscatelli, F., Desarmenien, M.G., Matarazzo, V., Grinevich, V. (2018). Oxytocin signaling in the early life of mammals: link to neurodevelopmental disorders associated with ASD. Curr Top Behav Neurosci, 35, 239-268. [CrossRef] [PubMed] [Google Scholar]
- Nagasawa, M., Okabe, S., Mogi, K., Kikusui, T. (2012). Oxytocin and mutual communication in mother-infant bonding. Front Hum Neurosci, 6, 31. [CrossRef] [PubMed] [Google Scholar]
- Nelson, E., Alberts, J.R. (1997). Oxytocin-induced paw sucking in infant rats. Ann N Y Acad Sci, 807, 543-545. [CrossRef] [PubMed] [Google Scholar]
- Newmaster, K.T., Nolan, Z.T., Chon, U., Vanselow, D.J., Weit, A.R., Tabbaa, M., Hidema, S., Nishimori, K., Hammock, E.A.D., Kim, Y. (2020). Quantitative cellular-resolution map of the oxytocin receptor in postnatally developing mouse brains. Nat Commun, 11, 1885. [CrossRef] [PubMed] [Google Scholar]
- Nowak, R., Porter, R.H., Levy, F., Orgeur, P., Schaal, B. (2000). Role of mother-young interactions in the survival of offspring in domestic mammals. Rev Reprod, 5, 153-163. [CrossRef] [PubMed] [Google Scholar]
- Oettl, L.L., Kelsch, W. (2018). Oxytocin and olfaction. Curr Top Behav Neurosci, 35, 55-75. [CrossRef] [PubMed] [Google Scholar]
- Oettl, L.L., Ravi, N., Schneider, M., Scheller, M.F., Schneider, P., Mitre, M., da Silva Gouveia, M., Froemke, R.C., Chao, M.V., Young, W.S., Meyer-Lindenberg, A., Grinevich, V., Shusterman, R., Kelsch, W. (2016). Oxytocin enhances social recognition by modulating cortical control of early olfactory processing. Neuron, 90, 609-621. [CrossRef] [PubMed] [Google Scholar]
- Okabe, S., Nagasawa, M., Mogi, K., Kikusui, T. (2012). Importance of mother-infant communication for social bond formation in mammals. Anim Sci J, 83, 446-452. [CrossRef] [PubMed] [Google Scholar]
- Onaka, T., Takayanagi, Y. (2021). The oxytocin system and early-life experience-dependent plastic changes. J Neuroendocrinol, 33, e13049. [CrossRef] [Google Scholar]
- Pedersen, P.E., Williams, C.L., Blass, E.M. (1982). Activation and odor conditioning of suckling behavior in 3-day-old albino rats. J Exp Psychol Anim Behav Process, 8, 329-341. [CrossRef] [PubMed] [Google Scholar]
- Perkeybile, A.M., Carter, C.S., Wroblewski, K.L., Puglia, M.H., Kenkel, W.M., Lillard, T.S., Karaoli, T., Gregory, S.G., Mohammadi, N., Epstein, L., Bales, K.L., Connelly, J.J. (2019). Early nurture epigenetically tunes the oxytocin receptor. Psychoneuroendocrinology, 99, 128-136. [CrossRef] [PubMed] [Google Scholar]
- Poisbeau, P., Grinevich, V., Charlet, A. (2018). Oxytocin signaling in pain: Cellular, circuit, system, and behavioral levels. Curr Top Behav Neurosci, 35, 193-211. [CrossRef] [PubMed] [Google Scholar]
- Quintana, D.S., Guastella, A.J. (2020). An allostatic theory of oxytocin. Trends Cogn Sci, 24, 515-528. [CrossRef] [PubMed] [Google Scholar]
- Ravi, S., Chandrasekaran, V., Kattimani, S., Subramanian, M. (2016). Maternal and birth risk factors for children screening positive for autism spectrum disorders on M-CHAT-R. Asian J Psychiatr, 22, 17-21. [CrossRef] [PubMed] [Google Scholar]
- Reichova, A., Schaller, F., Bukatova, S., Bacova, Z., Muscatelli, F., Bakos, J. (2021). The impact of oxytocin on neurite outgrowth and synaptic proteins in Magel2-deficient mice. Dev Neurobiol, 81, 366-388. [CrossRef] [PubMed] [Google Scholar]
- Rokicki, J., Quintana, D.S., Westlye, L.T. (2022). Linking central gene expression patterns and mental states using transcriptomics and large-scale meta-analysis of fMRI data: A tutorial and example using the oxytocin signaling pathway. Methods Mol Biol, 2384, 127-137. [CrossRef] [PubMed] [Google Scholar]
- Sala, M., Braida, D., Donzelli, A., Martucci, R., Busnelli, M., Bulgheroni, E., Rubino, T., Parolaro, D., Nishimori, K., Chini, B. (2013). Mice heterozygous for the oxytocin receptor gene (Oxtr(+/−)) show impaired social behaviour but not increased aggression or cognitive inflexibility: evidence of a selective haploinsufficiency gene effect. J Neuroendocrinol, 25, 107-118. [CrossRef] [PubMed] [Google Scholar]
- Sala, M., Braida, D., Lentini, D., Busnelli, M., Bulgheroni, E., Capurro, V., Finardi, A., Donzelli, A., Pattini, L., Rubino, T., Parolaro, D., Nishimori, K., Parenti, M., Chini, B. (2011). Pharmacologic rescue of impaired cognitive flexibility, social deficits, increased aggression, and seizure susceptibility in oxytocin receptor null mice: a neurobehavioral model of autism. Biol Psychiatry, 69, 875-882. [CrossRef] [PubMed] [Google Scholar]
- Schaal, B., Coureaud, G., Doucet, S., Delaunay-El Allam, M., Moncomble, A.S., Montigny, D., Patris, B., Holley, A. (2009). Mammary olfactory signalisation in females and odor processing in neonates: ways evolved by rabbits and humans. Behav Brain Res, 200, 346-358. [CrossRef] [PubMed] [Google Scholar]
- Schaller, F., Watrin, F., Sturny, R., Massacrier, A., Szepetowski, P., Muscatelli, F. (2010). A single postnatal injection of oxytocin rescues the lethal feeding behaviour in mouse newborns deficient for the imprinted Magel2 gene. Hum Mol Genet, 19, 4895-4905. [CrossRef] [PubMed] [Google Scholar]
- Schiavo, J.K., Valtcheva, S., Bair-Marshall, C.J., Song, S.C., Martin, K.A., Froemke, R.C. (2020). Innate and plastic mechanisms for maternal behaviour in auditory cortex. Nature, 587, 426-431. [CrossRef] [PubMed] [Google Scholar]
- Simpson, E.A., Sclafani, V., Paukner, A., Hamel, A.F., Novak, M.A., Meyer, J.S., Suomi, S.J., Ferrari, P.F. (2014). Inhaled oxytocin increases positive social behaviors in newborn macaques. Proc Natl Acad Sci U S A, 111, 6922-6927. [CrossRef] [PubMed] [Google Scholar]
- Smearman, E.L., Almli, L.M., Conneely, K.N., Brody, G.H., Sales, J.M., Bradley, B., Ressler, K.J., Smith, A.K. (2016). Oxytocin receptor genetic and epigenetic variations: Association with child abuse and adult psychiatric symptoms. Child Dev, 87, 122-134. [CrossRef] [PubMed] [Google Scholar]
- Soumier, A., Habart, M., Lio, G., Demily, C., Sirigu, A. (2022). Differential fate between oxytocin and vasopressin cells in the developing mouse brain. iScience, 25, 103655. [CrossRef] [PubMed] [Google Scholar]
- Sullivan, R.M. (2003). Developing a sense of safety: the neurobiology of neonatal attachment. Ann N Y Acad Sci, 1008, 122-131. [CrossRef] [PubMed] [Google Scholar]
- Sur, M., Rubenstein, J.L. (2005). Patterning and plasticity of the cerebral cortex. Science, 310, 805-810. [CrossRef] [PubMed] [Google Scholar]
- Takayanagi, Y., Yoshida, M., Bielsky, I.F., Ross, H.E., Kawamata, M., Onaka, T., Yanagisawa, T., Kimura, T., Matzuk, M.M., Young, L.J., Nishimori, K. (2005). Pervasive social deficits, but normal parturition, in oxytocin receptor-deficient mice. Proc Natl Acad Sci USA, 102, 16096-16101. [CrossRef] [PubMed] [Google Scholar]
- Takehara, K., Kawahara, S., Munemoto, Y., Kuriyama, H., Mori, H., Mishina, M., Kirino, Y. (2004). The N-methyl-D-aspartate (NMDA)-type glutamate receptor GluRepsilon2 is important for delay and trace eyeblink conditioning in mice. Neurosci Lett, 364, 43-47. [CrossRef] [PubMed] [Google Scholar]
- Tamborski, S., Mintz, E.M., Caldwell, H.K. (2016). Sex differences in the embryonic development of the central oxytocin system in mice. J Neuroendocrinol, 28. https://doi.org/10.1111/jne.12364. [CrossRef] [PubMed] [Google Scholar]
- Tang, Y., Benusiglio, D., Lefevre, A., Hilfiger, L., Althammer, F., Bludau, A., Hagiwara, D., Baudon, A., Darbon, P., Schimmer, J., Kirchner, M.K., Roy, R.K., Wang, S., Eliava, M., Wagner, S., Oberhuber, M., Conzelmann, K.K., Schwarz, M., Stern, J.E., Leng, G., Neumann, I.D., Charlet, A., Grinevich, V. (2020). Social touch promotes interfemale communication via activation of parvocellular oxytocin neurons. Nat Neurosci, 23, 1125-1137. [CrossRef] [PubMed] [Google Scholar]
- Tauber, M., Boulanouar, K., Diene, G., Cabal-Berthoumieu, S., Ehlinger, V., Fichaux-Bourin, P., Molinas, C., Faye, S., Valette, M., Pourrinet, J., Cessans, C., Viaux-Sauvelon S., Bascoul C., Guedeney A., Delhanty P., Geenen V., Martens H., Muscatelli F., Cohen D., Consoli, A., Payoux, P., Arnaud, C., Salles, J.P. (2017). The use of oxytocin to improve feeding and social skills in infants with Prader-Willi syndrome. Pediatrics, e20162976. [PubMed] [Google Scholar]
- Tribollet, E., Charpak, S., Schmidt, A., Dubois-Dauphin, M., Dreifuss, J.J. (1989). Appearance and transient expression of oxytocin receptors in fetal, infant, and peripubertal rat brain studied by autoradiography and electrophysiology. J Neurosci, 9, 1764-1773. [CrossRef] [PubMed] [Google Scholar]
- Tribollet, E., Goumaz, M., Raggenbass, M., Dubois-Dauphin, M., Dreifuss, J.J. (1991). Early appearance and transient expression of vasopressin receptors in the brain of rat fetus and infant. An autoradiographical and electrophysiological study. Brain Res Dev Brain Res, 58, 13-24. [CrossRef] [PubMed] [Google Scholar]
- Tyzio, R., Nardou, R., Ferrari, D.C., Tsintsadze, T., Shahrokhi, A., Eftekhari, S., Khalilov, I., Tsintsadze, V., Brouchoud, C., Chazal, G., Lemonnier, E., Lozovaya, N., Burnashev, N., Ben-Ari, Y. (2014). Oxytocin-mediated GABA inhibition during delivery attenuates autism pathogenesis in rodent offspring. Science, 343, 675-679. [CrossRef] [PubMed] [Google Scholar]
- Unternaehrer, E., Meyer, A.H., Burkhardt, S.C., Dempster, E., Staehli, S., Theill, N., Lieb, R., Meinlschmidt, G. (2015). Childhood maternal care is associated with DNA methylation of the genes for brain-derived neurotrophic factor (BDNF) and oxytocin receptor (OXTR) in peripheral blood cells in adult men and women. Stress, 18, 451-461. [CrossRef] [PubMed] [Google Scholar]
- Vaidyanathan, R., Hammock, E.A. (2017). Oxytocin receptor dynamics in the brain across development and species. Dev Neurobiol, 77, 143-157. [CrossRef] [PubMed] [Google Scholar]
- Veenema, A.H. (2012). Toward understanding how early-life social experiences alter oxytocin- and vasopressin-regulated social behaviors. Horm Behav, 61, 304-312. [CrossRef] [PubMed] [Google Scholar]
- Veenema, A.H., Blume, A., Niederle, D., Buwalda, B., Neumann, I.D. (2006). Effects of early life stress on adult male aggression and hypothalamic vasopressin and serotonin. Eur J Neurosci, 24, 1711-1720. [CrossRef] [PubMed] [Google Scholar]
- Veenema, A.H., Neumann, I.D. (2009). Maternal separation enhances offensive play-fighting, basal corticosterone and hypothalamic vasopressin mRNA expression in juvenile male rats. Psychoneuroendocrinology, 34, 463-467. [CrossRef] [PubMed] [Google Scholar]
- Wagner, S., Harony-Nicolas, H. (2018). Oxytocin and animal models for autism spectrum disorder. Curr Top Behav Neurosci, 35, 213-237. [CrossRef] [PubMed] [Google Scholar]
- Wainai, T., Takeuchi, T., Seo, N., Mishina, M. (2001). Regulation of acute nociceptive responses by the NMDA receptor GluRepsilon2 subunit. Neuroreport, 12, 3169-3172. [CrossRef] [PubMed] [Google Scholar]
- Walker, S.C., Trotter, P.D., Swaney, W.T., Marshall, A., McGlone, F.P. (2017). C-tactile afferents: cutaneous mediators of oxytocin release during affiliative tactile interactions? Neuropeptides, 64, 27-38. [CrossRef] [PubMed] [Google Scholar]
- Winslow, J.T., Hearn, E.F., Ferguson, J., Young, L.J., Matzuk, M.M., Insel, T.R. (2000). Infant vocalization, adult aggression, and fear behavior of an oxytocin null mutant mouse. Horm Behav, 37, 145-155. [Google Scholar]
- Wrobel, L.J., Reymond-Marron, I., Dupré, A., Raggenbass, M. (2010). Oxytocin and vasopressin enhance synaptic transmission in the hypoglossal motor nucleus of young rats by acting on distinct receptor types. Neuroscience, 165, 723-735. [CrossRef] [PubMed] [Google Scholar]
- Yoshimura, R., Kimura, T., Watanabe, D., Kiyama, H. (1996). Differential expression of oxytocin receptor mRNA in the developing rat brain. Neurosci Res, 24, 291-304. [CrossRef] [PubMed] [Google Scholar]
- Yu, H., Miao, W., Ji, E., Huang, S., Jin, S., Zhu, X., Liu, M.Z., Sun, Y.G., Xu, F., Yu, X. (2022). Social touch-like tactile stimulation activates a tachykinin 1-oxytocin pathway to promote social interactions. Neuron, 110, 1051-1067. [CrossRef] [PubMed] [Google Scholar]
- Zhang, J., Li, S.J., Miao, W., Zhang, X., Zheng, J.J., Wang, C., Yu, X. (2021). Oxytocin regulates synaptic transmission in the sensory cortices in a developmentally dynamic manner. Front Cell Neurosci, 15, 673439. [CrossRef] [PubMed] [Google Scholar]
- Zhang, J.B., Chen, L., Lv, Z.M., Niu, X.Y., Shao, C.C., Zhang, C., Pruski, M., Huang, Y., Qi, C.C., Song, N.N., Lang, B., Ding, Y.Q. (2016). Oxytocin is implicated in social memory deficits induced by early sensory deprivation in mice. Mol Brain, 9, 98. [CrossRef] [PubMed] [Google Scholar]
- Zheng, J.J., Li, S.J., Zhang, X.D., Miao, W.Y., Zhang, D., Yao, H., Yu, X. (2014). Oxytocin mediates early experience-dependent cross-modal plasticity in the sensory cortices. Nat Neurosci, 17, 391-399. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Muscatelli, F. (2022). L’ocytocine, dès la naissance, conditionne le comportement alimentaire et social d’un individu. Biologie Aujourd’hui, 216, 131-143
Liste des figures
 |
Figure 1 Dynamique du développement du système ocytocinergique chez la souris. (A). Maturation postnatale des neurones OT du jour de la naissance (P0) au jour 21, dans le noyau paraventriculaire (PVN) ou supraoptique (SO). (B). Développement des récepteurs OTR dans le cerveau aux stades embryonnaires (E) ou post-nataux (PN). (C). Expression des OTR dans le cerveau de souris. En jaune, les régions avec une expression transitoire des OTR ; en violet, les régions qui expriment les OTR tout au long de la vie (adapté de Grinevich et al., 2016). |
| Dans le texte | |
 |
Figure 2 MAGEL2 est impliqué dans le syndrome de Prader-Willi (SPW) et est responsable du syndrome de Schaaf-Yang (SYS). (A). Symptômes des patients atteints du SPW ou du SYS. (B). Anomalies génétiques associées au SPW ou au SYS. |
| Dans le texte | |
 |
Figure 3 Ocytocine (OT) et activité de succion. L’administration sous-cutanée d’OT rétablit une activité de succion normale chez des souriceaux Magel2 KO alors que l’injection d’un antagoniste de l’OT induit un déficit de succion chez des souriceaux sauvages. Une étude clinique (Phase I/II) montre une amélioration de l’activité de succion des bébés Prader-Willi à la suite d’une administration intranasale d’OT. |
| Dans le texte | |
 |
Figure 4 L’ocytocine produite par la mère ( |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




