| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 3-4, 2022
|
|
|---|---|---|
| Page(s) | 145 - 153 | |
| DOI | https://doi.org/10.1051/jbio/2022012 | |
| Publié en ligne | 6 février 2023 | |
Article
Ocytocine : une nouvelle cible de neuroprotection ?
Oxytocin: a new target for neuroprotection?
1
Laboratoire du développement, Université de Genève, Genève, Suisse
2
Inserm U1141, Université Paris Cité, 75019 Paris, France
3
Service de Soins Intensifs Pédiatriques et Néonatologie, Hôpitaux Universitaires de Genève, 30 boulevard de Cluse, 1205 Genève, Suisse
* Auteur correspondant : Olivier.baud@hcuge.ch
Reçu :
27
Avril
2022
Chaque année, dans le monde, 30 millions de nouveau-nés naissent après un retard de croissance intra-utérin (RCIU) et 15 millions naissent prématurément. Ces deux conditions sont les principales causes de stress anté-/périnatal et de lésions cérébrales responsables de troubles neurocognitifs et comportementaux chez plus de 9 millions d’enfants chaque année. La plupart des stratégies pharmacologiques visant à prévenir les lésions cérébrales périnatales n’ont pas réussi à démontrer des bénéfices cliniques substantiels. En revanche, l’enrichissement de l’environnement basé sur les soins de développement, le contact peau à peau et l’exposition vocale/musicale semblent avoir des effets positifs sur la structure et la fonctionnalité du cerveau. Toutefois, les mécanismes qui sous-tendent ces effets restent inconnus. De nombreuses évidences montrent qu’un environnement défavorable pendant la grossesse et la période néonatale peut influencer les réponses hormonales du nouveau-né et avoir des conséquences neurocomportementales durables pendant la petite enfance et à l’âge adulte. L’ocytocine (OT), un neuropeptide libéré par l’hypothalamus, joue un rôle pendant la période périnatale dans l’attachement parents-enfant et dans le comportement social. En outre, des études précliniques suggèrent que l’OT est capable de réguler la réponse inflammatoire centrale aux lésions dans le cerveau adulte. Ces données font de l’OT un candidat prometteur pour la neuroprotection néonatale par la régulation de la neuro-inflammation.
Abstract
Every year, 30 million infants worldwide are delivered after intra-uterine growth restriction (IUGR) and 15 million are born preterm. These two conditions are the leading causes of ante-/perinatal stress and brain injury responsible for neurocognitive and behavioral disorders affecting more than 9 million children each year. Most pharmacological candidates to prevent perinatal brain damage have failed to demonstrate substantial benefits. In contrast, environment enrichment based on developmental care, skin-to-skin contact and vocal/music exposure appear to exert positive effects on brain structure and function. However, mechanisms underlying these effects remain unknown. There is strong evidence that an adverse environment during pregnancy and the neonatal period can influence hormonal responses of the newborn with long-lasting neurobehavioral consequences in infancy and adulthood. In particular, excessive cortisol release in response to perinatal stress associated with prematurity or IUGR is recognized to induce brain-programming effects and neuroinflammation, a key predictor of subsequent neurological impairments. These deleterious effects are known to be balanced by oxytocin (OT), a neuropeptide released by the hypothalamus, which plays a role during the perinatal period and in social behavior. In addition, preclinical studies suggest that OT is able to regulate the central inflammatory response to injury in the adult brain. Using a rodent model of IUGR associated with developing white matter damage, we recently reported that carbetocin, a brain permeable OT receptor (OTR) agonist, induced a significant reduction of activated microglia, the primary immune cells of the brain. Moreover, this reduced microglia reactivity was associated with long-term neuroprotection. These findings make OT a promising candidate for neonatal neuroprotection through neuroinflammation regulation. However, the mechanisms linking endogenous OT and central inflammation response to injury have not yet been established. Further studies are needed to assess the protective role of OT in the developing brain through modulation of microglial activation, a key feature of brain injury observed in infants born preterm or growth-restricted. They are expected to have several impacts in the near future not only for improving knowledge of microglial cell physiology and reactivity during brain development, but also to design clinical trials testing interventions associated with endogenous OT release as a relevant strategy to alleviate neuroinflammation in neonates.
Mots clés : ocytocine / neuroprotection / nouveau-né prématuré / lésions cérébrales / microglie
Key words: oxytocin / neuroprotection / preterm infants / brain lesions / microglia
© Société de Biologie, 2023
Abréviations
HPA : Axe hypothalamo-hypophyso-surrénalien
OTR : Récepteur de l’ocytocine
RCIU : Retard de croissance intra-utérin
TSA : Troubles du spectre autistique
La prématurité : un enjeu majeur de santé publique
Parmi plus de 5 millions de naissances par an, le taux estimé de naissances prématurées en Europe varie de 6,3 % à 13,3 % et a augmenté ces dernières années dans la plupart des pays (Zeitlin et al., 2013 ; Chawanpaiboon et al., 2019). Alors que la survie des enfants nés très prématurément (< 32 semaines de gestation) augmente, les morbidités néonatales associées à l’accouchement prématuré restent plus ou moins inchangées, entraînant des conditions difficiles pour le développement du cerveau. La grande prématurité est donc un facteur de risque majeur de déficience neurocognitive et de troubles neurocomportementaux pendant la petite enfance et à l’âge adulte (Delobel-Ayoub et al., 2009). Parmi les 50 000 grands prématurés mis au monde chaque année en Europe, 10 % développeront une infirmité motrice cérébrale et 35 % présenteront des déficits cognitifs et socio-émotionnels persistants entraînant des troubles neuropsychiatriques, notamment des troubles du spectre autistique (TSA) et des troubles de l’attention (Volpe, 2011). La prévention des lésions cérébrales chez les grands prématurés et de leurs conséquences à long terme est donc une priorité de santé publique.
L’altération du développement cérébral chez les prématurés et ses conséquences neurocomportementales
Les atteintes cérébrales chez les prématurés entraînent un amalgame complexe de lésions primaires et de troubles secondaires de la maturation et de la trophicité et, par conséquent, des problèmes neurocognitifs et comportementaux à long terme (Ball et al., 2017). Ont ainsi été décrits chez les prématurés une altération de la croissance cérébrale (Gui et al., 2019) et des réseaux de substance blanche dans les circuits associatifs et limbiques cortico-basaux et thalamo-corticaux impliquant le cortex préfrontal dorsolatéral, le cortex orbitofrontal (Fischi-Gomez et al., 2015) et l’amygdale (Cismaru et al., 2016). Ces modifications structurelles du cerveau ont été associées à des déficits du traitement précoce des émotions et de leur régulation (Langerock et al., 2013 ; Witt et al., 2014), ainsi qu’à des troubles de l’attention, du contrôle exécutif et du raisonnement social (Kalpakidou et al., 2014 ; Lejeune et al., 2016 ; Munoz-Moreno et al., 2016 ; Reveillon et al., 2016 ; Urben et al., 2017).
Stratégies de neuroprotection néonatale : un défi non résolu
L’absence de stratégies validées pour prévenir les conséquences neurodéveloppementales et socio-émotionnelles de la prématurité souligne la nécessité de poursuivre les recherches afin d’identifier la meilleure option pour préserver la trajectoire du développement du cerveau. En effet, la plupart des agents pharmacologiques n’induisent que peu ou pas d’effets cliniquement efficaces pour prévenir les lésions cérébrales périnatales (Natalucci et al., 2016 ; Shepherd et al., 2017 ; Ruegger et al., 2018 ; Fleiss & Gressens, 2019 ; Juul et al., 2020). Ainsi, aucune amélioration significative des capacités cognitives n’a été observée chez les enfants nés très prématurément entre 1990 et 2008 (Twilhaar et al., 2018).
En revanche, l’enrichissement de l’environnement basé sur des soins axés sur le développement, l’amélioration des expériences sensorielles, les soins kangourou et le contact peau à peau ont montré des effets positifs (Als et al., 2012 ; Charpak et al., 2017 ; Ropars et al., 2018 ; Pineda et al., 2020). De plus, l’exposition à la voix maternelle ou à la musique s’est avérée avoir des effets bénéfiques sur le développement du cerveau (Chikahisa et al., 2006 ; Loewy et al., 2013 ; Lordier et al., 2019a), et notamment réduire l’altération de la connectivité fonctionnelle des réseaux neuronaux liée à une naissance prématurée (Lordier et al., 2019b). D’une manière générale, il est reconnu que les interventions parentales précoces sont associées à une meilleure évolution neurocognitive chez les grands prématurés (Herd et al., 2014).
Si les mécanismes qui sous-tendent ces effets restent inconnus, la modification de l’environnement hormonal du nourrisson en réponse à ces interventions pourrait jouer un rôle. En effet, un environnement nocif associé à un accouchement prématuré peut exacerber la réponse au stress chez les prématurés, en augmentant les concentrations sériques de cortisol et en réduisant la libération d’ocytocine (OT), une hormone fortement impliquée dans la reconnaissance sociale, les émotions et l’attachement parental (Rajamani et al., 2018). L’OT est un neuropeptide libéré par l’hypothalamus, connu pour atténuer l’activation de l’axe hypothalamo-hypophysio-surrénalien (HPA) et la libération de cortisol en réponse au stress, tant chez l’Homme (Cardoso et al., 2014) que chez les rongeurs (Windle et al., 1997, 2004 ; Neumann et al., 2000 ; Jurek et al., 2015 ; Mairesse et al., 2015). Outre son rôle dans le travail et la lactation, des études récentes ont également mis en évidence un rôle central de l’OT dans la régulation de la réponse inflammatoire dans le cerveau adulte (Karelina et al., 2011 ; Yuan et al., 2016 ; Amini-Khoei et al., 2017) et dans la médiation de plusieurs comportements, notamment la reconnaissance sociale et l’éducation des enfants, et les émotions. Chez les adultes humains, l’exposition à la musique induit une augmentation de la concentration d’OT et au contraire une diminution du cortisol dans la salive (Ooishi et al., 2017). Chez le rongeur, l’OT est une hormone importante pour la régulation du comportement et des soins maternels (Pedersen et al., 1982 ; Francis et al., 2000) ; de plus, les comportements sociaux, notamment ceux impliquant des vocalisations, sont associés à la libération d’OT (Tops, 2010 ; Theofanopoulou et al., 2017). Par conséquent, l’OT peut jouer un rôle important dans la médiation des bienfaits d’un enrichissement de l’environnement sur le cerveau en développement.
La neuro-inflammation : une caractéristique des lésions cérébrales périnatales
L’inflammation périnatale est un facteur de risque majeur de prématurité augurant une mauvaise évolution neurologique, avec des séquelles permanentes chez 9 millions de nourrissons chaque année (Dammann & Leviton, 2004 ; Volpe, 2008 ; Wu et al., 2009). Les événements périnataux indésirables associés à l’inflammation systémique sont connus pour activer les cellules microgliales (Hoogland et al., 2015), macrophages résidents du système nerveux central, et pour sensibiliser le cerveau en développement à une atteinte hypoxique ou excitatrice secondaire (Mallard & Hagberg, 2007). Les anomalies de l’élagage synaptique et de la croissance axonale, ainsi que le blocage de la lignée oligodendrocytaire entraînant une myélinisation défectueuse, sont des processus cellulaires majeurs impliqués dans ces vulnérabilités développementales et sont fortement associés à une activation microgliale anormale. Il reste à déterminer si d’autres acteurs clés, notamment le stress et les hormones, pourraient être impliqués dans le lien de causalité entre la prématurité ou le RCIU, l’activation microgliale et les lésions cérébrales et les troubles du développement qui en découlent (Figure 1).
 |
Figure 1 Rôle des cellules microgliales dans le développement des lésions cérébrales néonatales et leurs conséquences à long terme. |
Rôle de la microglie dans le développement et la réparation des lésions cérébrales périnatales
Les cellules microgliales constituent un ensemble de types cellulaires hétérogènes dont le destin et le comportement varient en réponse à un stimulus donné (inflammatoire, hypoxique, toxique). Elles jouent un rôle majeur au cours du développement, notamment lorsque le cerveau est soumis à des événements périnataux anormaux (Salter & Stevens, 2017). L’activation microgliale est une caractéristique de la plupart des troubles neurologiques liés à des événements périnataux indésirables, acquérant des phénotypes dynamiques divers et complexes en fonction de la nature et de la gravité de la lésion, tant chez l’Homme que chez les rongeurs (Gautier et al., 2012 ; Chhor et al., 2013 ; Hellstrom Erkenstam et al., 2016). En réponse aux stimuli périnataux, ces cellules immunitaires peuvent exercer des effets négatifs ou positifs en libérant des produits neurotoxiques qui perturbent les processus de développement normaux ou en favorisant la réparation et la régénération. Aussi bien chez l’Homme que dans des modèles précliniques de lésions cérébrales périnatales, les fonctions neurotoxiques exacerbées de la microglie sont fortement associées à des déficiences comportementales et cognitives. Malgré l’impact délétère de leur activation cytotoxique, les cellules microgliales ont également des rôles physiologiques multiples dans la prolifération neuronale, la mort programmée des cellules neuronales, l’angiogenèse, la synaptogenèse et l’élagage synaptique, et peuvent médier des fonctions neuroprotectrices (Pont-Lezica et al., 2011 ; Hellwig et al., 2013). Les lésions tissulaires elles-mêmes sont de puissants modulateurs de la microglie visant à restaurer la fonction cellulaire dans des conditions lésionnelles. La reprogrammation de la microglie vers des fonctions physiologiques semble être une stratégie pertinente pour protéger le cerveau en développement contre les lésions (Rivest, 2009 ; Miron et al., 2013 ; Fumagalli et al., 2018). Ainsi, plusieurs hormones, dont les stéroïdes, les œstrogènes et la mélatonine, ont été signalées comme régulant directement ou indirectement l’activité microgliale pendant la période périnatale chez les rongeurs (Gomez-Gonzalez & Escobar, 2010 ; Robertson et al., 2013 ; Pansiot et al., 2016).
Environnement périnatal, axe hypothalamo-hypophysaire et système ocytoninergique
Un environnement défavorable pendant la grossesse et la période périnatale peut influencer les réponses hormonales du nouveau-né et avoir des conséquences neurocomportementales durables pendant la petite enfance et à l’âge adulte (Barker et al., 1993 ; Heim & Nemeroff, 1999). Le cerveau en développement est très sensible à la programmation prénatale, et les glucocorticoïdes (GC) produits en réponse au stress sont bien connus pour leurs effets sur ce processus (Seckl, 1998). Outre leurs actions anti-inflammatoires à faible dose, les GC, lorsqu’ils sont produits en excès et de manière chronique, deviennent pro-inflammatoires, notamment au moment de la séparation maternelle, une condition constante après un accouchement prématuré ou une prise en charge en soins intensifs néonataux (Meagher et al., 2010). De même, un effet direct de l’excès d’exposition aux GC sur la microglie a été associé à un phénotype pro-inflammatoire (Gomez-Gonzalez & Escobar, 2010 ; Slusarczyk et al., 2015 ; Hartig et al., 2016 ; Roque et al., 2016). Ces effets peuvent être liés à la régulation épigénétique des récepteurs nucléaires des GC (Sorrells & Sapolsky, 2007 ; Zhang et al., 2013 ; Zhu et al., 2017). Or l’OT est connue pour atténuer l’activation de l’axe HPA et la libération de GC en réponse au stress, tant chez l’Homme que chez le rongeur (Windle et al., 1997, 2004 ; Neumann et al., 2000 ; Jurek et al., 2015 ; Mairesse et al., 2015). Par conséquent, l’OT pourrait jouer un rôle important dans la protection du cerveau en développement en modulant la réactivité des cellules microgliales à une inflammation systémique en lien avec les complications inhérentes à un accouchement prématuré ou un RCIU.
L’ocytocine comme modulateur des fonctions du système nerveux central
Comme nous l’avons rappelé plus haut, l’OT est donc une hormone clé pendant la période périnatale et la parturition où elle est massivement libérée ; de plus, elle module la reconnaissance sociale, les émotions et la parentalité. Au cours de la vie postnatale précoce, elle est impliquée dans la transition excitatrice/inhibitrice du GABA (Tyzio et al., 2006) et l’inhibition de cette transition médiée par l’OT induit des troubles du spectre autistique (TSA) chez l’enfant (Tyzio et al., 2014). Par ailleurs, dans un modèle animal de TSA, il a été démontré que la libération centrale d’OT induite par l’activation chémogénétique des neurones ocytocinergiques du noyau paraventriculaire améliorait le comportement social (Penagarikano et al., 2015). Outre son rôle dans les TSA, l’OT prévient certains troubles comportementaux fréquemment observés en cas de prématurité ou de RCIU, et associés à une neuro-inflammation exacerbée, notamment l’anxiété sociale, la schizophrénie et l’anorexie (Modi & Young, 2012 ; Young & Barrett, 2015 ; Lee et al., 2017 ; Salter & Stevens, 2017 ; Keech et al., 2018).
Par ailleurs, l’OT est une hormone importante pour la régulation du comportement et des soins maternels chez les rats (Pedersen et al., 1982 ; Francis et al., 2000). Chez l’Homme, l’augmentation des taux plasmatiques d’OT entre le premier et le deuxième trimestres de la grossesse est prédictive de l’attachement mère-enfant (Feldman et al., 2010). Or, cette première forme d’interaction sociale est toujours altérée par les soins néonataux après un accouchement prématuré et un RCIU. Le stress en début de vie perturbe le comportement d’attachement (Moriceau et al., 2009) qui, à son tour, affecte le système ocytocinergique endogène lui-même (Alves et al., 2015), conduisant à un risque accru de psychopathologie chez l’adulte (Hammock & Young, 2006 ; Gao et al., 2010) et de déficits cognitifs chez le jeune enfant (Sylva et al., 2011). Dans l’ensemble, ces données soutiennent fortement le rôle de l’OT comme modulateur de plusieurs systèmes en développement perturbés par le stress périnatal.
Relation entre l’ocytocine et l’activation de la microglie
Des études précliniques récentes ont mis en évidence un rôle central de l’OT dans la régulation d’une réponse inflammatoire centrale dans le cerveau mature (Karelina et al., 2011 ; Yuan et al., 2016 ; Amini-Khoei et al., 2017). Dans un modèle murin d’accident vasculaire cérébral chez l’adulte, l’OT endogène induit un effet neuroprotecteur de l’interaction sociale par son action anti-inflammatoire. L’exposition à l’OT réduit l’activation de la microglie et l’expression microgliale des cytokines pro-inflammatoires induites par le lipopolysaccharide (LPS) chez les souris adultes. L’action biologique de l’OT est liée à l’activation de son récepteur (OTR) à sept segments transmembranaires, couplé aux protéines Gq/Gi et exprimé à la fois dans les astrocytes et la microglie. L’exposition des cellules microgliales à un stimulus inflammatoire induit une augmentation de l’expression de l’OTR, ce qui suggère que le système OT est susceptible de jouer un rôle dans la modulation de l’activation microgliale. Les bases moléculaires de l’effet régulateur de l’OT sur la microglie restent mal comprises mais semblent impliquer plusieurs effecteurs de l’OTR, y compris ERK/MAPK, NFκB, le facteur d’élongation eucaryote 2, ou la balance entre le glutamate et le GABA (Pocock & Kettenmann, 2007).
Si plusieurs études ont porté sur le rôle de l’OT dans le cerveau mature, on ne sait que peu de choses sur son rôle dans la régulation de la microglie dans le cerveau en développement. L’interaction entre les neurones ocytocinergiques et la microglie peut être médiée par des projections vers le cortex préfrontal et le cortex cingulaire, également impliqués dans la cognition et les fonctions exécutives (Figure 2).
Dans un modèle de RCIU, nous avons récemment démontré une dysrégulation des gènes contrôlant la neuro-inflammation tôt après la naissance, associée à une trajectoire développementale anormale du cerveau (Rideau Batista Novais et al., 2016). Il a également été constaté que l’expression de l’OT était diminuée dans ce modèle ; de plus, il a été démontré que l’administration systémique de carbétocine, un agoniste sélectif d’OTR, de longue durée d’action et diffusible dans le cerveau, atténuait l’activation microgliale aux niveaux transcriptionnel et morphologique et assurait une neuroprotection à long terme (Mairesse et al., 2019). Ces expériences pharmacologiques suggèrent que le système OT/OTR pourrait être un modulateur clé de l’activité microgliale dans le cerveau en développement.
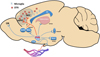 |
Figure 2 Projections des neurones à OT dans les circuits de la récompense, du stress et interactions possibles avec la microglie dans le cerveau des rongeurs. Le PVN et le SON projettent vers l’hypophyse postérieure pour libérer l’OT au niveau périphérique. Les neurones parvocellulaires du PVN projettent également vers les circuits de la récompense (VTA et NAc), les circuits du stress (hippocampe, MeA, et libération intra-PVN), et jusqu’aux bulbes olfactifs (OB) et aux mPFC et ACC, où existe un grand nombre de microglies et qui sont impliqués dans la cognition et les fonctions exécutives. Les projections du mPFC vers le VTA et le NAc sont censées être essentielles au développement cortical et aux interactions sociales. PVN : noyau paraventriculaire ; SON : noyau supra-optique ; ACC : cortex cingulaire antérieur ; mPFC : cortex préfrontal médian ; VTA : aire tegmentaire ventrale ; NAc : noyau accumbens ; MeA : amygdale médiane ; AON : noyau olfactif antérieur ; OB : bulbes olfactifs ; OTR : récepteur de l’ocytocine ; CC : corps calleux. |
Effets modulateurs de l’ocytocine sur le comportement maternel
L’OT est une hormone importante pour la régulation du comportement maternel et l’administration intracérébrale d’OT à des rattes vierges réduit la latence d’installation de ce comportement (Pedersen et al., 1982).
Chez l’Homme, des taux plus élevés d’OT sont observés chez les mères ayant un contact affectueux plus important (Feldman et al., 2010).
Chez l’animal, des résultats similaires ont été rapportés tels que des troubles anxieux et une hyperactivité de l’axe HPA lorsque l’attachement est déficient (Liu et al., 1997, 2000 ; Caldji et al., 1998).
Il existe donc une forte interaction entre l’OT et l’attachement maternel, d’une part, et les effets positifs d’un comportement maternel attentionné/aimant sur le développement neurocomportemental de la progéniture, d’autre part. Ainsi, il est possible de suggérer une interaction fonctionnelle entre l’OT et les soins maternels pouvant aboutir à un effet neuroprotecteur indirect sur l’enfant à risque de handicap ultérieur.
Conclusion
La réduction de l’inflammation systémique et de la neuro-inflammation pourrait représenter une stratégie thérapeutique valable pour le traitement des lésions cérébrales chez les prématurés et/ou de la prévention de leurs conséquences neurodéveloppementales. Dans ce contexte, l’OT pourrait exercer un rôle central grâce à sa capacité à moduler le système immunitaire et les microglies cérébrales vers un phénotype anti-inflammatoire. Cependant, les effets bénéfiques de l’OT ne sont pas seulement liés à son action sur la neuro-inflammation, mais aussi à son action sur le développement de circuits neuronaux. En effet, l’OT joue également un rôle clé dans la régulation du switch GABA et le bon équilibre entre la transmission excitatrice et inhibitrice, dont les altérations peuvent conduire à l’apparition de troubles du développement neurologique. Enfin, l’OT est aussi un important régulateur du comportement maternel dont les altérations en période postnatale sont corrélées à l’apparition de troubles comportementaux et neuroendocriniens ultérieurs.
En conclusion, les données actuelles confortent le rôle de l’OT comme agent neuroprotecteur potentiel dans le cerveau en développement.
Références
- Als, H., Duffy, F.H., McAnulty, G., Butler, S.C., Lightbody, L., Kosta, S., Weisenfeld, N.I., Robertson, R., Parad, R.B., Ringer, S.A., Blickman, J.G., Zurakowski, D., Warfield, S.K. (2012). NIDCAP improves brain function and structure in preterm infants with severe intrauterine growth restriction. J Perinatol, 32, 797-803. [CrossRef] [PubMed] [Google Scholar]
- Alves, E., Fielder, A., Ghabriel, N., Sawyer, M., Buisman-Pijlman, F.T. (2015). Early social environment affects the endogenous oxytocin system: a review and future directions. Front Endocrinol (Lausanne), 6, 32. [CrossRef] [PubMed] [Google Scholar]
- Amini-Khoei, H., Mohammadi-Asl, A., Amiri, S., Hosseini, M.J., Momeny, M., Hassanipour, M., Rastegar, M., Haj-Mirzaian, A., Mirzaian, A.H., Sanjarimoghaddam, H., Mehr, S.E., Dehpour, A.R. (2017). Oxytocin mitigated the depressive-like behaviors of maternal separation stress through modulating mitochondrial function and neuroinflammation. Prog Neuropsychopharmacol Biol Psychiatry, 76, 169-178. [CrossRef] [PubMed] [Google Scholar]
- Ball, G., Aljabar, P., Nongena, P., Kennea, N., Gonzalez-Cinca, N., Falconer, S., Chew, A.T.M., Harper, N., Wurie, J., Rutherford, M.A., Counsell, S.J., Edwards, A.D. (2017). Multimodal image analysis of clinical influences on preterm brain development. Ann Neurol, 82, 233-246. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Barker, D.J., Gluckman, P.D., Godfrey, K.M., Harding, J.E., Owens, J.A., Robinson, J.S. (1993). Fetal nutrition and cardiovascular disease in adult life. Lancet, 341, 938-941. [CrossRef] [PubMed] [Google Scholar]
- Caldji, C., Tannenbaum, B., Sharma, S., Francis, D., Plotsky, P.M., Meaney, M.J. (1998). Maternal care during infancy regulates the development of neural systems mediating the expression of fearfulness in the rat. Proc Natl Acad Sci USA, 95, 5335-5340. [CrossRef] [PubMed] [Google Scholar]
- Cardoso, C., Kingdon, D., Ellenbogen, M.A. (2014). A meta-analytic review of the impact of intranasal oxytocin administration on cortisol concentrations during laboratory tasks: moderation by method and mental health. Psychoneuroendocrinology, 49, 161-170. [CrossRef] [PubMed] [Google Scholar]
- Charpak, N., Tessier, R., Ruiz, J.G., Hernandez, J.T., Uriza, F., Villegas, J., Nadeau, L., Mercier, C., Maheu, F., Marin, J., Cortes, D., Gallego, J.M., Maldonado, D. (2017). Twenty-year follow-up of kangaroo mother care versus traditional care. Pediatrics, 139: e 20162063. [CrossRef] [Google Scholar]
- Chawanpaiboon, S., Vogel, J.P., Moller, A.B., Lumbiganon, P., Petzold, M., Hogan, D., Landoulsi, S., Jampathong, N., Kongwattanakul, K., Laopaiboon, M., Lewis, C., Rattanakanokchai, S., Teng, D.N., Thinkhamrop, J., Watananirun, K., Zhang, J., Zhou, W., Gulmezoglu, A.M. (2019). Global, regional, and national estimates of levels of preterm birth in 2014: a systematic review and modelling analysis. Lancet Glob Health, 7, e37-e46. [CrossRef] [PubMed] [Google Scholar]
- Chhor, V., Le Charpentier, T., Lebon, S., Ore, M.V., Celador, I.L., Josserand, J., Degos, V., Jacotot, E., Hagberg, H., Savman, K., Mallard, C., Gressens, P., Fleiss, B. (2013). Characterization of phenotype markers and neuronotoxic potential of polarised primary microglia in vitro. Brain Behav Immun, 32, 70-85. [CrossRef] [PubMed] [Google Scholar]
- Chikahisa, S., Sei, H., Morishima, M., Sano, A., Kitaoka, K., Nakaya, Y., Morita, Y. (2006). Exposure to music in the perinatal period enhances learning performance and alters BDNF/TrkB signaling in mice as adults. Behav Brain Res, 169, 312-319. [CrossRef] [PubMed] [Google Scholar]
- Cismaru, A.L., Gui, L., Vasung, L., Lejeune, F., Barisnikov, K., Truttmann, A., Borradori Tolsa, C., Huppi, P.S. (2016). Altered amygdala development and fear processing in prematurely born infants. Front Neuroanat, 10, 55. [CrossRef] [PubMed] [Google Scholar]
- Dammann, O., Leviton, A. (2004). Inflammatory brain damage in preterm newborns − dry numbers, wet lab, and causal inferences. Early Hum Dev, 79, 1-15. [CrossRef] [PubMed] [Google Scholar]
- Delobel-Ayoub, M., Arnaud, C., White-Koning, M., Casper, C., Pierrat, V., Garel, M., Burguet, A., Roze, J.C., Matis, J., Picaud, J.C., Kaminski, M., Larroque, B., EPIPAGE Study Group. (2009). Behavioral problems and cognitive performance at 5 years of age after very preterm birth: the EPIPAGE Study. Pediatrics, 123, 1485-1492. [CrossRef] [PubMed] [Google Scholar]
- Feldman, R., Gordon, I., Schneiderman, I., Weisman, O., Zagoory-Sharon, O. (2010). Natural variations in maternal and paternal care are associated with systematic changes in oxytocin following parent-infant contact. Psychoneuroendocrinology, 35, 1133-1141. [CrossRef] [PubMed] [Google Scholar]
- Feldman, R., Weller, A., Zagoory-Sharon, O., Levine, A. (2007). Evidence for a neuroendocrinological foundation of human affiliation: plasma oxytocin levels across pregnancy and the postpartum period predict mother-infant bonding. Psychol Sci, 18, 965-970. [CrossRef] [PubMed] [Google Scholar]
- Fischi-Gomez, E., Vasung, L., Meskaldji, D.E., Lazeyras, F., Borradori-Tolsa, C., Hagmann, P., Barisnikov, K., Thiran, J.P., Huppi, P.S. (2015). Structural brain connectivity in school-age preterm infants provides evidence for impaired networks relevant for higher order cognitive skills and social cognition. Cereb Cortex, 25, 2793-2805. [CrossRef] [PubMed] [Google Scholar]
- Fleiss, B., Gressens, P. (2019). Neuroprotection of the preterm brain. Handb Clin Neurol, 162, 315-328. [CrossRef] [PubMed] [Google Scholar]
- Francis, D.D., Champagne, F.C., Meaney, M.J. (2000). Variations in maternal behaviour are associated with differences in oxytocin receptor levels in the rat. J Neuroendocrinol, 12, 1145-1148. [Google Scholar]
- Fumagalli, M., Lombardi, M., Gressens, P., Verderio, C. (2018). How to reprogram microglia toward beneficial functions. Glia, 66, 2531-2549. [CrossRef] [PubMed] [Google Scholar]
- Gao, Y., Raine, A., Chan, F., Venables, P.H., Mednick, S.A. (2010). Early maternal and paternal bonding, childhood physical abuse and adult psychopathic personality. Psychol Med, 40, 1007-1016. [CrossRef] [PubMed] [Google Scholar]
- Gautier, E.L., Shay, T., Miller, J., Greter, M., Jakubzick, C., Ivanov, S., Helft, J., Chow, A., Elpek, K.G., Gordonov, S., Mazloom, A.R., Ma’ayan, A., Chua, W.J., Hansen, T.H., Turley, S.J., Merad, M., Randolph, G.J., Immunological Genome Consortium. (2012). Gene-expression profiles and transcriptional regulatory pathways that underlie the identity and diversity of mouse tissue macrophages. Nat Immunol, 13, 1118-1128. [CrossRef] [PubMed] [Google Scholar]
- Gomez-Gonzalez, B., Escobar, A. (2010). Prenatal stress alters microglial development and distribution in postnatal rat brain. Acta Neuropathol, 119, 303-315. [CrossRef] [PubMed] [Google Scholar]
- Gui L, Loukas, S., Lazyeras F, Hüppi PS, Meskaldij D.E., Borradori-Tolsa C. (2019). Longitudinal study of neonatal brain tissue volumes in preterm infants and their ability to predict neurodevelopmental outcome. Neuroimage, 185, 728-741. [CrossRef] [PubMed] [Google Scholar]
- Hammock, E.A., Young, L.J. (2006). Oxytocin, vasopressin and pair bonding: implications for autism. Philos Trans R Soc Lond B Biol Sci, 361, 2187-2198. [CrossRef] [PubMed] [Google Scholar]
- Hartig, E.I., Zhu, S., King, B.L., Coffman, J.A. (2016). Cortisol-treated zebrafish embryos develop into pro-inflammatory adults with aberrant immune gene regulation. Biol Open, 5, 1134-1141. [CrossRef] [PubMed] [Google Scholar]
- Heim, C., Nemeroff, C.B. (1999). The impact of early adverse experiences on brain systems involved in the pathophysiology of anxiety and affective disorders. Biol Psychiatry, 46, 1509-1522. [CrossRef] [PubMed] [Google Scholar]
- Hellstrom Erkenstam, N., Smith, P.L., Fleiss, B., Nair, S., Svedin, P., Wang, W., Bostrom, M., Gressens, P., Hagberg, H., Brown, K.L., Savman, K., Mallard, C. (2016). Temporal characterization of microglia/macrophage phenotypes in a mouse model of neonatal hypoxic-ischemic brain injury. Front Cell Neurosci, 10, 286. [CrossRef] [PubMed] [Google Scholar]
- Hellwig, S., Heinrich, A., Biber, K. (2013). The brain’s best friend: microglial neurotoxicity revisited. Front Cell Neurosci, 7, 71. [CrossRef] [PubMed] [Google Scholar]
- Herd, M., Whittingham, K., Sanders, M., Colditz, P., Boyd, R.N. (2014). Efficacy of preventative parenting interventions for parents of preterm infants on later child behavior: a systematic review and meta-analysis. Infant Ment Health J, 35, 630-641. [CrossRef] [PubMed] [Google Scholar]
- Hoogland, I.C., Houbolt, C., van Westerloo, D.J., van Gool, W.A., van de Beek, D. (2015). Systemic inflammation and microglial activation: systematic review of animal experiments. J Neuroinflammation, 12, 114. [CrossRef] [PubMed] [Google Scholar]
- Jurek, B., Slattery, D.A., Hiraoka, Y., Liu, Y., Nishimori, K., Aguilera, G., Neumann, I.D., van den Burg, E.H. (2015). Oxytocin regulates stress-induced Crf gene transcription through CREB-regulated transcription coactivator 3.J Neurosci, 35, 12248-12260. [CrossRef] [PubMed] [Google Scholar]
- Juul, S.E., Comstock, B.A., Wadhawan, R., Mayock, D.E., Courtney, S.E., Robinson, T., Ahmad, K.A., Bendel-Stenzel, E., Baserga, M., LaGamma, E.F., Downey, L.C., Rao, R., Fahim, N., Lampland, A., Frantz Iii, I.D., Khan, J.Y., Weiss, M., Gilmore, M.M., Ohls, R.K., Srinivasan, N., Perez, J.E., McKay, V., Vu, P.T., Lowe, J., Kuban, K., O’Shea, T.M., Hartman, A.L., Heagerty, P.J., PENUT Trial Consortium. (2020). A randomized trial of erythropoietin for neuroprotection in preterm infants. N Engl J Med, 382, 233-243. [CrossRef] [PubMed] [Google Scholar]
- Kalpakidou, A.K., Allin, M.P., Walshe, M., Giampietro, V., McGuire, P.K., Rifkin, L., Murray, R.M., Nosarti, C. (2014). Functional neuroanatomy of executive function after neonatal brain injury in adults who were born very preterm. PLoS One, 9, e113975. [CrossRef] [PubMed] [Google Scholar]
- Karelina, K., Stuller, K.A., Jarrett, B., Zhang, N., Wells, J., Norman, G.J., DeVries, A.C. (2011). Oxytocin mediates social neuroprotection after cerebral ischemia. Stroke, 42, 3606-3611. [CrossRef] [PubMed] [Google Scholar]
- Keech, B., Crowe, S., Hocking, D.R. (2018). Intranasal oxytocin, social cognition and neurodevelopmental disorders: A meta-analysis. Psychoneuroendocrinology, 87, 9-19. [CrossRef] [PubMed] [Google Scholar]
- Langerock, N., van Hanswijck de Jonge, L., BickleGraz, M., Huppi, P.S., Borradori Tolsa, C., Barisnikov, K. (2013). Emotional reactivity at 12 months in very preterm infants born at <29 weeks of gestation. Infant Behav Dev, 36, 289-297. [CrossRef] [PubMed] [Google Scholar]
- Lee, A.S., Azmitia, E.C., Whitaker-Azmitia, P.M. (2017). Developmental microglial priming in postmortem autism spectrum disorder temporal cortex. Brain Behav Immun, 62, 193-202. [CrossRef] [PubMed] [Google Scholar]
- Lejeune, F., Reveillon, M., Monnier, M., Huppi, P.S., Borradori Tolsa, C., Barisnikov, K. (2016). Social reasoning abilities in preterm and full-term children aged 5- 7 years. Early Hum Dev, 103, 49-54. [CrossRef] [PubMed] [Google Scholar]
- Liu, D., Diorio, J., Day, J.C., Francis, D.D., Meaney, M.J. (2000). Maternal care, hippocampal synaptogenesis and cognitive development in rats. Nat Neurosci, 3, 799-806. [CrossRef] [PubMed] [Google Scholar]
- Liu, D., Diorio, J., Tannenbaum, B., Caldji, C., Francis, D., Freedman, A., Sharma, S., Pearson, D., Plotsky, P.M., Meaney, M.J. (1997). Maternal care, hippocampal glucocorticoid receptors, and hypothalamic-pituitary-adrenal responses to stress. Science, 277, 1659-1662. [CrossRef] [PubMed] [Google Scholar]
- Loewy, J., Stewart, K., Dassler, A.M., Telsey, A., Homel, P. (2013). The effects of music therapy on vital signs, feeding, and sleep in premature infants. Pediatrics, 131, 902-918. [CrossRef] [PubMed] [Google Scholar]
- Lordier, L., Loukas, S., Grouiller, F., Vollenweider, A., Vasung, L., Meskaldij, D.E., Lejeune, F., Pittet, M.P., Borradori-Tolsa, C., Lazeyras, F., Grandjean, D., Van De Ville, D., Huppi, P.S. (2019a). Music processing in preterm and full-term newborns: A psychophysiological interaction (PPI) approach in neonatal fMRI. Neuroimage, 185, 857-864. [CrossRef] [PubMed] [Google Scholar]
- Lordier, L., Meskaldji, D.E., Grouiller, F., Pittet, M.P., Vollenweider, A., Vasung, L., Borradori-Tolsa, C., Lazeyras, F., Grandjean, D., Van De Ville, D., Huppi, P.S. (2019b). Music in premature infants enhances high-level cognitive brain networks. Proc Natl Acad Sci USA, 116, 12103-12108. [CrossRef] [PubMed] [Google Scholar]
- Mairesse, J., Gatta, E., Reynaert, M.L., Marrocco, J., Morley-Fletcher, S., Soichot, M., Deruyter, L., Camp, G.V., Bouwalerh, H., Fagioli, F., Pittaluga, A., Allorge, D., Nicoletti, F., Maccari, S. (2015). Activation of presynaptic oxytocin receptors enhances glutamate release in the ventral hippocampus of prenatally restraint stressed rats. Psychoneuroendocrinology, 62, 36-46. [CrossRef] [PubMed] [Google Scholar]
- Mairesse, J., Zinni, M., Pansiot, J., Hassan-Abdi, R., Demene, C., Colella, M., Charriaut-Marlangue, C., Rideau Batista Novais, A., Tanter, M., Maccari, S., Gressens, P., Vaiman, D., Soussi-Yanicostas, N., Baud, O. (2019). Oxytocin receptor agonist reduces perinatal brain damage by targeting microglia. Glia, 67, 345-359. [CrossRef] [PubMed] [Google Scholar]
- Mallard, C., Hagberg, H. (2007). Inflammation-induced preconditioning in the immature brain. Semin Fetal Neonatal Med, 12, 280-286. [CrossRef] [PubMed] [Google Scholar]
- Meagher, M.W., Sieve, A.N., Johnson, R.R., Satterlee, D., Belyavskyi, M., Mi, W., Prentice, T.W., Welsh, T.H., Jr., Welsh, C.J. (2010). Neonatal maternal separation alters immune, endocrine, and behavioral responses to acute Theiler’s virus infection in adult mice. Behav Genet, 40, 233-249. [CrossRef] [PubMed] [Google Scholar]
- Miron, V.E., Boyd, A., Zhao, J.W., Yuen, T.J., Ruckh, J.M., Shadrach, J.L., van Wijngaarden, P., Wagers, A.J., Williams, A., Franklin, R.J.M., Ffrench-Constant, C. (2013). M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination. Nat Neurosci, 16, 1211-1218. [CrossRef] [PubMed] [Google Scholar]
- Modi, M.E., Young, L.J. (2012). The oxytocin system in drug discovery for autism: animal models and novel therapeutic strategies. Horm Behav, 61, 340-350. [CrossRef] [PubMed] [Google Scholar]
- Moriceau, S., Shionoya, K., Jakubs, K., Sullivan, R.M. (2009). Early-life stress disrupts attachment learning: the role of amygdala corticosterone, locus ceruleus corticotropin releasing hormone, and olfactory bulb norepinephrine. J Neurosci, 29, 15745-15755. [CrossRef] [PubMed] [Google Scholar]
- Munoz-Moreno, E., Fischi-Gomez, E., Batalle, D., Borradori-Tolsa, C., Eixarch, E., Thiran, J.P., Gratacos, E., Huppi, P.S. (2016). Structural brain network reorganization and social cognition related to adverse perinatal condition from infancy to early adolescence. Front Neurosci, 10, 560. [CrossRef] [PubMed] [Google Scholar]
- Natalucci, G., Latal, B., Koller, B., Ruegger, C., Sick, B., Held, L., Bucher, H.U., Fauchere, J.C., Swiss EPO Neuroprotection Trial Group. (2016). Effect of early prophylactic high-dose recombinant human erythropoietin in very preterm infants on neurodevelopmental outcome at 2 years: A randomized clinical trial. JAMA, 315, 2079-2085. [CrossRef] [PubMed] [Google Scholar]
- Neumann, I.D., Wigger, A., Torner, L., Holsboer, F., Landgraf, R. (2000). Brain oxytocin inhibits basal and stress-induced activity of the hypothalamo-pituitary-adrenal axis in male and female rats: partial action within the paraventricular nucleus. J Neuroendocrinol, 12, 235-243. [Google Scholar]
- Ooishi, Y., Mukai, H., Watanabe, K., Kawato, S., Kashino, M. (2017). Increase in salivary oxytocin and decrease in salivary cortisol after listening to relaxing slow-tempo and exciting fast-tempo music. PLoS One, 12, e 0189075. [Google Scholar]
- Pansiot, J., Pham, H., Dalous, J., Chevenne, D., Colella, M., Schwendimann, L., Fafouri, A., Mairesse, J., Moretti, R., Schang, A.L., Charriaut-Marlangue, C., Gressens, P., Baud, O. (2016). Glial response to 17beta-estradiol in neonatal rats with excitotoxic brain injury. Exp Neurol, 282, 56-65. [CrossRef] [PubMed] [Google Scholar]
- Pedersen, C.A., Ascher, J.A., Monroe, Y.L., Prange, A.J., Jr. (1982). Oxytocin induces maternal behavior in virgin female rats. Science, 216, 648-650. [CrossRef] [PubMed] [Google Scholar]
- Penagarikano, O., Lazaro, M.T., Lu, X.H., Gordon, A., Dong, H., Lam, H.A., Peles, E., Maidment, N.T., Murphy, N.P., Yang, X.W., Golshani, P., Geschwind, D.H. (2015). Exogenous and evoked oxytocin restores social behavior in the Cntnap2 mouse model of autism. Sci Transl Med, 7, 271-278. [CrossRef] [Google Scholar]
- Pineda, R., Wallendorf, M., Smith, J. (2020). A pilot study demonstrating the impact of the supporting and enhancing NICU sensory experiences (SENSE) program on the mother and infant. Early Hum Dev, 144, 105000. [CrossRef] [PubMed] [Google Scholar]
- Pocock, J.M., Kettenmann, H. (2007). Neurotransmitter receptors on microglia. Trends Neurosci, 30, 527-535. [CrossRef] [PubMed] [Google Scholar]
- Pont-Lezica, L., Bechade, C., Belarif-Cantaut, Y., Pascual, O., Bessis, A. (2011). Physiological roles of microglia during development. J Neurochem, 119, 901-908. [CrossRef] [PubMed] [Google Scholar]
- Rajamani, K.T., Wagner, S., Grinevich, V., Harony-Nicolas, H. (2018). Oxytocin as a modulator of synaptic plasticity: implications for neurodevelopmental disorders. Front Synaptic Neurosci, 10, 17. [CrossRef] [PubMed] [Google Scholar]
- Reveillon, M., Borradori Tolsa, C., Monnier, M., Huppi, P.S., Barisnikov, K. (2016). Response inhibition difficulties in preterm children aged 9-12 years: Relations with emotion and behavior. Child Neuropsychol, 22, 420-442. [CrossRef] [PubMed] [Google Scholar]
- Rideau Batista Novais, A., Pham, H., Van de Looij, Y., Bernal, M., Mairesse, J., Zana-Taieb, E., Colella, M., Jarreau, P.H., Pansiot, J., Dumont, F., Sizonenko, S., Gressens, P., Charriaut-Marlangue, C., Tanter, M., Demene, C., Vaiman, D., Baud, O. (2016). Transcriptomic regulations in oligodendroglial and microglial cells related to brain damage following fetal growth restriction. Glia, 64, 2306-2320. [CrossRef] [PubMed] [Google Scholar]
- Rivest, S. (2009). Regulation of innate immune responses in the brain. Nat Rev Immunol, 9, 429-439. [CrossRef] [PubMed] [Google Scholar]
- Robertson, N.J., Faulkner, S., Fleiss, B., Bainbridge, A., Andorka, C., Price, D., Powell, E., Lecky-Thompson, L., Thei, L., Chandrasekaran, M., Hristova, M., Cady, E.B., Gressens, P., Golay, X., Raivich, G. (2013). Melatonin augments hypothermic neuroprotection in a perinatal asphyxia model. Brain, 136, 90-105. [CrossRef] [PubMed] [Google Scholar]
- Ropars, S., Tessier, R., Charpak, N., Uriza, L.F. (2018). The long-term effects of the Kangaroo Mother Care intervention on cognitive functioning: Results from a longitudinal study. Dev Neuropsychol, 43, 82-91. [CrossRef] [PubMed] [Google Scholar]
- Roque, A., Ochoa-Zarzosa, A., Torner, L. (2016). Maternal separation activates microglial cells and induces an inflammatory response in the hippocampus of male rat pups, independently of hypothalamic and peripheral cytokine levels. Brain Behav Immun, 55, 39-48. [CrossRef] [PubMed] [Google Scholar]
- Ruegger, C.M., Davis, P.G., Cheong, J.L. (2018). Xenon as an adjuvant to therapeutic hypothermia in near-term and term newborns with hypoxic-ischaemic encephalopathy. Cochrane Database Syst Rev, 8, CD012753. [PubMed] [Google Scholar]
- Salter, M.W., Stevens, B. (2017). Microglia emerge as central players in brain disease. Nat Med, 23, 1018-1027. [CrossRef] [PubMed] [Google Scholar]
- Seckl, J.R. (1998). Physiologic programming of the fetus. Clin Perinatol, 25, 939-962. [CrossRef] [PubMed] [Google Scholar]
- Shepherd, E., Salam, R.A., Middleton, P., Makrides, M., McIntyre, S., Badawi, N., Crowther, C.A. (2017). Antenatal and intrapartum interventions for preventing cerebral palsy: an overview of Cochrane systematic reviews. Cochrane Database Syst Rev, 8, CD012077. [PubMed] [Google Scholar]
- Slusarczyk, J., Trojan, E., Glombik, K., Budziszewska, B., Kubera, M., Lason, W., Popiolek-Barczyk, K., Mika, J., Wedzony, K., Basta-Kaim, A. (2015). Prenatal stress is a vulnerability factor for altered morphology and biological activity of microglia cells. Front Cell Neurosci, 9, 82. [CrossRef] [PubMed] [Google Scholar]
- Sorrells, S.F., Sapolsky, R.M. (2007). An inflammatory review of glucocorticoid actions in the CNS. Brain Behav Immun, 21, 259-272. [CrossRef] [PubMed] [Google Scholar]
- Sylva, K., Stein, A., Leach, P., Barnes, J., Malmberg, L.E., the FCCC-team. (2011). Effects of early child-care on cognition, language, and task-related behaviours at 18 months: an English study. Br J Dev Psychol, 29, 18-45. [CrossRef] [PubMed] [Google Scholar]
- Theofanopoulou, C., Boeckx, C., Jarvis, E.D. (2017). A hypothesis on a role of oxytocin in the social mechanisms of speech and vocal learning. Proc R Soc Biol B, 284, 20170988. [CrossRef] [PubMed] [Google Scholar]
- Tops, M. (2010). Oxytocin: envy or engagement in others? Biol Psychiatry, 67, e5-e6. [CrossRef] [PubMed] [Google Scholar]
- Twilhaar, E.S., Wade, R.M., de Kieviet, J.F., van Goudoever, J.B., van Elburg, R.M., Oosterlaan, J. (2018). Cognitive outcomes of children born extremely or very preterm since the 1990s and associated risk factors: A meta-analysis and meta-regression. JAMA Pediatr, 172, 361-367. [CrossRef] [PubMed] [Google Scholar]
- Tyzio, R., Cossart, R., Khalilov, I., Minlebaev, M., Hubner, C.A., Represa, A., Ben-Ari, Y., Khazipov, R. (2006). Maternal oxytocin triggers a transient inhibitory switch in GABA signaling in the fetal brain during delivery. Science, 314, 1788-1792. [CrossRef] [PubMed] [Google Scholar]
- Tyzio, R., Nardou, R., Ferrari, D.C., Tsintsadze, T., Shahrokhi, A., Eftekhari, S., Khalilov, I., Tsintsadze, V., Brouchoud, C., Chazal, G., Lemonnier, E., Lozovaya, N., Burnashev, N., Ben-Ari, Y. (2014). Oxytocin-mediated GABA inhibition during delivery attenuates autism pathogenesis in rodent offspring. Science, 343, 675-679. [CrossRef] [PubMed] [Google Scholar]
- Urben, S., Van Hanswijck De Jonge, L., Barisnikov, K., Pizzo, R., Monnier, M., Lazeyras, F., Borradori Tolsa, C., Huppi, P.S. (2017). Gestational age and gender influence on executive control and its related neural structures in preterm-born children at 6 years of age. Child Neuropsychol, 23, 188-207. [CrossRef] [PubMed] [Google Scholar]
- Volpe, J.J. (2008). Postnatal sepsis, necrotizing entercolitis, and the critical role of systemic inflammation in white matter injury in premature infants. J Pediatr, 153, 160-163. [CrossRef] [PubMed] [Google Scholar]
- Volpe, J.J. (2011). Systemic inflammation, oligodendroglial maturation, and the encephalopathy of prematurity. Ann Neurol, 70, 525-529. [CrossRef] [PubMed] [Google Scholar]
- Windle, R.J., Kershaw, Y.M., Shanks, N., Wood, S.A., Lightman, S.L., Ingram, C.D. (2004). Oxytocin attenuates stress-induced c-fos mRNA expression in specific forebrain regions associated with modulation of hypothalamo-pituitary-adrenal activity. J Neurosci, 24, 2974-2982. [CrossRef] [PubMed] [Google Scholar]
- Windle, R.J., Shanks, N., Lightman, S.L., Ingram, C.D. (1997). Central oxytocin administration reduces stress-induced corticosterone release and anxiety behavior in rats. Endocrinology, 138, 2829-2834. [CrossRef] [PubMed] [Google Scholar]
- Witt, A., Theurel, A., Tolsa, C.B., Lejeune, F., Fernandes, L., de Jonge, L., Monnier, M., Bickle Graz, M., Barisnikov, K., Gentaz, E., Huppi, P.S. (2014). Emotional and effortful control abilities in 42-month-old very preterm and full-term children. Early Hum Dev, 90, 565-569. [CrossRef] [PubMed] [Google Scholar]
- Wu, H.C., Shen, C.M., Wu, Y.Y., Yuh, Y.S., Kua, K.E. (2009). Subclinical histologic chorioamnionitis and related clinical and laboratory parameters in preterm deliveries. Pediatr Neonatol, 50, 217-221. [CrossRef] [PubMed] [Google Scholar]
- Young, L.J., Barrett, C.E. (2015). Neuroscience. Can oxytocin treat autism? Science, 347, 825-826. [CrossRef] [PubMed] [Google Scholar]
- Yuan, L., Liu, S., Bai, X., Gao, Y., Liu, G., Wang, X., Liu, D., Li, T., Hao, A., Wang, Z. (2016). Oxytocin inhibits lipopolysaccharide-induced inflammation in microglial cells and attenuates microglial activation in lipopolysaccharide-treated mice. J Neuroinflammation, 13, 77. [CrossRef] [PubMed] [Google Scholar]
- Zeitlin, J., Mohangoo, A.D., Delnord, M., Cuttini, M., EURO-PERISTAT Scientific Committee. (2013). The second European Perinatal Health Report: documenting changes over 6 years in the health of mothers and babies in Europe. J Epidemiol Community Health, 67, 983-985. [CrossRef] [PubMed] [Google Scholar]
- Zhang, T.Y., Labonte, B., Wen, X.L., Turecki, G., Meaney, M.J. (2013). Epigenetic mechanisms for the early environmental regulation of hippocampal glucocorticoid receptor gene expression in rodents and humans. Neuropsychopharmacology, 38, 111-123. [CrossRef] [PubMed] [Google Scholar]
- Zhu, Y., Wang, Y., Yao, R., Hao, T., Cao, J., Huang, H., Wang, L., Wu, Y. (2017). Enhanced neuroinflammation mediated by DNA methylation of the glucocorticoid receptor triggers cognitive dysfunction after sevoflurane anesthesia in adult rats subjected to maternal separation during the neonatal period. J Neuroinflammation, 14, 6. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Baud, O., Knoop, M., Jacquens, A., et Possovre, M.-L. (2022). Ocytocine : une nouvelle cible de neuroprotection ? Biologie Aujourd’hui, 216, 145-153
Liste des figures
 |
Figure 1 Rôle des cellules microgliales dans le développement des lésions cérébrales néonatales et leurs conséquences à long terme. |
| Dans le texte | |
 |
Figure 2 Projections des neurones à OT dans les circuits de la récompense, du stress et interactions possibles avec la microglie dans le cerveau des rongeurs. Le PVN et le SON projettent vers l’hypophyse postérieure pour libérer l’OT au niveau périphérique. Les neurones parvocellulaires du PVN projettent également vers les circuits de la récompense (VTA et NAc), les circuits du stress (hippocampe, MeA, et libération intra-PVN), et jusqu’aux bulbes olfactifs (OB) et aux mPFC et ACC, où existe un grand nombre de microglies et qui sont impliqués dans la cognition et les fonctions exécutives. Les projections du mPFC vers le VTA et le NAc sont censées être essentielles au développement cortical et aux interactions sociales. PVN : noyau paraventriculaire ; SON : noyau supra-optique ; ACC : cortex cingulaire antérieur ; mPFC : cortex préfrontal médian ; VTA : aire tegmentaire ventrale ; NAc : noyau accumbens ; MeA : amygdale médiane ; AON : noyau olfactif antérieur ; OB : bulbes olfactifs ; OTR : récepteur de l’ocytocine ; CC : corps calleux. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


