| Numéro |
Biologie Aujourd’hui
Volume 216, Numéro 3-4, 2022
|
|
|---|---|---|
| Page(s) | 155 - 165 | |
| DOI | https://doi.org/10.1051/jbio/2022022 | |
| Publié en ligne | 6 février 2023 | |
Article
Rôle émergent des astrocytes dans le contrôle des circuits neuronaux et des fonctions cérébrales modulés par l’ocytocine
Emergent role of astrocytes in oxytocin-mediated modulatory control of neuronal circuits and brain functions
Centre National de la Recherche Scientifique et Université de Strasbourg, Institut des Neurosciences Cellulaires et Intégratives, 8 allée du Général Rouvillois, 67000 Strasbourg, France
* Auteur correspondant : acharlet@unistra.fr
Reçu :
22
Septembre
2022
L’ocytocine est un neuropeptide au centre de l’attention des scientifiques depuis des décennies, en raison de ses effets puissants et pléiotropes tant sur le plan physiologique que sur l’activité des circuits neuronaux, modulant ainsi nos comportements. Jusqu’à une date récente, on pensait que l’action de l’ocytocine était induite exclusivement par l’activation directe de ses récepteurs neuronaux. Cependant, plusieurs études ont démontré l’existence et la pertinence fonctionnelle des récepteurs astrogliaux de l’ocytocine dans diverses régions du cerveau de la souris et du rat. La signalisation et l’activité astrocytaires sont essentielles à de nombreux processus physiologiques importants, notamment le métabolisme, l’élimination des neurotransmetteurs de la fente synaptique et les fonctions cérébrales intégrées. Bien que l’on puisse supposer que l’action de l’ocytocine sur les astrocytes facilite principalement la neuromodulation via la libération de gliotransmetteurs, le rôle précis des récepteurs astrocytaires de l’ocytocine reste difficile à cerner. Dans cette revue, nous discutons des dernières études sur l’interaction entre le système ocytocinergique et les astrocytes, et décrivons les cascades intracellulaires mises en jeu.
Abstract
The neuropeptide oxytocin has been in the focus of scientists for decades due to its profound and pleiotropic effects on physiology, activity of neuronal circuits and behaviors. Until recently, it was believed that oxytocinergic action exclusively occurs through direct activation of neuronal oxytocin receptors. However, several studies demonstrated the existence and functional relevance of astroglial oxytocin receptors in various brain regions in the mouse and rat brain. Astrocytic signaling and activity are critical for many important physiological processes including metabolism, neurotransmitter clearance from the synaptic cleft and integrated brain functions. While it can be speculated that oxytocinergic action on astrocytes predominantly facilitates neuromodulation via the release of gliotransmitters, the precise role of astrocytic oxytocin receptors remains elusive. In this review, we discuss the latest studies on the interaction between the oxytocinergic system and astrocytes, and give details of underlying intracellular cascades.
Mots clés : ocytocine / astrocytes / amygdale / hypothalamus
Key words: oxytocin / astrocytes / amygdala / hypothalamus
© Société de Biologie, 2023
Abréviations
AMPAR : Récepteur de l’acide α-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique
AMPc : Adénosine monophosphate cyclique
CeL : Amygdale centrale latérale
ERK 1/2 : Kinases 1/2 régulées par les signaux extracellulaires
GAT : Transporteur du GABA (acide γ-aminobutyrique)
GFAP : Protéine acide fibrillaire gliale
GLT-1 : Transporteur 1 du glutamate
GnRH : Hormone de libération des gonadotropines
LTP : Potentialisation à long terme
mGluR : Récepteur métabotropique du glutamate
MAPK : Protéine kinase activée par les signaux mitogènes
NMDAR : Récepteur du glutamate liant le N-méthyl D-aspartate
OTR : Récepteur de l’ocytocine
P2X : Récepteur canal de l’ATP
RCPG : Récepteurs couplés aux protéines G
Introduction
L’ocytocine (OT), un neuropeptide hypothalamique, est au centre de l’attention des chercheurs depuis sa première description par Sir Henry H. Dale (Dale, 1906). En raison de ses effets prosociaux et de renforcement de la confiance, la presse populaire a même inventé le terme d’hormone de l’amour. L’OT est impliquée dans une pléthore de fonctions, tout particulièrement le contrôle des interactions sociales et des processus émotionnels (Lee et al., 2009), et joue un rôle central dans la formation de couples (Young & Wang, 2004) et l’attachement entre les individus (Insel & Young, 2001). Les données actuelles suggèrent que l’OT est apparue il y a environ 600 millions d’années (Gwee et al., 2009) et a évolué avec son peptide frère, l’arginine-vasopressine (AVP), à partir d’un peptide ancêtre commun, la vasotocine (VT) (Gwee et al., 2009 ; Theofanopoulou et al., 2021). Sa fonction était alors la régulation de l’osmolarité, l’un des paramètres cruciaux de l’homéostasie. On suppose qu’au fil du temps, le gène de la vasotocine s’est dupliqué et a donné naissance à deux neuropeptides distincts aux propriétés et fonctions physiologiques différentes. Alors que la première lignée évolutive mène à l’AVP, que l’on trouve chez tous les vertébrés et qui est toujours critique pour l’osmorégulation et le contrôle de la pression sanguine, la voie alternative est à l’origine des peptides de type ocytocine dont les structures varient en fonction des espèces : l’isotocine se retrouve chez les poissons, la mésotocine est présente chez les amphibiens et les reptiles, et l’OT est synthétisée chez tous les mammifères (Gimpl & Fahrenholz, 2001 ; Jurek & Neumann, 2018 ; Theofanopoulou et al., 2021). Il a récemment été proposé de standardiser la nomenclature de ces deux peptides à travers les espèces en OT pour tous les peptides de type ocytocine et VT pour tous ceux de type AVP (Theofanopoulou et al., 2021).
Chez les mammifères, le gène codant l’OT (Oxt) est transcrit dans l’hypothalamus, où son ARNm y est l’un des ARNm spécifiques les plus abondants (Gautvik et al., 1996 ; Gimpl & Fahrenholz, 2001). Comme c’est le cas pour de nombreux autres peptides, l’ARNm de l’OT est traduit en un précurseur inactif, qui est ensuite clivé en fragments plus petits, pour finalement donner le peptide actif. Après sa synthèse, l’OT est stockée dans de grandes vésicules à cœur dense (Leng & Ludwig, 2008), libérée via une exocytose dépendante du calcium (Leng & Ludwig, 2008 ; Tobin et al., 2012 ; Ludwig & Stern, 2015 ; Maicas-Royo et al., 2018) et agit sur le récepteur de l’ocytocine (OTR) couplé aux protéines G (Jurek & Neumann, 2018). À ce jour, deux cascades de signalisation intracellulaires distinctes ont été identifiées après l’activation de l’OTR : les voies Gαi/o- et Gαq-dépendantes (Jurek & Neumann, 2018).
Différents modes de libération de l’OT dans le système nerveux central ont été décrits, notamment la libération axonale (Knobloch et al., 2012 ; Eliava et al., 2016 ; Grinevich et al., 2016 ; Hasan et al., 2019), la libération somato-dendritique (Ludwig & Leng, 2006) et la libération en passant (Ludwig & Leng, 2006 ; Fuxe et al., 2012 ; Bakos et al., 2018). L’OT est également libérée dans la circulation sanguine par la neurohypophyse. La libération ciblée et locale de l’OT au sein de différentes régions du cerveau qui expriment l’OTR permet au peptide d’agir à la fois comme un neurotransmetteur (Buijs, 1983 ; Landgraf & Neumann, 2004 ; Leng & Ludwig, 2008 ; Stoop, 2012 ; Althammer et al., 2021) et comme un neuromodulateur (Stoop, 2012 ; Owen et al., 2013 ; Mitre et al., 2018 ; Tirko et al., 2018), affectant ainsi un large éventail de comportements (Grinevich & Neumann, 2020 ; Froemke & Young, 2021). Jusqu’alors, les recherches sur l’OT étaient uniquement axées sur ses effets directs sur les circuits neuronaux. Par conséquent, selon l’hypothèse dominante, les actions de l’OT devaient être exclusivement médiées par les neurones et ce point de vue a prévalu jusqu’à une date récente (Wahis et al., 2021). En réalité, un nombre croissant de preuves suggère que l’OT agit également directement sur des cellules non neuronales (Wang & Hatton, 2009 ; Tasker et al., 2012 ; Havranek et al., 2017 ; Mairesse et al., 2019).
Les cellules neuronales et gliales existent dans un rapport global 1:1 dans le cerveau humain, mais des variations de ce rapport s’observent d’une région cérébrale à une autre, et des proportions différentes de ces deux populations cellulaires ont été rapportées chez d’autres espèces (von Bartheld et al., 2016). Les cellules gliales sont composées de plusieurs types, dont les astrocytes, les microglies et les oligodendrocytes. Par définition, elles sont non excitables électriquement. Ainsi, pendant longtemps, on a cru qu’elles étaient simplement des cellules passives et qu’elles ne participaient pas activement au traitement de l’information et à la transduction du signal au sein du cerveau. Si, à notre connaissance, il n’existe actuellement aucune preuve suggérant une action de l’OT sur les oligodendrocytes, en revanche il a été démontré qu’elle influence l’activité de la microglie (Inoue et al., 2019 ; Panaro et al., 2020), la différenciation des progéniteurs neuraux (Palanisamy et al., 2018) et la stellation des pituicytes (Rosso et al., 2002). De surcroît, il existe de plus en plus de données démontrant une action de l’OT sur les astrocytes (Di Scala-Guénot et al., 1994 ; Panatier et al., 2006 ; Wahis et al., 2021).
Les astrocytes jouent un rôle primordial dans l’homéostasie, l’approvisionnement en nutriments et le métabolisme du cerveau. Ils représentent environ 20 à 40 % de toutes les cellules gliales, selon l’espèce et la région du cerveau (Augusto-Oliveira et al., 2020). Au cours des deux dernières décennies, les astrocytes sont devenus des acteurs clés de la neuromodulation et de la neuroinflammation, tant dans le cerveau sain que dans le cerveau malade. La façon dont les astrocytes interviennent dans le fonctionnement des circuits neuronaux est particulièrement intrigante. Les neurones et les astrocytes sont fondamentalement différents dans leur morphologie et leur cinétique d’activité : les neurones sont polarisés fonctionnellement et ont des dendrites et des axones permettant la formation de projections à longue distance, tandis que les astrocytes possèdent une myriade de minuscules excroissances membranaires leur permettant de s’infiltrer dans leur environnement et de répondre à de nombreux signaux. De plus, les neurones ont une activité électrique de l’ordre de la milliseconde, tandis que la durée des évènements calciques astrocytaires peut aller de quelques minutes à plusieurs heures (Bazargani & Attwell, 2016). Cette différence de dynamique temporelle drastique entre les deux types de cellules pourrait affecter la façon dont les différents neuromodulateurs opèrent au sein des microcircuits. Ainsi, il est impératif de comprendre comment les neurones et les cellules gliales interagissent en réponse aux neuromodulateurs pour déchiffrer complètement leurs rôles respectifs dans le fonctionnement du cerveau. Dans cette revue, nous résumons la littérature actuelle sur l’action de l’OT sur les astrocytes, et nous proposons de nouveaux modèles qui pourraient expliquer l’implication astrocytaire dans des pathologies associées à des dysfonctionnements du système ocytocinergique.
Effets de l’ocytocine sur les astrocytes
Le récepteur de l’ocytocine est exprimé par les astrocytes
Dans le cerveau, l’OT est principalement synthétisée au sein de trois structures hypothalamiques distinctes : le noyau paraventriculaire, le noyau supraoptique (SON) et les noyaux accessoires. L’une des caractéristiques des neurones OTergiques est la libération somato-dendritique. Au milieu des années 1980, il a été démontré qu’après une sécrétion/infusion d’une quantité importante d’OT dans l’hypothalamus, des modifications de la morphologie des astrocytes s’y produisent in vivo (Salm et al., 1985 ; Theodosis et al., 1986a, b). Cette observation a conduit Di Scala-Guénot & Strosser (1992) à réaliser des études de liaison pour déterminer si les astrocytes hypothalamiques en culture expriment l’OTR. L’utilisation de ligands radiomarqués leur a permis de démontrer que l’OTR est distribué au niveau du soma et des prolongements de cellules morphologiquement similaires à celles exprimant la protéine acide fibrillaire gliale (GFAP), suggérant leur identité astrocytaire. De plus, en utilisant les mêmes méthodes, des OTR ont été révélés dans des cellules exprimant la GFAP au sein de cultures primaires d’astrocytes spinaux (Evrard et al., 1997). En utilisant l’hybridation in situ ou l’immunomarquage, des études récentes ont détecté l’expression des OTR dans les astrocytes de rongeurs au niveau du SON (Wang & Hatton, 2006), du cortex auditif (Mitre et al., 2016), de l’amygdale centrale (Wahis et al., 2021), du striatum ventral (Amato et al., 2022), de l’hippocampe (Althammer et al., 2022b) et même du cortex frontal humain (McKay et al., 2019). En outre, l’OTR peut être co-immunoprécipité avec la GFAP dans des lysats de SON, ce qui indique que le récepteur est lié au cytosquelette astrocytaire (Wang et al., 2017). Si chacun de ces résultats souffre d’une limitation technique inhérente à l’approche utilisée, invitant à la prudence dans l’interprétation des données présentées, leur convergence laisse à penser que l’OTR est effectivement exprimé dans les astrocytes de plusieurs structures cérébrales.
Il faut noter ici que, bien que l’expression de l’OTR dans les neurones soit observée chez une myriade d’espèces et dans de nombreuses régions du cerveau (Gould & Zingg, 2003 ; Mitre et al., 2016 ; Newmaster et al., 2020 ; Young & Song, 2020), les études réalisées jusqu’à présent n’ont pas quantifié les niveaux d’expression réels de l’OTR dans les neurones. À notre connaissance, aucune étude publiée n’a encore évalué et comparé directement les niveaux d’expression d’OTR neuronaux et astrocytaires ; en cause, l’absence d’une approche quantitative et fiable pour la mesure de l’expression de l’OTR, par immunofluorescence par exemple. Cependant, de récentes données d’hybridation in situ de l’ARNm de l’OTR suggèrent que les niveaux d’OTR pourraient être 2 à 3 fois plus faibles dans les astrocytes que dans les neurones au niveau de l’amygdale (Wahis et al., 2021 ; Althammer et al., 2022a) et de la région dorsale CA2 (Althammer et al., 2022b).
Les récepteurs ocytocinergiques astrocytaires sont fonctionnels
La première indication d’une action directe de l’OT sur les cellules gliales remonte au milieu des années 1990, lorsque Di Scala-Guénot et al. (1994) ont réalisé de l’imagerie du calcium intracellulaire sur des astrocytes hypothalamiques en culture. Ils ont observé que l’application d’OT ou de [Thr4Gly7]-ocytocine (TGOT, un agoniste sélectif de l’OTR) déclenche des réponses calciques monophasiques dans la majorité des astrocytes enregistrés, mais aussi des oscillations calciques dans ∼ 15 % d’entre eux (Di Scala-Guénot et al., 1994). Ces observations sur des astrocytes in vitro suggèrent que ces cellules réagissent directement à l’OT. Cependant, il convient de rappeler que les astrocytes cultivés sont connus pour être très différents de ceux trouvés in situ, à la fois en termes de morphologie, d’expression protéique et de signalisation calcique (Shigetomi et al., 2010a, b ; Foo et al., 2011).
Plus récemment, il a été démontré que la libération d’OT évoquée par optogénétique à partir de terminaisons axonales dans l’amygdale centrale déclenche des évènements calciques dans les astrocytes ex vivo (Wahis et al., 2021). Cela suggère fortement que la libération endogène d’OT est suffisante pour induire une signalisation calcique dans les astrocytes. Pourtant, cet effet pourrait résulter indirectement de l’activation de l’OTR sur les neurones voisins. En utilisant une approche Cre/Lox, les auteurs ont éliminé l’OTR dans les cellules exprimant la GFAP et observé une diminution des réponses calciques induites par l’activation de l’OTR dans les astrocytes. Malgré le problème potentiel concernant une putative fuite de Cre des cellules GFAP positives (Hu et al., 2020 ; Stifter & Greter, 2020), cette observation corrobore l’hypothèse selon laquelle l’activité astrocytaire médiée par l’OTR pourrait dépendre de l’activation de ce récepteur sur les astrocytes (Wahis et al., 2021). Cependant, même si ce modèle GFAP-OTR KO met en évidence l’implication de l’OTR dans l’activité astrocytaire, il n’exclut pas la participation potentielle d’un neurotransmetteur co-libéré avec l’OT à partir des terminaisons axonales OTergiques.
Sur la base de ces observations, il semble plausible que des OTR fonctionnels puissent être exprimés dans les astrocytes de plusieurs régions du système nerveux central. Pour bien comprendre comment l’OT agit sur les astrocytes, il est important d’examiner de près la voie intracellulaire déclenchée par la liaison de l’OT à l’OTR astrocytaire.
Signalisation intracellulaire recrutée par le récepteur ocytocinergique astrocytaire
L’OTR est un membre de la famille des récepteurs à sept domaines transmembranaires, couplés aux protéines G (RCPG), de classe A. Chez les mammifères, l’OTR est codé par un seul gène, cependant, son couplage intracellulaire est complexe. Les boucles intracellulaires et le domaine C-terminal intracellulaire relient le récepteur aux complexes de protéines G hétérotrimériques. Chacun d’entre eux est composé de trois sous-unités : Gα, Gβ, Gγ. Lors de la liaison de l’agoniste, des changements conformationnels du récepteur conduisent au remplacement de la guanine diphosphatée liée à la sous-unité Gα par une guanine triphosphatée. La sous-unité Gα se dissocie alors du complexe Gβγ et agit sur diverses enzymes qui produisent des seconds messagers. Comme l’OTR est fonctionnellement couplé aux protéines Gαq et/ou Gαi/o, son activation peut produire une signalisation calcique à partir des réserves de calcium intracellulaire (Phaneuf et al., 1993 ; Gimpl & Fahrenholz, 2001 ; Busnelli & Chini, 2018 ; Jurek & Neumann, 2018). Outre cet effet, l’activation de l’OTR peut contrôler diverses voies intracellulaires, notamment celles dépendantes de l’AMPc, de la phospholipase C (PLC) et de la protéine kinase C (PKC) (Chatterjee et al., 2016). De plus, l’application d’OT sur des tranches de SON augmente la phosphorylation des kinases 1/2 régulées par les signaux extracellulaires (ERK1/2), renforçant l’hypothèse selon laquelle l’activation de l’OTR affecte la voie MAPK dans les astrocytes (Wang & Hatton, 2007). Wang et al. (2017) ont en outre montré que l’OT diminue l’expression de la GFAP dans les astrocytes du SON, un effet qui semble médié par les sous-unités Gβγ des protéines G couplées à l’OTR et l’activation séquentielle de ERK1/2 et de la protéine kinase A (PKA) (Wang et al., 2017). Il convient de noter que l’activation de ERK1/2 et de la PKA semble avoir des effets antagonistes sur la stabilité de la GFAP, la PKA provoquant d’abord la dégradation des filaments de GFAP et ERK1/2 stabilisant ensuite les filaments nouvellement synthétisés (Wang et al., 2017). Récemment, une étude menée sur des cellules provenant d’un astrocytome et semblables à des astrocytes a montré que l’ablation de l’OTR empêchait la phosphorylation de ERK1/2 induite par l’OT et interférait avec la prolifération et les effets antioxydants de l’activation de l’OTR (Alanazi et al., 2020), soutenant ainsi l’idée d’une régulation de la voie MAPK médiée par l’OTR.
Comme mentionné précédemment, l’OTR peut également se coupler aux protéines Gαi/o (Phaneuf et al., 1993 ; Strakova et al., 1998 ; Hoare et al., 1999 ; Busnelli et al., 2012 ; Busnelli & Chini, 2018) mais, à notre connaissance, ceci n’a encore jamais été démontré dans les astrocytes. Il est possible que l’OTR puisse être couplé à différentes protéines G dans un même type cellulaire comme cela a été rapporté pour les neurones (Gravati et al., 2010). Ce couplage pourrait également dépendre de la localisation de l’OTR dans différents microdomaines de la membrane plasmique (Rimoldi et al., 2003).
Modulation de la morphologie et des fonctions astrocytaires par l’ocytocine
Sachant que des OTR fonctionnels sont exprimés dans les astrocytes, il est possible d’étudier l’effet de leur activation sur les fonctions de ces cellules. Plusieurs études indiquent que la liaison de l’OT aux OTR des astrocytes déclenche des évènements calciques dans ces cellules (Kuo et al., 2009 ; Zatkova et al., 2018 ; Wahis et al., 2021). Cependant, les cibles en aval et les conséquences finales de la signalisation de l’OTR astrocytaire ne sont pas encore complètement connues. Dans ce chapitre, nous résumons les conséquences de l’activation de l’OTR sur la morphologie des astrocytes et l’activité du réseau neuronal.
Conséquences morphologiques
Les neurones OT libèrent le peptide localement, un phénomène connu sous le nom de libération somato-dendritique (Ludwig & Leng, 2006). Il a été proposé que cette forme de libération facilite un mécanisme de rétroaction locale et permet d’activer les neurones ocytocinergiques lors de situations physiologiques particulières comme la parturition, la lactation ou d’autres défis homéostatiques (Brown et al., 2013, 2020). Dès le milieu des années 1980, il a été démontré que ces conditions associées à une forte libération d’OT entraînent une diminution importante de la densité de filaments de GFAP dans les SON (Salm et al., 1985 ; Wang & Hatton, 2009). En outre, la perfusion d’OT dans les SON entraîne une augmentation des contacts entre les somas neuronaux (Theodosis et al., 1986a, b ; Langle et al., 2003). Cela suggère fortement que l’OT peut modifier la morphologie des astrocytes dont les extensions membranaires séparent normalement les corps cellulaires des neurones. Cette hypothèse a été confirmée dans des tranches de SON. En effet, alors que dans les conditions basales, les membranes neuronales ne sont presque pas juxtaposées car les prolongements astrocytaires les séparent, l’application d’OT sur les tranches, en déclenchant la rétraction de ces prolongements, augmente les contacts entre les neurones OTergiques. Cette modification de la cytoarchitecture astrocytaire semble être calcium-dépendante (Langle et al., 2003). Bien que les auteurs n’aient pas fourni d’explication à ce phénomène, on peut supposer que l’activation de l’OTR des astrocytes modifie le cytosquelette de ces cellules en affectant la dynamique des microtubules, des filaments intermédiaires et/ou des microfilaments d’actine. De fait, les variations de la concentration calcique intracellulaire dans les astrocytes peuvent influer sur les protéines de remodelage de l’actine, telles que la cofiline. Cela a été démontré dans l’hippocampe où la potentialisation à long terme (LTP) déclenche le retrait des prolongements astrocytaires péridendritiques au niveau des synapses « potentialisées » (Henneberger et al., 2020). Il est intéressant de noter qu’une telle réorganisation du cytosquelette d’actine a été observée dans les neurones du SON, et probablement aussi dans les astrocytes voisins en réponse à l’application d’OT (Wang & Hatton, 2007) (Figure 1).
Ces changements morphologiques des astrocytes hypothalamiques pourraient potentiellement avoir de nombreuses conséquences drastiques et durables sur l’activité globale du réseau. En premier lieu, comme les astrocytes maintiennent l’homéostasie des ions K+, connus pour être fortement impliqués dans l’excitabilité neuronale (Verkhratsky & Nedergaard, 2018), une réduction de la couverture astrocytaire pourrait entraîner des modifications importantes du potentiel membranaire des neurones voisins. Deuxièmement, les astrocytes étant des médiateurs importants de la clairance des neurotransmetteurs de la fente synaptique (les transporteurs GLT-1 et GAT sont présents sur les extensions astrocytaires et assurent l’élimination respective du glutamate et du GABA extracellulaires), une réduction de la couverture astrocytaire entraîne inévitablement une augmentation de la concentration extracellulaire des neurotransmetteurs, ce qui se traduit finalement par des modifications de la transmission synaptique. D’ailleurs, les neurotransmetteurs peuvent déborder de la fente synaptique et activer les récepteurs présynaptiques (par exemple, les mGluR) ou extrasynaptiques (par exemple, les NMDAR) afin de promouvoir un effet de régulation par rétroaction ou de moduler l’efficacité et/ou la puissance des synapses voisines (Oliet et al., 2008). Troisièmement, en désencombrant l’espace extracellulaire, la rétraction des prolongements astrocytaires pourrait permettre la formation de nouvelles synapses, comme cela a été suggéré pour l’hypothalamus (Hatton et al., 1984). Enfin, les astrocytes étant connus pour libérer des molécules neuroactives nommées gliotransmetteurs, la rétraction de leurs prolongements pourrait conduire à une diminution des taux de ces molécules dans l’espace extracellulaire et donc à la réduction de leur capacité à moduler la neurotransmission via les récepteurs de gliotransmetteurs exprimés par les neurones environnants.
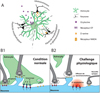 |
Figure 1 Effets de l’activation du récepteur ocytocinergique astrocytaire. (A) En haut : L’ocytocine module la gliotransmission. En bas à gauche : L’ocytocine induit des changements morphologiques astrocytaires. En bas à droite : Nous émettons l’hypothèse selon laquelle les deux mécanismes pourraient se produire en même temps. (B) Interactions astrocytes-neurones en conditions normales (B1) ou pathologiques (rétraction des prolongements astrocytaires), (B2) (voir le texte pour plus de détails). |
Gliotransmission
Le concept de communication directe entre les astrocytes et les neurones par la libération de gliotransmetteurs a été introduit dès le début des années 1990 (Grandes et al., 1991), mais il a fallu attendre les travaux de Parpura et al. (1994) pour en apporter la démonstration. En effet, ces auteurs ont été les premiers à rapporter que le glutamate libéré par les astrocytes provoquait une augmentation de l’activité calcique dans les neurones voisins. Plus tard, il a également été démontré que l’ATP agissait sur les récepteurs P2X des neurones après avoir été libéré par les astrocytes (Zhang et al., 2003). Il est important de noter, cependant, que les mécanismes qui sous-tendent la gliotransmission sont encore controversés (Sloan & Barres, 2014 ; Fiacco & McCarthy, 2018), bien que la majorité des chercheurs dans le domaine semble reconnaître son existence (Araque et al., 2014 ; Savtchouk & Volterra, 2018).
Dans le SON, Panatier et al. (2006) ont montré que les astrocytes expriment la sérine racémase, une enzyme qui convertit la L-sérine en D-sérine et que cette D-sérine est le co-agoniste endogène des NMDAR (Panatier et al., 2006). En outre, ils ont démontré que les courants induits par l’ouverture des NMDAR sont fortement altérés dans les tranches de SON traitées par la D-aminoacide-oxydase (DAAO), une enzyme qui dégrade la D-sérine extracellulaire. Comme cette altération est corrigée par l’application de D-sérine exogène, ils en déduisent que les astrocytes synthétisent et libèrent la D-sérine pour induire un signal dépendant des NMDAR. Panatier et al. (2006) ont également réalisé des enregistrements ex vivo de courants déclenchés par l’ouverture des NMDAR dans des neurones du SON de rattes vierges ou en lactation. Ils ont montré que chez les rattes allaitantes, les courants évoqués par l’ouverture des AMPAR et des NMDAR étaient similaires à ceux observés dans des tranches d’animaux vierges traités par DAAO et qu’ils pouvaient également être corrigés par l’application de D-sérine. Étant donné que l’activation des NMDAR semble être essentielle pour l’établissement de la LTP, ils ont étudié l’implication de ces récepteurs dans ce phénomène de plasticité synaptique au niveau du SON. Chez les animaux vierges, ils ont observé un établissement normal de la LTP, alors que chez les rattes allaitantes, cette plasticité ne se produit que si le milieu d’enregistrement est supplémenté en D-sérine. Il semble donc que l’apport de D-sérine par les astrocytes soit essentiel à la plasticité synaptique dans le SON (Panatier et al., 2006). Toutefois, il convient de noter que l’origine astrocytaire de la D-sérine fait encore l’objet de débats (Papouin et al., 2017 ; Ivanov & Mothet, 2019 ; Coyle et al., 2020).
Plus récemment, Wahis et al. (2021) ont étudié l’implication des astrocytes de la partie latérale de l’amygdale centrale (CeL) dans la régulation de l’activité neuronale en réponse à l’OT. Dans cette structure, une population d’astrocytes de la CeL semble exprimer l’OTR et son activation déclenche une augmentation de leur activité calcique (Wahis et al., 2021). De plus, ces changements d’activité calcique astrocytaire sont liés à une augmentation de l’activité électrique des neurones du CeL voisins. Cette augmentation est dépendante des NMDAR et sensible à l’enzyme de dégradation de la D-sérine, la DAAO, suggérant que les astrocytes modulent l’activité des neurones de CeL en libérant de la D-sérine (Figure 1). Au niveau comportemental, cette modulation du réseau neuronal semble réduire les comportements de type anxieux. Cela démontre que les astrocytes de la CeL participent activement à la modulation du réseau neuronal par l’OT (Wahis et al., 2021).
Un autre circuit impliquant les astrocytes dans la régulation de l’activité neuronale a été mis en évidence au niveau de l’hypothalamus basal médian par Parent et al. (2008). Dans cette structure, l’OTR n’est pas exprimé par les neurones exprimant la GnRH, mais l’est au contraire par les cellules voisines qui seraient des astrocytes, comme le suggère l’expression d’OTR dans ces cellules mises en culture (Parent et al., 2008). De manière intéressante, l’injection intrapéritonéale d’OT réduit l’intervalle entre les pics de sécrétion de la GnRH, connue pour être impliquée dans la maturation sexuelle. Si les astrocytes sont bien les seules cellules qui expriment l’OTR dans l’hypothalamus basal médian, on peut alors se demander comment l’OT module la libération de GnRH dans le sang (c’est-à-dire l’activité des neurones GnRH). Étant donné que l’OT induit la libération de prostaglandine E2 (PGE2) (Strakova et al., 1998), Parent et al. (2008) ont émis l’hypothèse selon laquelle celle-ci était le médiateur de la communication entre les astrocytes et les neurones GnRH. De fait, ils ont constaté que la PGE2 reproduisait l’effet de l’OT en diminuant l’intervalle entre les pics de sécrétion de GnRH. In fine, l’ensemble de ces données suggère que l’OT active directement les astrocytes de l’hypothalamus basal médian pour déclencher la libération de PGE2, celle-ci agissant ensuite sur les neurones GnRH pour moduler la sécrétion neuronale pulsatile de GnRH et, finalement, la maturation sexuelle (Parent et al., 2008). Ainsi, les astrocytes activés par l’OT pourraient communiquer avec les neurones voisins en libérant plusieurs gliotransmetteurs, tels que la D-sérine ou la PGE2.
Conclusions
Les recherches menées au cours des deux dernières décennies ont montré que les astrocytes sont bien plus que des cellules passives nécessaires au soutien neuronal. Il est devenu évident que les astrocytes jouent un rôle majeur dans le métabolisme, l’homéostasie, le traitement des informations et les fonctions cognitives. De nombreux neuromodulateurs qui influencent ces fonctions agissent également sur l’activité calcique astrocytaire, ce qui suggère que les astrocytes pourraient être impliqués dans la régulation de l’activité des circuits neuronaux. Parmi ces neuromodulateurs, il a été démontré que l’OT déclenche des évènements calciques dans les astrocytes, mettant en évidence un mode d’intégration des informations OTergiques dans le système nerveux central. La différence de dynamique temporelle entre les astrocytes et les neurones permet une interaction complexe entre les deux types de cellules et pourrait influencer radicalement la fonction des neuromodulateurs.
Le fait que l’OT induise des changements morphologiques dans les astrocytes hypothalamiques, et affecte ainsi directement la transmission neuronale, donne lieu à une série d’hypothèses intéressantes. L’OT pourrait potentiellement déclencher un ajustement fin et limité dans le temps de la neurotransmission dans les microcircuits pendant des situations physiologiques particulières. La rétraction des prolongements astrocytaires ne fait pas seulement de la place pour plus de signalisation extracellulaire, mais empêche également l’élimination des neurotransmetteurs et des surcharges ioniques générées par l’activité neuronale. Ainsi, l’amorçage OTergique des astrocytes pourrait potentiellement avoir des effets durables sur l’activité du réseau neuronal. Cela serait en accord avec l’idée que les astrocytes peuvent intégrer, traiter et transmettre des informations dans le cadre d’un réseau astro-neuronal. Des études futures devraient permettre d’évaluer précisément le rôle de l’OTR neuronal dans ces réseaux astrocytes-neurones. Il semble plausible que l’activation des astrocytes par l’OT précède l’activation des neurones médiée par l’OTR et que la signalisation OTergique dans les neurones permette une activité soutenue des réseaux astrocytaires-neuronaux. Enfin, on ne sait toujours pas comment la signalisation OTergique dans les astrocytes affecte divers comportements en conditions physiologiques ou pathologiques, des dysfonctions du système OTergique ayant été identifiées comme cause sous-jacente des troubles du spectre autistique (Guastella et al., 2010 ; Domes et al., 2013 ; Gordon et al., 2013 ; Anagnostou et al., 2014 ; Ford & Young, 2022), du syndrome de Prader-Willi (Swaab et al., 1995 ; Swaab, 1997 ; Tauber et al., 2011, 2017) ou des troubles de stress post-traumatiques (Swaab et al., 1995 ; Swaab, 1997 ; Guastella et al., 2010 ; Olff et al., 2010 ; Meyer-Lindenberg et al., 2011 ; Domes et al., 2013 ; Gordon et al., 2013 ; Anagnostou et al., 2014 ; Frijling et al., 2014 ; Frijling, 2017 ; Tauber et al., 2017 ; Ford & Young, 2022).
Remerciements
Ce travail a reçu le support du Centre National de la Recherche Scientifique (UPR3212) et de l’Université de Strasbourg (UPR3212), et les financements de l’ANR (JCJC n°19-CE16-0011-0 à A. Charlet), de la fondation pour la recherche médicale (FDT202204015114 à A. Baudon) et de la Graduate School of Pain (EURIDOL ANR-17-EURE-0022 à A. Charlet et E. Clauss Creusot). Les auteurs remercient les referees et les relecteurs pour la qualité de leur travail d’édition.
Références
- Alanazi, M.M., Havranek, T., Bakos, J., Cubeddu, L.X., Castejon, A.M. (2020). Cell proliferation and anti-oxidant effects of oxytocin and oxytocin receptors: role of extracellular signal-regulating kinase in astrocyte-like cells. Endocr Regul, 54, 172-182. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Althammer, F., Eliava, M., Grinevich, V. (2021). Central and peripheral release of oxytocin: Relevance of neuroendocrine and neurotransmitter actions for physiology and behavior. Handb Clin Neurol, 180, 25-44. [CrossRef] [PubMed] [Google Scholar]
- Althammer, F., Krause, E.G., de Kloet, A.D., Smith, J., Grinevich, V., Charlet, A., Stern, J.E. (2022a). Identification and three-dimensional reconstruction of oxytocin receptor expressing astrocytes in the rat and mouse brain. STAR Protoc, 3, 101160. [CrossRef] [PubMed] [Google Scholar]
- Althammer, F., Roy, R.K., Lefevre, A., Najjar, R.S., Schoenig, K., Bartsch, D., Eliava, M., Feresin, R., Hammock, E.A.D., Murphy, A.Z., Charlet, A., Grinevich, V., Stern, J.E. (2022b). Altered PVN-to-CA2 hippocampal oxytocin pathway and reduced number of oxytocin-receptor expressing astrocytes in heart failure rats. J Neuroendocrinol, 34, e13166. [PubMed] [Google Scholar]
- Amato, S., Averna, M., Guidolin, D., Pedrazzi, M., Pelassa, S., Capraro, M., Passalacqua, M., Bozzo, M., Gatta, E., Anderlini, D., Maura, G., Agnati, L.F., Cervetto, C., Marcoli, M. (2022). Heterodimer of A2A and oxytocin receptors regulating glutamate release in adult striatal astrocytes. Int J Mol Sci, 23, 2326. [CrossRef] [PubMed] [Google Scholar]
- Anagnostou, E., Soorya, L., Brian, J., Dupuis, A., Mankad, D., Smile, S., Jacob, S. (2014). Intranasal oxytocin in the treatment of autism spectrum disorders: a review of literature and early safety and efficacy data in youth. Brain Res, 1580, 188-198. [CrossRef] [PubMed] [Google Scholar]
- Araque, A., Carmignoto, G., Haydon, P.G., Oliet, S.H., Robitaille, R., Volterra, A. (2014). Gliotransmitters travel in time and space. Neuron, 81, 728-739. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Augusto-Oliveira, M., Arrifano, G.P., Takeda, P.Y., Lopes-Araujo, A., Santos-Sacramento, L., Anthony, D.C., Verkhratsky, A., Crespo-Lopez, M.E. (2020). Astroglia-specific contributions to the regulation of synapses, cognition and behaviour. Neurosci Biobehav Rev, 118, 331-357. [CrossRef] [PubMed] [Google Scholar]
- Bakos, J., Srancikova, A., Havranek, T., Bacova, Z. (2018). Molecular mechanisms of oxytocin signaling at the synaptic connection. Neural Plast, 2018, 4864107. [CrossRef] [Google Scholar]
- Bazargani, N., Attwell, D. (2016). Astrocyte calcium signaling: the third wave. Nat Neurosci, 19, 182-189. [CrossRef] [PubMed] [Google Scholar]
- Brown, C.H., Bains, J.S., Ludwig, M., Stern, J.E. (2013). Physiological regulation of magnocellular neurosecretory cell activity: integration of intrinsic, local and afferent mechanisms. J Neuroendocrinol, 25, 678-710. [CrossRef] [PubMed] [Google Scholar]
- Brown, C.H., Ludwig, M., Tasker, J.G., Stern, J.E. (2020). Somato-dendritic vasopressin and oxytocin secretion in endocrine and autonomic regulation. J Neuroendocrinol, 32, e12856. [CrossRef] [PubMed] [Google Scholar]
- Buijs, R.M. (1983). Vasopressin and oxytocin – Their role in neurotransmission. Pharmacol Ther, 22, 127-141. [CrossRef] [PubMed] [Google Scholar]
- Busnelli, M., Chini, B. (2018). Molecular basis of oxytocin receptor signalling in the brain: What we know and what we need to know. Curr Top Behav Neurosci, 35, 3-29. [CrossRef] [PubMed] [Google Scholar]
- Busnelli, M., Sauliere, A., Manning, M., Bouvier, M., Gales, C., Chini, B. (2012). Functional selective oxytocin-derived agonists discriminate between individual G protein family subtypes. J Biol Chem, 287, 3617-3629. [CrossRef] [PubMed] [Google Scholar]
- Chatterjee, O., Patil, K., Sahu, A., Gopalakrishnan, L., Mol, P., Advani, J., Mukherjee, S., Christopher, R., Prasad, T.S. (2016). An overview of the oxytocin-oxytocin receptor signaling network. J Cell Commun Signal, 10, 355-360. [CrossRef] [PubMed] [Google Scholar]
- Coyle, J.T., Balu, D., Wolosker, H. (2020). D-Serine, the shape-shifting NMDA receptor co-agonist. Neurochem Res, 45, 1344-1353. [CrossRef] [PubMed] [Google Scholar]
- Dale, H.H. (1906). On some physiological actions of ergot. J Physiol, 34, 163-206. [CrossRef] [PubMed] [Google Scholar]
- Di Scala-Guénot, D., Strosser, M.T. (1992). Oxytocin receptors on cultured astroglial cells. Kinetic and pharmacological characterization of oxytocin-binding sites on intact hypothalamic and hippocampic cells from foetal rat brain. Biochem J, 284, 491-497. [CrossRef] [PubMed] [Google Scholar]
- Di Scala-Guénot, D., Mouginot, D., Strosser, M.T. (1994). Increase of intracellular calcium induced by oxytocin in hypothalamic cultured astrocytes. Glia, 11, 269-276. [CrossRef] [PubMed] [Google Scholar]
- Domes, G., Heinrichs, M., Kumbier, E., Grossmann, A., Hauenstein, K., Herpertz, S.C. (2013). Effects of intranasal oxytocin on the neural basis of face processing in autism spectrum disorder. Biol Psychiatry, 74, 164-171. [CrossRef] [PubMed] [Google Scholar]
- Eliava, M., Melchior, M., Knobloch-Bollmann, H.S., Wahis, J., da Silva Gouveia, M., Tang, Y., Ciobanu, A.C., Triana del Rio, R., Roth, L.C., Althammer, F., Chavant, V., Goumon, Y., Gruber, T., Petit-Demoulière, N., Busnelli, M., Chini, B., Tan, L.L., Mitre, M., Froemke, R.C., Chao, M.V., Giese, G., Sprengel, R., Kuner, R., Poisbeau, P., Seeburg, P.H., Stoop, R., Charlet, A., Grinevich, V. (2016). A new population of parvocellular oxytocin neurons controlling magnocellular neuron activity and inflammatory pain processing. Neuron, 89, 1291-1304. [CrossRef] [PubMed] [Google Scholar]
- Evrard, M.E., Strosser, M.T., Di Scala-Guénot, D. (1997). Pharmacological characterization of oxytocin-binding sites in rat spinal cord membranes: comparison with embryonic cultured spinal cord neurones and astrocytes. J Neuroendocrinol, 9, 553-560. [CrossRef] [PubMed] [Google Scholar]
- Fiacco, T.A., McCarthy, K.D. (2018). Multiple lines of evidence indicate that gliotransmission does not occur under physiological conditions. J Neurosci, 38, 3-13. [CrossRef] [PubMed] [Google Scholar]
- Foo, L.C., Allen, N.J., Bushong, E.A., Ventura, P.B., Chung, W.S., Zhou, L., Cahoy, J.D., Daneman, R., Zong, H., Ellisman, M.H., Barres, B.A. (2011). Development of a method for the purification and culture of rodent astrocytes. Neuron, 71, 799-811. [CrossRef] [PubMed] [Google Scholar]
- Ford, C.L., Young, L.J. (2022). Refining oxytocin therapy for autism: context is key. Nat Rev Neurol, 18, 67-68. [CrossRef] [PubMed] [Google Scholar]
- Frijling, J.L., (2017). Preventing PTSD with oxytocin: effects of oxytocin administration on fear neurocircuitry and PTSD symptom development in recently trauma-exposed individuals. Eur J Psychotraumatol, 8, 1302652. [CrossRef] [PubMed] [Google Scholar]
- Frijling, J.L., van Zuiden, M., Koch, S.B., Nawijn, L., Goslings, J.C., Luitse, J.S., Biesheuvel, T.H., Honig, A., Bakker, F.C., Denys, D., Veltman, D.J., Olff, M. (2014). Efficacy of oxytocin administration early after psychotrauma in preventing the development of PTSD: study protocol of a randomized controlled trial. BMC Psychiatry, 14, 92. [CrossRef] [PubMed] [Google Scholar]
- Froemke, R.C., Young, L.J. (2021). Oxytocin, neural plasticity, and social behavior. Annu Rev Neurosci, 44, 359-381. [CrossRef] [PubMed] [Google Scholar]
- Fuxe, K., Borroto-Escuela, D.O., Romero-Fernandez, W., Ciruela, F., Manger, P., Leo, G., Diaz-Cabiale, Z., Agnati, L.F. (2012). On the role of volume transmission and receptor-receptor interactions in social behaviour: focus on central catecholamine and oxytocin neurons. Brain Res, 1476, 119-131. [CrossRef] [PubMed] [Google Scholar]
- Gautvik, K.M., de Lecea, L., Gautvik, V.T., Danielson, P.E., Tranque, P., Dopazo, A., Bloom, F.E., Sutcliffe, J.G. (1996). Overview of the most prevalent hypothalamus-specific mRNAs, as identified by directional tag PCR subtraction. Proc Natl Acad Sci USA, 93, 8733-8738. [CrossRef] [PubMed] [Google Scholar]
- Gimpl, G., Fahrenholz, F., (2001). The oxytocin receptor system: structure, function, and regulation. Physiol Rev, 81, 629-683. [CrossRef] [PubMed] [Google Scholar]
- Gordon, I., Vander Wyk, B.C., Bennett, R.H., Cordeaux, C., Lucas, M.V., Eilbott, J.A., Zagoory-Sharon, O., Leckman, J.F., Feldman, R., Pelphrey, K.A. (2013). Oxytocin enhances brain function in children with autism. Proc Natl Acad Sci USA, 110, 20953-20958. [CrossRef] [PubMed] [Google Scholar]
- Gould, B.R., Zingg, H.H. (2003). Mapping oxytocin receptor gene expression in the mouse brain and mammary gland using an oxytocin receptor-LacZ reporter mouse. Neuroscience, 122, 155-167. [CrossRef] [PubMed] [Google Scholar]
- Grandes, P., Kq, K.Q.D., Morino, P., Cuenod, M., Streit, P. (1991). Homocysteate, an excitatory transmitter candidate localized in glia. Eur J Neurosci, 3, 1370-1373. [CrossRef] [PubMed] [Google Scholar]
- Gravati, M., Busnelli, M., Bulgheroni, E., Reversi, A., Spaiardi, P., Parenti, M., Toselli, M., Chini, B. (2010). Dual modulation of inward rectifier potassium currents in olfactory neuronal cells by promiscuous G protein coupling of the oxytocin receptor. J Neurochem, 114, 1424-1435. [PubMed] [Google Scholar]
- Grinevich, V., Knobloch-Bollmann, H.S., Eliava, M., Busnelli, M., Chini, B. (2016). Assembling the puzzle: Pathways of oxytocin signaling in the brain. Biol Psychiatry, 79, 155-164. [CrossRef] [PubMed] [Google Scholar]
- Grinevich, V., Neumann, I.D. (2020). Brain oxytocin: how puzzle stones from animal studies translate into psychiatry. Mol Psychiatry, 26, 265-279. [Google Scholar]
- Guastella, A.J., Einfeld, S.L., Gray, K.M., Rinehart, N.J., Tonge, B.J., Lambert, T.J., Hickie, I.B., (2010). Intranasal oxytocin improves emotion recognition for youth with autism spectrum disorders. Biol Psychiatry, 67, 692-694. [CrossRef] [PubMed] [Google Scholar]
- Gwee, P.C., Tay, B.H., Brenner, S., Venkatesh, B. (2009). Characterization of the neurohypophysial hormone gene loci in elephant shark and the Japanese lamprey: Origin of the vertebrate neurohypophysial hormone genes. BMC Evol Biol, 9, 47. [CrossRef] [PubMed] [Google Scholar]
- Hasan, M.T., Althammer, F., Silva da Gouveia, M., Goyon, S., Eliava, M., Lefevre, A., Kerspern, D., Schimmer, J., Raftogianni, A., Wahis, J., Knobloch-Bollmann, H.S., Tang, Y., Liu, X., Jain, A., Chavant, V., Goumon, Y., Weislogel, J.M., Hurlemann, R., Herpertz, S.C., Pitzer, C., Darbon, P., Dogbevia, G.K., Bertocchi, I., Larkum, M.E., Sprengel, R., Bading, H., Charlet, A., Grinevich, V. (2019). A fear memory engram and its plasticity in the hypothalamic oxytocin system. Neuron, 103, 133-146. [CrossRef] [PubMed] [Google Scholar]
- Hatton, G.I., Perlmutter, L.S., Salm, A.K., Tweedle, C.D. (1984). Dynamic neuronal-glial interactions in hypothalamus and pituitary: implications for control of hormone synthesis and release. Peptides, 5(Suppl 1), 121-138. [CrossRef] [PubMed] [Google Scholar]
- Havranek, T., Lestanova, Z., Mravec, B., Strbak, V., Bakos, J., Bacova, Z. (2017). Oxytocin modulates expression of neuron and glial markers in the rat hippocampus. Folia Biol (Praha), 63, 91-97. [PubMed] [Google Scholar]
- Henneberger, C., Bard, L., Panatier, A., Reynolds, J.P., Kopach, O., Medvedev, N.I., Minge, D., Herde, M.K., Anders, S., Kraev, I., Heller, J.P., Rama, S., Zheng, K., Jensen, T.P., Sanchez-Romero, I., Jackson, C.J., Janovjak, H., Ottersen, O.P., Nagelhus, E.A., Oliet, S.H.R., Stewart, M.G., Nagerl, U.V., Rusakov, D.A. (2020). LTP induction boosts glutamate spillover by driving withdrawal of perisynaptic astroglia. Neuron, 108, 919-936. [CrossRef] [PubMed] [Google Scholar]
- Hoare, S., Copland, J.A., Strakova, Z., Ives, K., Jeng, Y.J., Hellmich, M.R., Soloff, M.S. (1999). The proximal portion of the COOH terminus of the oxytocin receptor is required for coupling to G(q), but not G(i). Independent mechanisms for elevating intracellular calcium concentrations from intracellular stores. J Biol Chem, 274, 28682-28689. [CrossRef] [PubMed] [Google Scholar]
- Hu, N.Y., Chen, Y.T., Wang, Q., Jie, W., Liu, Y.S., You, Q.L., Li, Z.L., Li, X.W., Reibel, S., Pfrieger, F.W., Yang, J.M., Gao, T.M. (2020). Expression patterns of inducible Cre recombinase driven by differential astrocyte-specific promoters in transgenic mouse lines. Neurosci Bull, 36, 530-544. [CrossRef] [PubMed] [Google Scholar]
- Inoue, T., Yamakage, H., Tanaka, M., Kusakabe, T., Shimatsu, A., Satoh-Asahara, N. (2019). Oxytocin suppresses inflammatory responses induced by lipopolysaccharide through inhibition of the eIF-2-ATF4 pathway in mouse microglia. Cells, 8, 527. [CrossRef] [PubMed] [Google Scholar]
- Insel, T.R., Young, L.J., 2001. The neurobiology of attachment. Nat Rev Neurosci, 2, 129-136. [CrossRef] [PubMed] [Google Scholar]
- Ivanov, A.D., Mothet, J.P. (2019). The plastic D-serine signaling pathway: Sliding from neurons to glia and vice-versa. Neurosci Lett, 689, 21-25. [CrossRef] [PubMed] [Google Scholar]
- Jurek, B., Neumann, I.D. (2018). The oxytocin receptor: From intracellular signaling to behavior. Physiol Rev, 98, 1805-1908. [CrossRef] [PubMed] [Google Scholar]
- Knobloch, H.S., Charlet, A., Hoffmann, L.C., Eliava, M., Khrulev, S., Cetin, A.H., Osten, P., Schwarz, M.K., Seeburg, P.H., Stoop, R., Grinevich, V. (2012). Evoked axonal oxytocin release in the central amygdala attenuates fear response. Neuron, 73, 553-566. [CrossRef] [PubMed] [Google Scholar]
- Kuo, J., Hariri, O.R., Micevych, P. (2009). An interaction of oxytocin receptors with metabotropic glutamate receptors in hypothalamic astrocytes. J Neuroendocrinol, 21, 1001-1006. [CrossRef] [PubMed] [Google Scholar]
- Landgraf, R., Neumann, I.D. (2004). Vasopressin and oxytocin release within the brain: a dynamic concept of multiple and variable modes of neuropeptide communication. Front Neuroendocrinol, 25, 150-176. [CrossRef] [PubMed] [Google Scholar]
- Langle, S.L., Poulain, D.A., Theodosis, D.T. (2003). Induction of rapid, activity-dependent neuronal-glial remodelling in the adult rat hypothalamus in vitro. Eur J Neurosci, 18, 206-214. [CrossRef] [PubMed] [Google Scholar]
- Lee, H.J., Macbeth, A.H., Pagani, J.H., Young, W.S., 3rd. (2009). Oxytocin: the great facilitator of life. Prog Neurobiol, 88, 127-151. [PubMed] [Google Scholar]
- Leng, G., Ludwig, M. (2008). Neurotransmitters and peptides: whispered secrets and public announcements. J Physiol, 586, 5625-5632. [Google Scholar]
- Ludwig, M., Leng, G. (2006). Dendritic peptide release and peptide-dependent behaviours. Nat Rev Neurosci, 7, 126-136. [CrossRef] [PubMed] [Google Scholar]
- Ludwig, M., Stern, J. (2015). Multiple signalling modalities mediated by dendritic exocytosis of oxytocin and vasopressin. Philos Trans R Soc Lond B Biol Sci, 370(1762), 20140182. [CrossRef] [PubMed] [Google Scholar]
- Maicas-Royo, J., Leng, G., MacGregor, D.J. (2018). A predictive, quantitative model of spiking activity and stimulus-secretion coupling in oxytocin neurons. Endocrinology, 159, 1433-1452. [CrossRef] [PubMed] [Google Scholar]
- Mairesse, J., Zinni, M., Pansiot, J., Hassan-Abdi, R., Demene, C., Colella, M., Charriaut-Marlangue, C., Rideau Batista Novais, A., Tanter, M., Maccari, S., Gressens, P., Vaiman, D., Soussi-Yanicostas, N., Baud, O. (2019). Oxytocin receptor agonist reduces perinatal brain damage by targeting microglia. Glia, 67, 345-359. [CrossRef] [PubMed] [Google Scholar]
- McKay, E.C., Beck, J.S., Khoo, S.K., Dykema, K.J., Cottingham, S.L., Winn, M.E., Paulson, H.L., Lieberman, A.P., Counts, S.E. (2019). Peri-infarct upregulation of the oxytocin receptor in vascular dementia. J Neuropathol Exp Neurol, 78, 436-452. [CrossRef] [PubMed] [Google Scholar]
- Meyer-Lindenberg, A., Domes, G., Kirsch, P., Heinrichs, M. (2011). Oxytocin and vasopressin in the human brain: social neuropeptides for translational medicine. Nat Rev Neurosci, 12, 524-538. [CrossRef] [PubMed] [Google Scholar]
- Mitre, M., Marlin, B.J., Schiavo, J.K., Morina, E., Norden, S.E., Hackett, T.A., Aoki, C.J., Chao, M.V., Froemke, R.C. (2016). A distributed network for social cognition enriched for oxytocin receptors. J Neurosci, 36, 2517-2535. [CrossRef] [PubMed] [Google Scholar]
- Mitre, M., Minder, J., Morina, E.X., Chao, M.V., Froemke, R.C. (2018). Oxytocin modulation of neural circuits. Curr Top Behav Neurosci, 35, 31-53. [CrossRef] [PubMed] [Google Scholar]
- Newmaster, K.T., Nolan, Z.T., Chon, U., Vanselow, D.J., Weit, A.R., Tabbaa, M., Hidema, S., Nishimori, K., Hammock, E.A.D., Kim, Y., (2020). Quantitative cellular-resolution map of the oxytocin receptor in postnatally developing mouse brains. Nat Commun, 11, 1885. [CrossRef] [PubMed] [Google Scholar]
- Olff, M., Langeland, W., Witteveen, A., Denys, D. (2010). A psychobiological rationale for oxytocin in the treatment of posttraumatic stress disorder. CNS Spectr, 15, 522-530. [CrossRef] [PubMed] [Google Scholar]
- Oliet, S.H., Panatier, A., Piet, R., Mothet, J.P., Poulain, D.A., Theodosis, D.T. (2008). Neuron-glia interactions in the rat supraoptic nucleus. Prog Brain Res, 170, 109-117. [CrossRef] [PubMed] [Google Scholar]
- Owen, S.F., Tuncdemir, S.N., Bader, P.L., Tirko, N.N., Fishell, G., Tsien, R.W. (2013). Oxytocin enhances hippocampal spike transmission by modulating fast-spiking interneurons. Nature, 500, 458-462. [CrossRef] [PubMed] [Google Scholar]
- Palanisamy, A., Kannappan, R., Xu, Z., Martino, A., Friese, M.B., Boyd, J.D., Crosby, G., Culley, D.J. (2018). Oxytocin alters cell fate selection of rat neural progenitor cells in vitro. PLoS One, 13, e0191160. [CrossRef] [PubMed] [Google Scholar]
- Panaro, M.A., Benameur, T., Porro, C. (2020). Hypothalamic neuropeptide brain protection: Focus on oxytocin. J Clin Med, 9, 1534. [CrossRef] [PubMed] [Google Scholar]
- Panatier, A., Gentles, S.J., Bourque, C.W., Oliet, S.H. 2006. Activity-dependent synaptic plasticity in the supraoptic nucleus of the rat hypothalamus. J Physiol, 573, 711-721. [CrossRef] [PubMed] [Google Scholar]
- Papouin, T., Henneberger, C., Rusakov, D.A., Oliet, S.H.R. (2017). Astroglial versus neuronal D-serine: Fact checking. Trends Neurosci, 40, 517-520. [CrossRef] [PubMed] [Google Scholar]
- Parent, A.S., Rasier, G., Matagne, V., Lomniczi, A., Lebrethon, M.C., Gerard, A., Ojeda, S.R., Bourguignon, J.P. (2008). Oxytocin facilitates female sexual maturation through a glia-to-neuron signaling pathway. Endocrinology, 149, 1358-1365. [CrossRef] [PubMed] [Google Scholar]
- Parpura, V., Basarsky, T.A., Liu, F., Jeftinija, K., Jeftinija, S., Haydon, P.G. (1994). Glutamate-mediated astrocyte-neuron signalling. Nature, 369, 744-747. [CrossRef] [PubMed] [Google Scholar]
- Phaneuf, S., Europe-Finner, G.N., Varney, M., MacKenzie, I.Z., Watson, S.P., Lopez Bernal, A. (1993). Oxytocin-stimulated phosphoinositide hydrolysis in human myometrial cells: involvement of pertussis toxin-sensitive and -insensitive G-proteins. J Endocrinol, 136, 497-509. [CrossRef] [PubMed] [Google Scholar]
- Rimoldi, V., Reversi, A., Taverna, E., Rosa, P., Francolini, M., Cassoni, P., Parenti, M., Chini, B. (2003). Oxytocin receptor elicits different EGFR/MAPK activation patterns depending on its localization in caveolin-1 enriched domains. Oncogene, 22, 6054-6060. [CrossRef] [PubMed] [Google Scholar]
- Rosso, L., Peteri-Brunback, B., Vouret-Craviari, V., Deroanne, C., Van Obberghen-Schilling, E., Mienville, J.M. (2002). Vasopressin and oxytocin reverse adenosine-induced pituicyte stellation via calcium-dependent activation of Cdc42. Eur J Neurosci, 16, 2324-2332. [CrossRef] [PubMed] [Google Scholar]
- Salm, A.K., Smithson, K.G., Hatton, G.I. (1985). Lactation-associated redistribution of the glial fibrillary acidic protein within the supraoptic nucleus. An immunocytochemical study. Cell Tissue Res, 242, 9-15. [CrossRef] [PubMed] [Google Scholar]
- Savtchouk, I., Volterra, A. (2018). Gliotransmission: Beyond black-and-white. J Neurosci, 38, 14-25. [CrossRef] [PubMed] [Google Scholar]
- Shigetomi, E., Kracun, S., Khakh, B.S. (2010a). Monitoring astrocyte calcium microdomains with improved membrane targeted GCaMP reporters. Neuron Glia Biol, 6, 183-191. [CrossRef] [PubMed] [Google Scholar]
- Shigetomi, E., Kracun, S., Sofroniew, M.V., Khakh, B.S. (2010b). A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nat Neurosci, 13, 759-766. [CrossRef] [PubMed] [Google Scholar]
- Sloan, S.A., Barres, B.A. (2014). Looks can be deceiving: reconsidering the evidence for gliotransmission. Neuron, 84, 1112-1115. [CrossRef] [PubMed] [Google Scholar]
- Stifter, S.A., Greter, M. (2020). STOP floxing around: Specificity and leakiness of inducible Cre/loxP systems. Eur J Immunol, 50, 338-341. [CrossRef] [PubMed] [Google Scholar]
- Stoop, R. (2012). Neuromodulation by oxytocin and vasopressin. Neuron, 76, 142-159. [CrossRef] [PubMed] [Google Scholar]
- Strakova, Z., Copland, J.A., Lolait, S.J., Soloff, M.S. (1998). ERK2 mediates oxytocin-stimulated PGE2 synthesis. Am J Physiol, 274, E634-641. [PubMed] [Google Scholar]
- Swaab, D.F. (1997). Prader-Willi syndrome and the hypothalamus. Acta Paediatr Suppl, 423, 50-54. [CrossRef] [Google Scholar]
- Swaab, D.F., Purba, J.S., Hofman, M.A. (1995). Alterations in the hypothalamic paraventricular nucleus and its oxytocin neurons (putative satiety cells) in Prader-Willi syndrome: a study of five cases. J Clin Endocrinol Metab, 80, 573-579. [PubMed] [Google Scholar]
- Tasker, J.G., Oliet, S.H., Bains, J.S., Brown, C.H., Stern, J.E. (2012). Glial regulation of neuronal function: from synapse to systems physiology. J Neuroendocrinol, 24, 566-576. [CrossRef] [PubMed] [Google Scholar]
- Tauber, M., Boulanouar, K., Diene, G., Cabal-Berthoumieu, S., Ehlinger, V., Fichaux-Bourin, P., Molinas, C., Faye, S., Valette, M., Pourrinet, J., Cessans, C., Viaux-Sauvelon, S., Bascoul, C., Guedeney, A., Delhanty, P., Geenen, V., Martens, H., Muscatelli, F., Cohen, D., Consoli, A., Payoux, P., Arnaud, C., Salles, J.P. (2017). The use of oxytocin to improve feeding and social skills in infants with Prader-Willi syndrome. Pediatrics, 139, e20162976. [CrossRef] [PubMed] [Google Scholar]
- Tauber, M., Mantoulan, C., Copet, P., Jauregui, J., Demeer, G., Diene, G., Roge, B., Laurier, V., Ehlinger, V., Arnaud, C., Molinas, C., Thuilleaux, D. (2011). Oxytocin may be useful to increase trust in others and decrease disruptive behaviours in patients with Prader-Willi syndrome: a randomised placebo-controlled trial in 24 patients. Orphanet J Rare Dis, 6, 47. [Google Scholar]
- Theodosis, D.T., Chapman, D.B., Montagnese, C., Poulain, D.A., Morris, J.F. (1986a). Structural plasticity in the hypothalamic supraoptic nucleus at lactation affects oxytocin-, but not vasopressin-secreting neurones. Neuroscience, 17, 661-678. [CrossRef] [PubMed] [Google Scholar]
- Theodosis, D.T., Montagnese, C., Rodriguez, F., Vincent, J.D., Poulain, D.A. (1986b). Oxytocin induces morphological plasticity in the adult hypothalamo-neurohypophysial system. Nature, 322, 738-740. [CrossRef] [PubMed] [Google Scholar]
- Theofanopoulou, C., Gedman, G., Cahill, J.A., Boeckx, C., Jarvis, E.D. (2021). Universal nomenclature for oxytocin-vasotocin ligand and receptor families. Nature, 592, 747-755. [CrossRef] [PubMed] [Google Scholar]
- Tirko, N.N., Eyring, K.W., Carcea, I., Mitre, M., Chao, M.V., Froemke, R.C., Tsien, R.W. (2018). Oxytocin transforms firing mode of CA2 hippocampal neurons. Neuron, 100, 593-608. [CrossRef] [PubMed] [Google Scholar]
- Tobin, V., Leng, G., Ludwig, M. (2012). The involvement of actin, calcium channels and exocytosis proteins in somato-dendritic oxytocin and vasopressin release. Front Physiol, 3, 261. [CrossRef] [PubMed] [Google Scholar]
- Verkhratsky, A., Nedergaard, M. (2018). Physiology of astroglia. Physiol Rev, 98, 239-389. [CrossRef] [PubMed] [Google Scholar]
- von Bartheld, C.S., Bahney, J., Herculano-Houzel, S., (2016). The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. J Comp Neurol, 524, 3865-3895. [CrossRef] [PubMed] [Google Scholar]
- Wahis, J., Baudon, A., Althammer, F., Kerspern, D., Goyon, S., Hagiwara, D., Lefevre, A., Barteczko, L., Boury-Jamot, B., Bellanger, B., Abatis, M., Da Silva Gouveia, M., Benusiglio, D., Eliava, M., Rozov, A., Weinsanto, I., Knobloch-Bollmann, H.S., Kirchner, M.K., Roy, R.K., Wang, H., Pertin, M., Inquimbert, P., Pitzer, C., Siemens, J., Goumon, Y., Boutrel, B., Lamy, C.M., Decosterd, I., Chatton, J.Y., Rouach, N., Young, W.S., Stern, J.E., Poisbeau, P., Stoop, R., Darbon, P., Grinevich, V., Charlet, A. (2021). Astrocytes mediate the effect of oxytocin in the central amygdala on neuronal activity and affective states in rodents. Nat Neurosci, 24, 529-541. [CrossRef] [PubMed] [Google Scholar]
- Wang, P., Qin, D., Wang, Y.F. (2017). Oxytocin rapidly changes astrocytic GFAP plasticity by differentially modulating the expressions of pERK 1/2 and protein kinase A. Front Mol Neurosci, 10, 262. [CrossRef] [PubMed] [Google Scholar]
- Wang, Y.F., Hatton, G.I. (2006). Mechanisms underlying oxytocin-induced excitation of supraoptic neurons: prostaglandin mediation of actin polymerization. J Neurophysiol, 95, 3933-3947. [CrossRef] [PubMed] [Google Scholar]
- Wang, Y.F., Hatton, G.I. (2007). Interaction of extracellular signal-regulated protein kinase 1/2 with actin cytoskeleton in supraoptic oxytocin neurons and astrocytes: role in burst firing. J Neurosci, 27, 13822-13834. [CrossRef] [PubMed] [Google Scholar]
- Wang, Y.F., Hatton, G.I. (2009). Astrocytic plasticity and patterned oxytocin neuronal activity: dynamic interactions. J Neurosci, 29, 1743-1754. [CrossRef] [PubMed] [Google Scholar]
- Young, L.J., Wang, Z. (2004). The neurobiology of pair bonding. Nat Neurosci, 7, 1048-1054. [CrossRef] [PubMed] [Google Scholar]
- Young, W.S., Song, J. (2020). Characterization of oxytocin receptor expression within various neuronal populations of the mouse dorsal hippocampus. Front Mol Neurosci, 13, 40. [CrossRef] [PubMed] [Google Scholar]
- Zatkova, M., Bacova, Z., Puerta, F., Lestanova, Z., Alanazi, M., Kiss, A., Reichova, A., Castejon, A.M., Ostatnikova, D., Bakos, J. (2018). Projection length stimulated by oxytocin is modulated by the inhibition of calcium signaling in U-87MG cells. J Neural Transm, 125, 1847-1856. [CrossRef] [PubMed] [Google Scholar]
- Zhang, J.M., Wang, H.K., Ye, C.Q., Ge, W., Chen, Y., Jiang, Z.L., Wu, C.P., Poo, M.M., Duan, S. (2003). ATP released by astrocytes mediates glutamatergic activity-dependent heterosynaptic suppression. Neuron, 40, 971-982. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Baudon, A., Clauss Creusot, E., et Charlet, A. (2022). Rôle émergent des astrocytes dans le contrôle des circuits neuronaux et des fonctions cérébrales modulés par l’ocytocine. Biologie Aujourd’hui, 216, 155-165
Liste des figures
 |
Figure 1 Effets de l’activation du récepteur ocytocinergique astrocytaire. (A) En haut : L’ocytocine module la gliotransmission. En bas à gauche : L’ocytocine induit des changements morphologiques astrocytaires. En bas à droite : Nous émettons l’hypothèse selon laquelle les deux mécanismes pourraient se produire en même temps. (B) Interactions astrocytes-neurones en conditions normales (B1) ou pathologiques (rétraction des prolongements astrocytaires), (B2) (voir le texte pour plus de détails). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


