| Numéro |
Biologie Aujourd'hui
Volume 212, Numéro 1-2, 2018
|
|
|---|---|---|
| Page(s) | 27 - 33 | |
| Section | La signalisation dans des compartiments intracellulaires : un nouveau paradigme | |
| DOI | https://doi.org/10.1051/jbio/2018016 | |
| Publié en ligne | 26 octobre 2018 | |
Article
L’EGFR nucléaire : un nouveau mode de signalisation dans les cancers
Nuclear EGFR: a new mode of oncogenic signalling in cancer
« Epigénétique, maladies chroniques et cancer », INSERM U1209, CNRS UMR 5309, Université Grenoble Alpes, Institut pour l’Avancée des Biosciences (IAB),
Allée des Alpes,
38700
La Tronche Cedex 09, France
* Auteur correspondant : sylvie.gazzeri@univ-grenoble-alpes.fr
Reçu :
14
Juin
2018
L’EGFR (Epidermal Growth Factor Receptor) est l’une des molécules les plus étudiées en biologie. Depuis son identification précoce et son clonage jusqu’à la découverte de son rôle dans le cancer, ces analyses ont été à la pointe de notre compréhension des récepteurs à activité tyrosine kinase et des signaux cellulaires qui médient l’homéostasie, mais qui, une fois surexprimés, facilitent la tumorigenèse. Si les fonctions biologiques de l’EGFR impliquent traditionnellement l’activation d’un réseau de signalisation à partir de la membrane plasmique, un autre mode de signalisation de l’EGFR a été mis en évidence dans lequel l’EGFR est transporté après endocytose de la surface cellulaire vers le noyau, où il agit comme régulateur transcriptionnel, transmet des signaux et intervient dans de multiples fonctions biologiques, notamment la prolifération cellulaire, la progression tumorale, la réparation et la réplication de l’ADN et la résistance aux thérapies anti-cancéreuses. Dans cette revue nous résumerons les connaissances actuelles sur le réseau de signalisation nucléaire de l’EGFR, en nous attachant à son acheminement au noyau, ses fonctions dans le noyau et à l’influence de celles-ci sur la progression du cancer, la survie et la réponse au traitement.
Abstract
EGFR (Epidermal Growth Factor Receptor) is one of the most studied molecules in biology. From its early identification and cloning to the discovery of its role in cancer, it has been at the forefront of our understanding of Receptor Tyrosine Kinase (RTK) and cell signals that induce homeostasis, but when overexpressed, facilitate tumorigenesis. While the biological functions of EGFR traditionally involve the activation of a signaling network from the plasma membrane that includes activation of the RAS/MAPK/ERK, PI3K/AKT and STATS pathways, a new mode of EGFR signaling has been progressively decoded in which membrane-associated EGFR is transported after endocytosis from cell surface to the nucleus through endocytosis, retrograde trafficking to the Golgi, the endoplasmic reticulum and the inner nuclear membrane through a series of proteic interactions. In the nucleus, EGFR acts as a transcriptional regulator, a kinase and a physical interactor, transmits signals and is involved in multiple biological functions, including cell proliferation, tumor progression, DNA repair and replication, and resistance to cancer therapies. In this review, we will summarize current knowledge of the EGFR nuclear signaling network, including how it is delivered to the nucleus, the functions it serves in the nucleus and how these functions affect cancer progression, survival and the response to treatment.
Mots clés : EGFR / signalisation nucléaire / tumorigenèse / résistance aux traitements
Key words: EGFR / nuclear signalling / tumorigenesis / resistance to treatments
© Société de Biologie, 2018
Abréviations
ATRS : Séquences riches en résidus A/T
COPI : Complexe protéique d’enveloppe I
EGFR : Epidermal Growth Factor Receptor
INM : Membrane nucléaire interne
NLS : Séquences tripartites de localisation nucléaire
PCNA : Antigène nucléaire prolifératif
RTK : Récepteurs à activité Tyrosine Kinase
TIF2 : Facteur de transcription intermédiaire 2
Vps34 : Vacuolar protein sorting
Introduction
Les Récepteurs à activité Tyrosine Kinase (RTK) sont des récepteurs transmembranaires positionnés à la surface des cellules qui détectent la présence de facteurs de croissance apparentés, produits dans le milieu extracellulaire. La liaison du ligand à son récepteur stimule la dimérisation du récepteur, son activité tyrosine kinase et son autophosphorylation (Schlessinger, 2000). Les RTK autophosphorylés activent un réseau de voies de signalisation qui relaient l’information de la surface de la cellule vers le noyau et autres compartiments intracellulaires, et qui jouent un rôle important dans le contrôle des processus cellulaires les plus fondamentaux comme la prolifération et la différenciation, le cycle cellulaire, le métabolisme et la survie cellulaires (Blume-Jensen & Hunter, 2001 ; Lemmon & Schlessinger, 2010). Les complexes facteur de croissance/RTK formés à la membrane plasmique sont rapidement internalisés par endocytose et les RTK sont ensuite recyclés à la membrane plasmique ou adressés vers le lysosome pour être dégradés (von Zastrow & Sorkin, 2007 ; Sorkin & Goh, 2009 ; Zwang & Yarden, 2009). Dans certains cas, la persistance d’une signalisation à partir des endosomes a été démontrée (Carpenter 2000 ; Sorkin & von Zastrow, 2002). À côté de ce mécanisme bien établi de signalisation des RTK, on a décrit une communication directe entre la membrane et le noyau via une translocation nucléaire des RTK dépendante ou non du ligand, impliquant généralement l’isolement à partir de la surface cellulaire d’un fragment du domaine intracellulaire du récepteur, qui est ensuite transloqué jusqu’au noyau avec des conséquences fonctionnelles potentielles (Carpenter & Liao, 2013). Cependant, dans quelques cas comme dans celui du récepteur à l’EGF (EGFR), une translocation nucléaire du récepteur intact (non clivé) a été rapportée. C’est à ce dernier aspect que cette revue est dédiée.
Mécanismes de translocation nucléaire de l’EGFR
Différents travaux suggèrent l’existence d’une nouvelle voie par laquelle l’EGFR présent à la surface des cellules est internalisé dans les endosomes précoces puis transporté vers le noyau. Si la séquence exacte des mécanismes moléculaires impliqués dans ce processus n’a pas encore été totalement décryptée, un certain nombre d’éléments ont néanmoins été décrits. L’EGFR membranaire internalisé dans des vésicules d’endosomes précoces utilise un transport rétrograde via l’appareil de Golgi et le réticulum endoplasmique (RE) pour rejoindre le noyau. Ce mécanisme de transport rétrograde du Golgi vers le RE implique le complexe protéique d’enveloppe I (COPI) (Wang et al., 2010a). Il a aussi été rapporté qu’en réponse à l’EGF, l’EGFR se déplace vers le Golgi par un mouvement dépendant des microtubules en interagissant avec la dynéine, puis sa fusion avec le Golgi est médiée par la syntaxine 6 (Du et al., 2014). Récemment, notre équipe a montré que la protéine Vps34 (Vacuolar protein sorting), qui joue un rôle central dans la formation des endosomes précoces, est impliquée dans le transport nucléaire de l’EGFR en réponse à l’EGF dans des cellules tumorales pulmonaires (Dayde et al., 2016). Des séquences tripartites de localisation nucléaire (NLS), différentes des traditionnelles NLS mono- et bipartites, ont été localisées dans la région juxtamembranaire de l’EGFR (Lo et al., 2005a). Ces séquences NLS et l’importine β1 sont impliquées dans la translocation nucléaire de l’EGFR (Lo et al., 2006), selon un mécanisme par lequel l’importine β1 forme un complexe avec les molécules porteuses de NLS et induit la translocation nucléaire à travers la liaison aux nucléoporines des complexes des pores nucléaires. L’EGFR est retrouvé au niveau de la membrane nucléaire interne (INM). Certains travaux indiquent que l’EGFR pourrait être adressé à l’INM par un mécanisme nommé INTERNET pour Integral trafficking from the ER to the Nuclear Envelope Transport (Wang et al., 2010a, 2010b), et que l’EGFR serait extrait de la bicouche lipidique de l’INM vers le nucléoplasme par un processus impliquant un rôle jusqu’alors inconnu du translocon sec61β (Wang et al., 2010c). Les premiers évènements au niveau de la membrane plasmique qui pourraient servir de signaux initiateurs critiques pour le mouvement de l’EGFR vers le noyau sont encore mal compris mais différents travaux suggèrent que la phosphorylation de l’EGFR par les kinases Src, PKCɛ et AKT influence la translocation nucléaire de l’EGFR (Wanner et al., 2008 ; Huang et al., 2011 ; Iida et al., 2013).
Fonctions moléculaires et biologiques de l’EGFR nucléaire
Un nombre croissant d’études rapporte que l’EGFR nucléaire présente différentes fonctions moléculaires et biologiques (Figure 1).
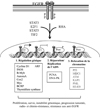 |
Figure 1 Fonctions nucléaires de l’EGFR. Dans le noyau, l’EGFR fonctionne comme un co-régulateur transcriptionnel pour stimuler ou inhiber la transcription de ses gènes cibles. Certains facteurs de transcription (FT) comme STAT3, STAT5, E2F1 et TIF2 ou autres protéines comme la RNA Hélicase A (RHA) ont été identifiés comme des partenaires de l’EGFR nucléaire dans ce contexte. L’EGFR nucléaire peut aussi activer et stabiliser PCNA et DNA-PK pour favoriser la réplication et la réparation de l’ADN respectivement. Enfin, l’EGFR nucléaire pourrait interagir avec certains facteurs protéiques pour induire une relaxation de la chromatine. L’ensemble de ces fonctions permet à l’EGFR nucléaire de stimuler la prolifération et la survie cellulaire, d’induire une instabilité génomique, de favoriser la progression tumorale et de rendre les cellules résistantes à la radiothérapie, la chimiothérapie et aux thérapies ciblées anti-EGFR (Cetuximab, gefitinib). |
Régulation transcriptionnelle
Différents travaux montrent que l’EGFR nucléaire a un impact majeur dans la régulation transcriptionnelle de gènes qui sont potentiellement différents de ceux activés par l’EGFR membranaire. L’EGFR contient dans sa région C-terminale une activité transactivatrice intrinsèque (Lin et al., 2001). Cependant, comme l’EGFR ne semble pas posséder de domaine de liaison à l’ADN, sa capacité à réguler la transcription des gènes nécessite l’intervention de facteurs nucléaires. Le promoteur de la cycline D1 est la première cible génomique de l’EGFR nucléaire à avoir été identifiée. En réponse à l’EGF, l’EGFR se transloque vers le noyau où il se lie à une séquence riche en résidus A/T (ATRS) dans la région proximale du promoteur de la cycline D1 et stimule son expression dans les cellules cancéreuses (Lin et al., 2001). Ces travaux ont représenté le premier lien entre EGFR nucléaire et prolifération cellulaire. Par la suite, il a été montré que la RNA Hélicase A (RHA) se lie à l’EGFR nucléaire et que le complexe EGFR/RHA active la transcription de la cycline D1 via l’interaction de RHA avec les séquences ATRS (Huo et al., 2010). Une interaction de Muc1 avec l’EGFR nucléaire stimulerait également l’expression de la cycline D1 dans des modèles cellulaires de tumeurs mammaires (Bitler et al., 2010). Enfin, dans les carcinomes du nasopharynx, la protéine membranaire LMP1 est capable d’activer l’interaction de l’EGFR nucléaire avec le facteur de transcription intermédiaire 2 (TIF2) pour réguler l’expression de la cycline D1 (Shi et al., 2012). L’EGFR nucléaire se lie aussi aux séquences ATRS d’autres promoteurs comme B-Myb (Hanada et al., 2006), iNOS (Lo et al., 2005a), Aurora-A (Hung et al., 2011) et COX-2 (Lo et al., 2010), qui sont impliqués dans la tumorigenèse et l’instabilité chromosomique. Une interaction de l’EGFR nucléaire avec les facteurs de transcription E2F1, STAT3 ou STAT5A a été décrite dans ce contexte. Par ailleurs, dans des cellules cancéreuses, les récepteurs nucléaires EGFR et HER2 se lient au promoteur du gène de la thymidylate synthase et activent sa transcription (Kim et al., 2009). Cette interaction est inhibée par le lapatinib, un inhibiteur de l’activité tyrosine kinase de l’EGFR et de HER2. Dans des cellules mammaires résistantes au gefitinib, l’EGFR nucléaire cible plusieurs séquences ATRS sur le promoteur de BRCP, qui est impliqué dans la chimiorésistance (Huang et al., 2011). Enfin, un complexe nucléaire comprenant l’EGFR, la kinase c-Src et STAT3, est retrouvé sur le promoteur de c-myc dans des cellules de cancer du pancréas, suggérant que ce complexe hétéromérique pourrait réguler l’expression du gène c-myc (Jaganathan et al., 2011). Des modifications post-traductionnelles de l’EGFR semblent réguler son activité transcriptionnelle. Ainsi, une étude a montré que la sumoylation de l’EGFR nucléaire par les sumoylases SUMO-1 et SUMO-2/3 stimule sa capacité à activer la transcription génique (Packham et al., 2015). L’ensemble de ces travaux identifie l’EGFR nucléaire comme un activateur transcriptionnel. Récemment, nous avons montré dans des modèles cellulaires de tumeurs pulmonaires que l’EGF induit la translocation nucléaire de l’EGFR, stimule sa fixation sur le promoteur du gène suppresseur de tumeur ARF et réprime sa transcription, conduisant à une amélioration de la survie cellulaire (Dayde et al., 2016). Cette étude représente la première démonstration de la capacité de l’EGFR nucléaire à réprimer la transcription génique. Très récemment, Dittmann et co-auteurs (2017) ont démontré que l’EGFR nucléaire était aussi capable de réguler la stabilité et la traduction des ARN messagers.
Protéine kinase
Dans le noyau, l’EGFR conserve son activité tyrosine kinase. L’EGFR nucléaire se lie à l’antigène nucléaire prolifératif (PCNA) et induit sa phosphorylation, ce qui stabilise la protéine PCNA conduisant à la réplication de l’ADN et à la réparation des dommages de l’ADN (Wang et al., 2006).
Complexes protéine/protéine
Différents travaux montrent qu’en réponse à l’irradiation par les UV ou le traitement par le cisplatine, l’activation des voies de dommage de l’ADN stimule l’interaction entre l’EGFR nucléaire et la protéine kinase dépendante de l’ADN (DNA-PK), qui joue un rôle central dans la réparation des cassures doubles brins de l’ADN (Dittmann et al., 2005a ; Hsu et al., 2009 ; Liccardi et al., 2011). Il a aussi été décrit que les radiations peuvent induire une interaction de l’EGFR nucléaire avec plusieurs protéines impliquées dans la relaxation et la réparation de l’ADN dont ATM, KAP1, PML et H3-K9, suggérant que l’EGFR nucléaire régule l’accès à la chromatine et sa réparation (Dittmann et al., 2011).
EGFR nucléaire : un indicateur de mauvais résultat clinique chez les patients porteurs de cancer
Si l’expression nucléaire de l’EGFR a été initialement rapportée dans les tissus normaux prolifératifs (Marti et al., 1991), il existe maintenant un certain nombre d’études qui soulignent son implication dans les cancers. L’expression nucléaire de l’EGFR a été initialement observée par immunohistochimie (IHC) en 1994 dans les cancers du col utérin et de la vessie. Parmi 234 cancers transitionnels de la vessie, 31 % présentaient une expression nucléaire de l’EGFR (Lipponen & Eskelinen, 1994). Celle-ci était associée à un stade avancé ainsi qu’à une augmentation de la fréquence mitotique et de la prolifération cellulaire. Une expression nucléaire de l’EGFR était aussi détectée dans 37 % de biopsies de cancers du col utérin (Tervahauta et al., 1994). Par la suite, différentes études ont décrit l’EGFR nucléaire comme un indicateur de mauvais pronostic. Sur une cohorte de 130 cancers du sein, 37 % présentaient une expression nucléaire positive de l’EGFR nucléaire inversement corrélée à la survie des patientes et associée à deux marqueurs de prolifération cellulaire, Ki-67 et cycline D1 (Lo et al., 2005b). Ces résultats ont été validés par la suite sur une série de 113 tumeurs mammaires canalaires invasives où une expression nucléaire de l’EGFR a été détectée dans 40 % des échantillons et corrélée à un mauvais pronostic (Hadzisejdic et al., 2010). Dans une autre cohorte de 221 cancers de l’ovaire, 28 % présentaient un haut niveau d’expression nucléaire de l’EGFR détectable par IHC et il y avait une corrélation inverse entre ces hauts niveaux et la survie globale (Xia et al., 2009). De même, sur une série de 95 carcinomes oropharyngés, l’expression nucléaire détectée dans 49 % de tissus tumoraux était associée avec une survie sans progression tumorale (Psyrri et al., 2005). Lo et al. (2005b) ont décrit l’expression nucléaire de l’EGFR dans 24 % d’une série de 37 carcinomes squameux oraux. Dans cette cohorte, une forte expression nucléaire de l’EGFR était associée avec une faible survie globale par rapport aux patients n’ayant que très peu ou pas d’EGFR nucléaire. Plus récemment, une étude, utilisant un microarray comprenant 104 cas de carcinomes de vésicule biliaire, a montré une expression nucléaire de l’EGFR dans 24 % des tissus. De hauts niveaux d’EGFR nucléaire ont été associés à un stade avancé et une invasion vasculaire (Li et al., 2012). L’expression nucléaire de l’EGFR a aussi été retrouvée dans 26 % d’une série de 88 carcinomes pulmonaires non à petites cellules et corrélée à une diminution de la survie globale (Traynor et al., 2013). Très récemment Bazzani et co-auteurs (2018) ont mis en évidence une signature transcriptionnelle de l’EGFR nucléaire dans les cancers du poumon, et ont montré que cette signature moléculaire est associée avec un mauvais pronostic. L’ensemble de ces données suggère que l’EGFR nucléaire pourrait représenter un indicateur pronostic de mauvais résultat clinique, et souligne la possibilité pour l’EGFR nucléaire de contrôler des processus physiologiques contribuant à l’agressivité des cellules.
EGFR nucléaire et résistance thérapeutique
Différentes études montrent que l’EGFR nucléaire contribue à la résistance acquise par les tumeurs en réponse aux radiations, à la chimiothérapie et aux thérapies ciblées anti-EGFR.
Résistance aux radiations
Plusieurs travaux de la littérature rapportent que la radiothérapie induit la translocation nucléaire de l’EGFR (Liccardi et al., 2011 ; Dittmann et al., 2005a, 2005b, 2007, 2008a, 2008b, 2010, 2011 ; Wanner et al., 2008). Dans le noyau, l’EGFR forme des complexes avec la DNA-PK et la stabilise, conduisant à la réparation des liaisons doubles brins de l’ADN induites en réponse aux radiations (Dittmann et al., 2005a, 2005b ; Wanner et al., 2008). Les radiations induisent aussi l’association de l’EGFR nucléaire avec différentes protéines qui jouent un rôle dans la relaxation et la réparation de l’ADN comme ATM, KAP1, PML et H3-K9, suggérant que l’EGFR nucléaire induit la résistance aux radiations en modulant l’accès à la chromatine (Dittmann et al., 2011). Face à cet impact négatif de l’EGFR nucléaire sur la sensibilité des tumeurs à la radiothérapie, d’autres études montrent que l’EGFR nucléaire protège les cellules normales des dommages à l’ADN causés par les ultraviolets et les irradiations γ (Xu et al., 2009). Les mécanismes exacts par lesquels l’EGFR nucléaire facilite la réparation des lésions de l’ADN dans ce contexte sont largement inconnus, mais il a été montré que l’EGFR nucléaire s’associe avec p53 et MDC1, une protéine essentielle pour le recrutement des points focaux impliqués dans la réparation de l’ADN (Dittmann et al., 2008).
Résistance à la chimiothérapie
L’utilisation de différentes constructions génétiques basées sur la génération de mutants de l’EGFR dépourvus ou non de leurs séquences NLS suggère fortement que la translocation nucléaire de l’EGFR est impliquée dans la résistance au cisplatine (Hsu et al., 2009). En accord avec ces données, Liccardi et co-auteurs (2011) ont montré une augmentation de l’interaction de l’EGFR avec la DNA-PK dans le noyau de cellules tumorales pulmonaires résistantes au cisplatine. Ainsi, ces études indiquent un rôle de l’EGFR nucléaire dans la résistance au cisplatine, probablement à travers sa capacité à interagir avec la DNA-PK.
Résistance aux thérapies ciblées anti-EGFR
Différentes études décrivent un rôle de l’EGFR nucléaire dans la résistance aux thérapies ciblées anti-EGFR. Le cetuximab (anti-corps anti-EGFR) induit la translocation nucléaire de l’EGFR (Liao & Carpenter, 2009), et l’accumulation nucléaire de l’EGFR s’observe dans des lignées cellulaires de tumeurs pulmonaires ayant acquis une résistance au cetuximab (Li et al., 2009). La translocation nucléaire de l’EGFR est induite par l’activation de la famille des kinases Src (SFK), tandis que le traitement des cellules par le dasatinib, un inhibiteur de Src, diminue l’expression de l’EGFR dans le noyau, induit sa relocalisation à la membrane plasmique et resensibilise les cellules résistantes au cetuximab (Li et al., 2009 ; Wheeler et al., 2009). Très récemment, Brand et co-auteurs (2017) ont décrit un rôle du récepteur AXL dans l’accumulation nucléaire de l’EGFR dépendante de SFK dans des cellules tumorales pulmonaires résistantes au cetuximab. Une localisation périnucléaire et nucléaire de l’EGFR est aussi observée dans des cellules tumorales résistantes au gefitinib (inhibiteur de l’activité tyrosine kinase de l’EGFR, EGFR-TKI) (Kwak et al., 2005 ; Nishimura et al., 2008). Il a été montré dans un modèle cellulaire de tumeur mammaire que la localisation nucléaire de l’EGFR induite par le gefitinib dépend de la voie AKT (Huang et al., 2011). L’inhibition d’AKT prévient la translocation nucléaire de l’EGFR et resensibilise les cellules au gefitinib. Bien que très peu de données soient disponibles sur les mécanismes moléculaires par lesquels l’EGFR nucléaire contribue à la résistance induite par les thérapies anti-EGFR, son rôle dans la régulation transcriptionnelle semble important. Dans les tumeurs mammaires, l’EGFR nucléaire stimule la transcription du transporteur BCRP/ABCG2, favorisant l’élimination du gefitinib (Huang et al., 2011). Dans les tumeurs pulmonaires, le cetuximab active la transcription des gènes tumorigéniques B-Myb et iNOS (Iida et al., 2013).
Conclusions
Si les fonctions oncogéniques de l’EGFR impliquent traditionnellement l’activation d’un réseau de signalisation à partir de la membrane plasmique, il est maintenant établi que l’EGFR exerce aussi des fonctions nucléaires. Depuis sa première identification comme facteur de transcription, l’EGFR a conduit à la découverte de plusieurs autres RTK dans le noyau comme HER2, HER3, HER4, IGF1R, cMET, etc. (Carpenter & Liao, 2013). Cependant, il reste beaucoup à faire pour appréhender le rôle des RTK nucléaires dans un contexte biologique normal et dans une situation pathologique comme le cancer. La corrélation de l’expression nucléaire de l’EGFR avec une mauvaise survie globale dans plusieurs cancers, son association avec la résistance à différents traitements et son implication dans la régulation de gènes nécessaires à la prolifération cellulaire suggèrent fortement que la localisation nucléaire de l’EGFR est impliquée dans l’étiologie des cancers et fournit les bases du développement de nouveaux traitements pour cibler cliniquement ce mode de signalisation dans le futur.
Références
- Bazzani, L., Donnini, S., Giachetti, A., Christofori, G., Ziche, M. (2018). PGE2 mediates EGFR internalization and nuclear translocation via caveolin endocytosis promoting its transcriptional activity and proliferation in human NSCLC cells. Oncotarget, 9, 14939-14958. [PubMed] [Google Scholar]
- Bitler, B.G., Goverdhan, A., Schroeder, J.A. (2010). MUC1 regulates nuclear localization and function of the epidermal growth factor receptor. J Cell Sci, 123, 1716-1723. [Google Scholar]
- Blume-Jensen, P., Hunter, T. (2001). Oncogenic kinase signalling. Nature, 411, 355-365. [CrossRef] [PubMed] [Google Scholar]
- Brand, T.M., Iida, M., Corrigan, K.L., Braverman, C.M., Coan, J.P., Flanigan, B.G., Stein, A.P., Salgia, R., Rolff, J., Kimple, R.J., Wheeler, D.L. (2017). The receptor tyrosine kinase AXL mediates nuclear translocation of the epidermal growth factor receptor. Sci Signal, 10, 460. [Google Scholar]
- Carpenter, G. (2000). The EGF receptor: a nexus for trafficking and signaling. Bioessays, 22, 697-707. [CrossRef] [PubMed] [Google Scholar]
- Carpenter, G., Liao, H.J. (2013). Receptor tyrosine kinases in the nucleus. Cold Spring Harb Perspect Biol, 5, a008979. [CrossRef] [PubMed] [Google Scholar]
- Dayde, D., Guerard, M., Perron, P., Hatat, A.S., Barrial, C., Eymin, B., Gazzeri, S. (2016). Nuclear trafficking of EGFR by Vps34 represses Arf expression to promote lung tumor cell survival. Oncogene, 35, 3986-3994. [Google Scholar]
- Dittmann, K., Mayer, C., Fehrenbacher, B., Schaller, M., Raju, U., Milas, L., Chen, D.J., Kehlbach, R., Rodemann, H.P. (2005a). Radiation-induced epidermal growth factor receptor nuclear import is linked to activation of DNA-dependent protein kinase. J Biol Chem, 280, 31182-31189. [CrossRef] [PubMed] [Google Scholar]
- Dittmann, K., Mayer, C., Rodemann, H.P. (2005b). Inhibition of radiation-induced EGFR nuclear import by C225 (Cetuximab) suppresses DNA-PK activity. Radiother Oncol, 76, 157-161. [CrossRef] [PubMed] [Google Scholar]
- Dittmann, K., Mayer, C., Wanner, G., Kehlbach, R., Rodemann, H.P. (2007). The radioprotector O-phospho-tyrosine stimulates DNA-repair via epidermal growth factor receptor- and DNA-dependent kinase phosphorylation. Radiother Oncol, 84, 328-334. [CrossRef] [PubMed] [Google Scholar]
- Dittmann, K., Mayer, C., Kehlbach, R., Rodemann, H.P. (2008a). Radiation-induced caveolin-1 associated EGFR internalization is linked with nuclear EGFR transport and activation of DNA-PK. Mol Cancer , 7, 69. [CrossRef] [PubMed] [Google Scholar]
- Dittmann, K., Mayer, C., Kehlbach, R., Rodemann, H.P. (2008b). The radioprotector Bowman-Birk proteinase inhibitor stimulates DNA repair via epidermal growth factor receptor phosphorylation and nuclear transport. Radiother Oncol , 86, 375-382. [CrossRef] [PubMed] [Google Scholar]
- Dittmann, K., Mayer, C., Fehrenbacher, B., Schaller, M., Kehlbach, R., Rodemann, H.P. (2010). Nuclear EGFR shuttling induced by ionizing radiation is regulated by phosphorylation at residue Thr654. FEBS Lett , 584, 3878-3884. [CrossRef] [PubMed] [Google Scholar]
- Dittmann, K., Mayer, C., Fehrenbacher, B., Schaller, M., Kehlbach, R., Rodemann, H.P. (2011). Nuclear epidermal growth factor receptor modulates cellular radio-sensitivity by regulation of chromatin access. Radiother Oncol , 99, 317-322. [CrossRef] [PubMed] [Google Scholar]
- Dittmann, K., Mayer, C., Czemmel, S., Huber, S.M., Rodemann, H.P. (2017). New roles for nuclear EGFR in regulating the stability and translation of mRNAs associated with VEGF signaling. PLoS One , 12, e0189087. [CrossRef] [PubMed] [Google Scholar]
- Du, Y., Shen, J., Hsu, J.L., Han, Z., Hsu, M.C., Yang, C.C., Kuo, H.P., Wang, Y.N., Yamaguchi, H., Miller, S.A., Hung, M.C. (2014). Syntaxin 6-mediated Golgi translocation plays an important role in nuclear functions of EGFR through microtubule-dependent trafficking. Oncogene , 33, 756-770. [Google Scholar]
- Hadzisejdic, I., Mustac, E., Jonjic, N., Petkovic, M., Grahovac, B. (2010). Nuclear EGFR in ductal invasive breast cancer: correlation with cyclin-D1 and prognosis. Mod Pathol , 23, 392-403. [CrossRef] [PubMed] [Google Scholar]
- Hanada, N., Lo, H.W., Day, C.P., Pan, Y., Nakajima, Y., Hung, M.C. (2006). Co-regulation of B-Myb expression by E2F1 and EGF receptor. Mol Carcinog , 45, 10-17. [CrossRef] [PubMed] [Google Scholar]
- Hsu, S.C., Miller, S.A., Wang, Y., Hung, M.C. (2009). Nuclear EGFR is required for cisplatin resistance and DNA repair. Am J Transl Res , 1, 249-258. [PubMed] [Google Scholar]
- Huang, W.C., Chen, Y.J., Li, L.Y., Wei, Y.L., Hsu, S.C., Tsai, S.L., Chiu, P.C., Huang, W.P., Wang, Y.N., Chen, C.H., Chang, W.C., Chang, W.C., Chen, A.J., Tsai, C.H., Hung, M.C. (2011). Nuclear translocation of epidermal growth factor receptor by Akt-dependent phosphorylation enhances breast cancer-resistant protein expression in gefitinib-resistant cells. J Biol Chem, 286, 20558-20568. [CrossRef] [PubMed] [Google Scholar]
- Hung, L.Y., Tseng, J.T., Lee, Y.C., Xia, W., Wang, Y.N., Wu, M.L., Chuang, Y.H., Lai, C.H., Chang, W.C. (2011). Nuclear epidermal growth factor receptor (EGFR) interacts with signal transducer and activator of transcription 5 (STAT5) in activating Aurora-A gene expression. Nucleic Acids Res , 36, 4337-4351 [Google Scholar]
- Huo, L., Wang, Y.N., Xia, W., Hsu, S.C., Lai, C.C., Li, L.Y., Chang, W.C., Wang, Y., Hsu, M.C., Yu, Y.L., Huang, T.H., Ding, Q., Chen, C.H., Tsai, C.H., Hung, M.C. (2010). RNA helicase A is a DNA-binding partner for EGFR-mediated transcriptional activation in the nucleus. Proc Natl Acad Sci USA , 107, 16125-16130. [CrossRef] [Google Scholar]
- Iida, M., Brand, T.M., Campbell, D.A., Li, C., Wheeler, D.L. (2013). Yes and Lyn play a role in nuclear translocation of the epidermal growth factor receptor. Oncogene , 32, 759-767. [Google Scholar]
- Jaganathan, S., Yue, P., Paladino, D.C., Bogdanovic, J., Huo, Q., Turkson, J. (2011). A functional nuclear epidermal growth factor receptor, SRC and Stat3 heteromeric complex in pancreatic cancer cells. PLoS One , 6, e19605. [CrossRef] [PubMed] [Google Scholar]
- Kim, H.P., Yoon, Y.K., Kim, J.W., Han, S.W., Hur, H.S., Park, J., Lee, J.H., Oh, D.Y., Im, S.A., Bang, Y.J., Kim, T.Y. (2009). Lapatinib, a dual EGFR and HER2 tyrosine kinase inhibitor, downregulates thymidylate synthase by inhibiting the nuclear translocation of EGFR and HER2. PLoS One, 4, e5933. [CrossRef] [Google Scholar]
- Kwak, E.L., Sordella, R., Bell, D.W., Godin-Heymann, N., Okimoto, R.A., Brannigan, B.W., Harris, P.L., Driscoll, D.R., Fidias, P., Lynch, T.J., Rabindran, S.K., McGinnis, J.P., Wissner, A., Sharma, S.V., Isselbacher, K.J., Settleman, J., Haber, D.A. (2005). Irreversible inhibitors of the EGF receptor may circumvent acquired resistance to gefitinib. Proc Natl Acad Sci USA , 102, 7665-7670. [CrossRef] [Google Scholar]
- Lemmon, M.A., Schlessinger, J. (2010). Cell signaling by receptor tyrosine kinases. Cell , 141, 1117-1134. [CrossRef] [PubMed] [Google Scholar]
- Li, C., Iida, M., Dunn, E.F., Ghia, A.J., Wheeler, D.L. (2009). Nuclear EGFR contributes to acquired resistance to cetuximab. Oncogene , 28, 3801-3813. [Google Scholar]
- Li, C.F., Fang, F.M., Wang, J.M., Tzeng, C.C., Tai, H.C., Wei, Y.C., Li, S.H., Lee, Y.T., Wang, Y.H., Yu, S.C., Shiue, Y.L., Chu, P.Y., Wang, W.L., Chen, L.T., Huang, H.Y. (2012). EGFR nuclear import in gallbladder carcinoma: nuclear phosphorylated EGFR upregulates iNOS expression and confers independent prognostic impact. Ann Surg Oncol , 19, 443-454. [CrossRef] [PubMed] [Google Scholar]
- Liao, H.J., Carpenter, G. (2009). Cetuximab/C225-induced intracellular trafficking of epidermal growth factor receptor. Cancer Res , 69, 6179-6183. [Google Scholar]
- Liccardi, G., Hartley, J.A., Hochhauser, D. (2011). EGFR nuclear translocation modulates DNA repair following cisplatin and ionizing radiation treatment. Cancer Res , 71, 1103-1114. [Google Scholar]
- Lin, S.Y., Makino, K., Xia, W., Matin, A., Wen, Y., Kwong, K.Y., Bourguignon, L., Hung, M.C. (2001). Nuclear localization of EGF receptor and its potential new role as a transcription factor. Nat Cell Biol , 3, 802-808. [CrossRef] [PubMed] [Google Scholar]
- Lipponen, P., Eskelinen, M. (1994). Expression of epidermal growth factor receptor in bladder cancer as related to established prognostic factors, oncoprotein (c-erbB-2, p53) expression and long-term prognosis. Br J Cancer , 69, 1120-1125. [CrossRef] [PubMed] [Google Scholar]
- Lo, H.W., Hsu, S.C., Ali-Seyed, M., Gunduz, M., Xia, W., Wei, Y., Bartholomeusz, G., Shih, J.Y., Hung, M.C. (2005a). Nuclear interaction of EGFR and STAT3 in the activation of the iNOS/NO pathway. Cancer Cell, 7, 575-589. [CrossRef] [PubMed] [Google Scholar]
- Lo, H.W., Xia, W., Wei, Y., Ali-Seyed, M., Huang, S.F., Hung, M.C. (2005b). Novel prognostic value of nuclear epidermal growth factor receptor in breast cancer. Cancer Res , 65, 338-348 [Google Scholar]
- Lo, H.W., Ali-Seyed, M., Wu, Y., Bartholomeusz, G., Hsu, S.C., Hung, M.C. (2006). Nuclear-cytoplasmic transport of EGFR involves receptor endocytosis, importin beta1 and CRM1. J Cell Biochem, 98, 1570-1583. [CrossRef] [Google Scholar]
- Lo, H.W., Cao, X., Zhu, H., Ali-Osman, F. (2010). Cyclooxygenase-2 is a novel transcriptional target of the nuclear EGFR-STAT3 and EGFRvIII-STAT3 signaling axes. Mol Cancer Res , 8, 232-245. [CrossRef] [PubMed] [Google Scholar]
- Marti, U., Burwen, S.J., Wells, A., Barker, M.E., Huling, S., Feren, A.M., Jones, A.L. (1991). Localization of epidermal growth factor receptor in hepatocyte nuclei. Hepatology , 13, 15-20. [CrossRef] [PubMed] [Google Scholar]
- Nishimura, Y., Yoshioka, K., Bereczky, B., Itoh, K. (2008). Evidence for efficient phosphorylation of EGFR and rapid endocytosis of phosphorylated EGFR via the early/late endocytic pathway in a gefitinib-sensitive non-small cell lung cancer cell line. Mol Cancer , 7, 42. [CrossRef] [PubMed] [Google Scholar]
- Packham, S., Lin, Y., Zhao, Z., Warsito, D., Rutishauser, D., Larsson, O. (2015). The nucleus-localized epidermal growth factor receptor is SUMOylated. Biochemistry , 54, 5157-5166. [CrossRef] [PubMed] [Google Scholar]
- Psyrri, A., Yu, Z., Weinberger, P.M., Sasaki, C., Haffty, B., Camp, R., Rimm, D., Burtness, B.A. (2005). Quantitative determination of nuclear and cytoplasmic epidermal growth factor receptor expression in oropharyngeal squamous cell cancer by using automated quantitative analysis. Clin Cancer Res , 11, 5856-5862. [CrossRef] [PubMed] [Google Scholar]
- Schlessinger, J. (2000). Cell signaling by receptor tyrosine kinases. Cell , 103, 211-225. [CrossRef] [PubMed] [Google Scholar]
- Shi, Y., Tao, Y., Jiang, Y., Xu, Y., Yan, B., Chen, X., Xiao, L., Cao, Y. (2012). Nuclear epidermal growth factor receptor interacts with transcriptional intermediary factor 2 to activate cyclin D1 gene expression triggered by the oncoprotein latent membrane protein 1. Carcinogenesis , 33, 1468-1478. [CrossRef] [PubMed] [Google Scholar]
- Sorkin, A., von Zastrow, M. (2002). Signal transduction and endocytosis: close encounters of many kinds. Nat Rev Mol Cell Biol , 3, 600-614. [CrossRef] [PubMed] [Google Scholar]
- Sorkin, A., Goh, L.K. (2009). Endocytosis and intracellular trafficking of ErbBs. Exp Cell Res , 315, 683-696. [CrossRef] [PubMed] [Google Scholar]
- Tervahauta, A., Syrjanen, S., Syrjanen, K. (1994). Epidermal growth factor receptor, c-erbB-2 proto-oncogene and estrogen receptor expression in human papillomavirus lesions of the uterine cervix. Int J Gynecol Pathol , 13, 234-240. [CrossRef] [PubMed] [Google Scholar]
- Traynor, A.M., Weigel, T.L., Oettel, K.R., Yang, D.T., Zhang, C., Kim, K., Salgia, R., Iida, M., Brand, T.M., Hoang, T., Campbell, T.C., Hernan, H.R., Wheeler, D.L. (2013). Nuclear EGFR protein expression predicts poor survival in early stage non-small cell lung cancer. Lung Cancer , 81, 138-141. [CrossRef] [PubMed] [Google Scholar]
- von Zastrow, M., Sorkin, A. (2007). Signaling on the endocytic pathway. Curr Opin Cell Biol , 19, 436-445. [CrossRef] [PubMed] [Google Scholar]
- Wang, S.C., Nakajima, Y., Yu, Y.L., Xia, W., Chen, C.T., Yang, C.C., McIntush, E.W., Li, L.Y., Hawke, D.H., Kobayashi, R., Hung, M.C. (2006). Tyrosine phosphorylation controls PCNA function through protein stability. Nat Cell Biol , 8, 1359-1368. [CrossRef] [PubMed] [Google Scholar]
- Wang, Y.N., Wang, H., Yamaguchi, H., Lee, H.J., Lee, H.H., Hung, M.C. (2010a). COPI-mediated retrograde trafficking from the Golgi to the ER regulates EGFR nuclear transport. Biochem Biophys Res Commun , 399, 498-504. [Google Scholar]
- Wang, Y.N., Yamaguchi, H., Hsu, J.M., Hung, M.C. (2010b). Nuclear trafficking of the epidermal growth factor receptor family membrane proteins. Oncogene , 29, 3997-4006. [Google Scholar]
- Wang, Y.N., Yamaguchi, H., Huo, L., Du, Y., Lee, H.J., Lee, H.H., Wang, H., Hsu, J.M., Hung, M.C. (2010c). The translocon Sec61beta localized in the inner nuclear membrane transports membrane-embedded EGF receptor to the nucleus. J Biol Chem , 285, 38720-38729. [CrossRef] [PubMed] [Google Scholar]
- Wanner, G., Mayer, C., Kehlbach, R., Rodemann, H.P., Dittmann, K. (2008). Activation of protein kinase Cepsilon stimulates DNA-repair via epidermal growth factor receptor nuclear accumulation. Radiother Oncol , 86, 383-390. [CrossRef] [PubMed] [Google Scholar]
- Wheeler, D.L., Iida, M., Kruser, T.J., Nechrebecki, M.M., Dunn, E.F., Armstrong, E.A., Huang, S., Harari, P.M. (2009). Epidermal growth factor receptor cooperates with Src family kinases in acquired resistance to cetuximab. Cancer Biol Ther , 8, 696-703. [CrossRef] [PubMed] [Google Scholar]
- Xia, W., Wei, Y., Du, Y., Liu, J., Chang, B., Yu, Y.L., Huo, L.F., Miller, S., Hung, M.C. (2009). Nuclear expression of epidermal growth factor receptor is a novel prognostic value in patients with ovarian cancer. Mol Carcinog , 48, 610-617. [CrossRef] [PubMed] [Google Scholar]
- Xu, Y., Shao, Y., Zhou, J., Voorhees, J.J., Fisher, G.J. (2009). Ultraviolet irradiation-induces epidermal growth factor receptor (EGFR) nuclear translocation in human keratinocytes. J Cell Biochem , 107, 873-880. [CrossRef] [PubMed] [Google Scholar]
- Zwang, Y., Yarden, Y. (2009). Systems biology of growth factor-induced receptor endocytosis. Traffic, 10, 349-363. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Gazzeri, S. (2018). L’EGFR nucléaire : un nouveau mode de signalisation dans les cancers. Biologie Aujourd'hui, 212, 27-33
Liste des figures
 |
Figure 1 Fonctions nucléaires de l’EGFR. Dans le noyau, l’EGFR fonctionne comme un co-régulateur transcriptionnel pour stimuler ou inhiber la transcription de ses gènes cibles. Certains facteurs de transcription (FT) comme STAT3, STAT5, E2F1 et TIF2 ou autres protéines comme la RNA Hélicase A (RHA) ont été identifiés comme des partenaires de l’EGFR nucléaire dans ce contexte. L’EGFR nucléaire peut aussi activer et stabiliser PCNA et DNA-PK pour favoriser la réplication et la réparation de l’ADN respectivement. Enfin, l’EGFR nucléaire pourrait interagir avec certains facteurs protéiques pour induire une relaxation de la chromatine. L’ensemble de ces fonctions permet à l’EGFR nucléaire de stimuler la prolifération et la survie cellulaire, d’induire une instabilité génomique, de favoriser la progression tumorale et de rendre les cellules résistantes à la radiothérapie, la chimiothérapie et aux thérapies ciblées anti-EGFR (Cetuximab, gefitinib). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


