| Numéro |
Biologie Aujourd’hui
Volume 213, Numéro 3-4, 2019
|
|
|---|---|---|
| Page(s) | 131 - 140 | |
| DOI | https://doi.org/10.1051/jbio/2019023 | |
| Publié en ligne | 12 décembre 2019 | |
Article
Potentialités thérapeutiques des neurostéroïdes en psychiatrie
New therapeutic avenues for neurosteroids in psychiatric diseases
MAPREG SAS, CHU Bicêtre,
94270
Le Kremlin-Bicêtre, France
* Auteur correspondant : nicolas.froger@mapreg.com
Reçu :
26
Juin
2019
Les neurostéroïdes constituent une famille de molécules synthétisées par le cerveau, représentée par les hormones stéroïdes elles-mêmes, mais également par certains de leurs précurseurs et métabolites. Ils ont des propriétés neuroactives en stimulant des voies de signalisation non génomiques, spécifiques des neurones. Trois types de neurostéroïdes ont été identifiés selon les voies qu’ils activent, à savoir (i) les neurostéroïdes inhibiteurs, (ii) les neurostéroïdes excitateurs et (iii) les neurostéroïdes microtubulaires. Les neurostéroïdes inhibiteurs activent les récepteurs ionotropiques GABA-A, tandis que les neurostéroïdes excitateurs inhibent les courants GABAergiques et stimulent la neurotransmission glutamatergique (soit directement en activant les récepteurs NMDA, soit indirectement via la stimulation des récepteurs sigma-1). Enfin, les neurostéroïdes microtubulaires sont capables de se lier aux protéines associées aux microtubules, comme MAP2, pour favoriser la croissance des microtubules, et in fine la plasticité neuronale. En regard de leurs actions pharmacologiques, certains neurostéroïdes ont fait l’objet d’études cliniques pour le traitement de maladies psychiatriques. C’est le cas de l’alloprégnanolone, le principal neurostéroïde inhibiteur, qui a montré une efficacité dans le traitement de la dépression du post-partum et de l’anxiété. Contrairement à leurs dérivés sulfatés qui n’ont jamais été testés en clinique, la DHEA (déhydroépiandrostérone) et la prégnénolone ont montré des effets antidépresseurs et antipsychotiques. Cependant, la surproduction éventuelle d’hormones provoquée par leur métabolisation a conduit à développer des dérivés de synthèse non métabolisables. C’est le cas du composé MAP4343, un dérivé de la prégnénolone, qui a montré des effets de type antidépresseur dans différents modèles animaux. Il fait actuellement l’objet d’un développement clinique pour le traitement de la dépression.
Abstract
Discovered in the eighties by Pr Baulieu and colleagues, neurosteroids are a class of neuroactive brain-born steroids, which comprises the steroid hormones, their biosynthesis precursors and their metabolites. They can act through genomic as well as non-genomic pathways. Genomic pathways, only triggered by the neurosteroid hormones, are, in the brain, the same as those largely described in the periphery: the binding of these steroid hormones to nuclear receptors leads to transcription regulations. On the other hand, their precursors and metabolites, such as pregnenolone (PREG), dehydroepiandrosterone (DHEA), their respective sulfate esters, pregnenolone sulfate (PREG-S) and DHEA sulfate (DHEA-S) and allopregnanolone (ALLOP), are defined as neurosteroids, but no corresponding nuclear receptors have been identified so far. In fact, they trigger non-genomic pathways which consist in (i) inhibitory ionotropic receptors, (ii) excitatory ionotropic receptors and (iii) the microtubular system. Hence, inhibitory neurosteroids, whose mostly studied representative is ALLOP, positively modulate, or directly activate, the ionotropic GABA-A receptors. In contrast, excitatory neurosteroids, represented by PREG-S, DHEA-S and DHEA, inhibit the GABA-A receptors, and activate, directly or indirectly, through the sigma-1 receptors, the NMDA glutamate receptors. Neurosteroids of the third group, the microtubular neurosteroids, are able to bind microtubule associated proteins, in particular MAP2, to promote microtubule assembly, neurite outgrowth and in fine structural neuroplasticity. So far, PREG, DHEA and progesterone are the three identified microtubular neurosteroids. The pharmacological properties of neurosteroids have led to specific investigations for assessing their therapeutic potentialities in psychiatric diseases, using validated animal models. In some cases, clinical trials were also performed. These studies showed that ALLOP, the main inhibitory neurosteroid, displayed clear-cut anxiolytic-like and antidepressant-like efficacy in animals. It has been subsequently developed as Brexanolone and tested with success in phase III of clinical trials for the treatment of post-partum depression. Although showing pro-cognitive properties in animals, the sulfated neurosteroids, PREG-S and DHEA-S, were, in contrast, never tested in clinical trials, probably due to their poor stability and proconvulsivant side effects. Their respective non-sulfated forms, PREG and DHEA, showed antidepressant and antipsychotic efficacies in clinical trials, but these drugs never reached the phase III of clinical development because their therapeutic uses would have led to an overproduction of active metabolites responsible for intolerable side effects. The alternative strategy which has been selected consists of the development of non-metabolizable synthetic derivatives of these natural steroids, which keep the same neuroactive properties as their parent molecules, but are devoid of any hormonal side effects. An example of such innovative drugs is MAP4343, a synthetic derivative of PREG, which exhibits potent antidepressant-like efficacy in validated animal models. It is currently tested in depressed patients.
Mots clés : neurostéroïdes / voies non génomiques / récepteurs ionotropiques / microtubules / psychiatrie
Key words: neurosteroids / non-genomic pathways / ionotropic receptors / microtubules / psychiatry
© Société de Biologie, 2019
Introduction
Les composés stéroïdes sont dérivés du cholestérol. À l’origine, ils ont été définis en tant qu’hormones, synthétisées et libérées par des organes endocrines spécifiques, à savoir les glandes surrénales, les gonades et le placenta. Puis, au début des années 1980, ces molécules ont également été identifiées au niveau cérébral par le Pr Etienne-Émile Baulieu, qui les a nommées « neurostéroïdes » (Baulieu, 1997, 1998). Les neurostéroïdes sont en fait les mêmes molécules que les hormones stéroïdes présentes dans les organes périphériques (mêmes structures, mêmes voies de biosynthèse), avec cette différence qu’ils sont spécifiquement synthétisés par le parenchyme cérébral et possèdent des propriétés neuroactives. Leur production et leur accumulation dans le système nerveux central (SNC) sont indépendantes de la stéroïdogenèse qui s’effectue à la périphérie. Les neurostéroïdes sont constitués soit par les hormones stéroïdes elles-mêmes, soit par leurs précurseurs métaboliques, comme la prégnénolone (PREG) ou la dihydroépiandrostérone (DHEA), soit enfin par leurs produits de dégradation (métabolites), tels que l’alloprégnanolone (ALLOP), un métabolite de la progestérone (Figure 1).
Les actions des hormones (neuro)stéroïdes peuvent être classiquement attribuées à l’activation de leurs récepteurs nucléaires qui agissent comme des facteurs de transcription dans les neurones, en modulant l’expression d’une grande diversité de gènes. Dans ce cas, on parle d’activation de voies génomiques. Ces actions sont lentes (minutes, heures) en raison de la mise en route des processus de transcription et de synthèse protéique.
Pour ce qui concerne les précurseurs et métabolites des hormones stéroïdes, on a longtemps pensé que ces molécules n’avaient aucune activité biologique, jusqu’à la découverte de leurs propriétés neuroactives. Toutefois, aucune activité biologique à la périphérie ne leur a encore été attribuée à ce jour. Leurs effets spécifiques sur le SNC impliquent l’activation de voies non génomiques à l’origine de modifications rapides de l’activité neuronale (Weng & Chung, 2016). Ces voies sont représentées par les récepteurs ionotropiques des neurotransmetteurs, les récepteurs sigma-1 (σ-1) et les protéines associées aux microtubules. Elles sont principalement déclenchées par les neurostéroïdes précurseurs et métabolites d’hormones, mais elles peuvent l’être également par certaines hormones (neuro)stéroïdes elles-mêmes. Ces voies constituent autant de possibilités d’actions pour les neurostéroïdes, sur de nouvelles cibles d’intérêt thérapeutique potentiel dans le champ de diverses pathologies psychiatriques.
 |
Figure 1 Voies métaboliques de la stéroïdogénèse montrant les neurostéroïdes actifs dans le système nerveux central, représentés soit par les hormones stéroïdes elles-mêmes (cadres rouges), soit par leurs précurseurs (cadres bleus), ou leurs métabolites (cadres verts). DHDOC : Dihydrodéoxycorticostérone ; DHEA : Déhydroépiandrostérone ; DHEA-S : Sulfate de déhydroépiandrostérone ; DHT : Dihydrotestostérone; DHP : Dihydroprogestérone ; DOC : Déoxycorticostérone ; PREG : Prégnénolone ; PREG-S : Sulfate de prégnénolone ; THDOC : Tétrahydrodéoxycorticostérone. |
Les voies non génomiques activées par les neurostéroïdes
Activation des récepteurs ionotropiques
Les récepteurs ionotropiques des neurotransmetteurs sont des récepteurs-canaux situés à la membrane plasmique des neurones. Lorsqu’ils sont activés par leurs ligands, ils sont capables de générer un courant ionique entre les compartiments extracellulaire et intracellulaire, ce qui modifie l’excitabilité du neurone et in fine la neurotransmission synaptique.
Depuis une vingtaine d’années, de nombreuses données indiquent que les neurostéroïdes ont la capacité de moduler l’activité des récepteurs ionotropiques des neurotransmetteurs cérébraux. On peut ainsi classer ces neurostéroïdes en deux catégories : les neurostéroïdes inhibiteurs, qui potentialisent la neurotransmission de l’acide γ-aminobutyrique (GABA), et les neurostéroïdes excitateurs, qui potentialisent la neurotransmission de l’acide glutamique (glutamate) (Schverer et al., 2018) (Figure 2).
Dès le début des années 1940, ont été rapportées les propriétés anesthésiques de certains stéroïdes administrés chez le rat, en particulier la progestérone et l’un de ses métabolites, la déoxycorticostérone (DOC), laissant penser à une action inhibitrice de ces molécules sur l’activité cérébrale. Par la suite, des dérivés synthétiques des métabolites de la progestérone ont été développés en tant qu’anesthésiques : c’est le cas de l’alphaxalone (3α-hydroxy-5α-prégnane-l-l, 20-dione) (Harrison & Simmonds, 1984), un dérivé de l’ALLOP (3α-hydroxy-5α-prégnane-20-one), qui est actuellement sur le marché pour un usage vétérinaire. De fait, les neurostéroïdes inhibiteurs sont principalement représentés par les métabolites de la progestérone comme l’ALLOP et la prégnanolone (3α-hydroxy-5β-prégnane-20-one), et les métabolites de la DOC, notamment la tétrahydro-DOC (THDOC : 3α, 21-dihydroxy-5α-prégnane-20-one) (Figure 1). Ces métabolites exercent une action de type modulation allostérique positive sur les récepteurs ionotropiques GABA-A, ce qui conduit à une augmentation des courants GABAergiques générés lorsque le GABA se fixe sur son récepteur. Une stimulation directe (de type agoniste) des récepteurs GABA-A a également été montrée pour l’ALLOP et la THDOC. Les deux sites de fixation de ces neurostéroïdes sur le récepteur-canal GABA-A ont été localisés et correspondent à leurs deux types d’actions, i.e. modulatrice versus activatrice. Le site de modulation de l’activité GABAergique est situé à l’intérieur de la sous-unité α du récepteur GABA-A, tandis que le site d’activation est situé entre les sous-unités α et β (Hosie et al., 2006).
Parmi les neurostéroïdes excitateurs, les dérivés sulfatés de la PREG et de la DHEA, respectivement le sulfate de prégnénolone (S-PREG) et le sulfate de DHEA (S-DHEA), sont les plus étudiés. Ils exercent une modulation allostérique négative sur les récepteurs ionotropiques GABA-A (Schverer et al., 2018). La DHEA native a également montré une capacité inhibitrice sur l’activité des récepteurs GABA-A, lui conférant ainsi un rôle de neurostéroïde excitateur (Schverer et al., 2018). En présence de GABA, ces neurostéroïdes vont donc réduire les courants GABAergiques et augmenter l’excitabilité des neurones. Toutefois, leur(s) site(s) d’interaction avec le récepteur GABA-A reste(nt), pour l’heure, inconnu(s).
À de fortes concentrations (> micromolaire), le S-PREG est également capable de moduler directement l’activité des récepteurs ionotropiques du glutamate de type NMDA, soit positivement soit négativement selon les types de sous-unités protéiques qui composent le récepteur-canal NMDA. Par ailleurs, le S-PREG exercerait une modulation négative sur les récepteurs ionotropiques du glutamate de type AMPA (Schverer et al., 2018). Ainsi, l’activation directe des récepteurs ionotropiques du glutamate par le S-PREG pourrait conduire à des effets contrastés.
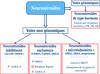 |
Figure 2 Multiplicité des actions pharmacologiques des neurostéroïdes dans le cerveau. Outre les voies génomiques activées par les neurostéroïdes de type hormone, des voies non génomiques spécifiques du système nerveux central peuvent également être activées par les neurostéroïdes. Selon la nature de ces voies, on peut distinguer (i) les neurostéroïdes inhibiteurs qui stimulent les récepteurs ionotropiques du GABA (GABA-A), (ii) les neurostéroïdes excitateurs, qui activent – directement ou indirectement – les récepteurs ionotropiques du glutamate de type NMDA, et inhibent les récepteurs GABA-A, et (iii) les neurostéroïdes microtubulaires qui vont se lier aux protéines microtubulaires, en particulier MAP2, pour renforcer la plasticité structurale. GABA-A : Récepteur ionotropique du GABA de type A ; PR : Récepteur nucléaire de la progestérone ; ER : Récepteur nucléaire des œstrogènes ; AR : Récepteur nucléaire des androgènes ; NMDA : N-Méthyl-D-aspartate, désigne un type de récepteur ionotropique du glutamate. |
Activation des récepteurs Sigma-1
Le récepteur σ-1 est un récepteur intracellulaire, localisé au niveau de la membrane du réticulum endoplasmique (Alonso et al., 2000). Son activation par un ligand agoniste entraîne une augmentation du courant calcique du récepteur-canal NMDA, et favorise l’adressage de ce dernier à la membrane plasmique. Au total, un agoniste des récepteurs σ-1 augmente la réponse excitatrice des neurones au glutamate (Morales-Lazaro et al., 2019).
Les neurostéroïdes sulfatés, le S-PREG et S-DHEA, sont les deux principaux neurostéroïdes montrant une activité de type agoniste des récepteurs σ-1 (Monnet & Maurice, 2006). Mais, il a été montré, de façon indirecte, que la DHEA était également capable de stimuler les récepteurs σ-1 (Debonnel et al., 1996). Ainsi, la liaison de ces neurostéroïdes excitateurs sur les récepteurs σ-1 vient renforcer leur effet stimulant sur l’activité neuronale.
Liaison aux protéines associées aux microtubules
Les microtubules sont l’un des éléments constitutifs du cytosquelette. Ils participent à la neuroplasticité structurale en régulant la forme des neurones, leur apportant une polarité cellulaire essentielle aux fonctions spécifiquement neuronales (Hoogenraad & Bradke, 2009). De plus, ils exercent d’autres fonctions importantes dans la cellule : ils constituent des axes de transport intracellulaires sous l’action des moteurs moléculaires que sont la dynéine et la kinésine (Dent & Baas, 2014) et ils permettent la formation du fuseau mitotique lors de la mitose (Walczak & Heald, 2008). Les microtubules sont constitués par des dimères de tubulines α et β. Ces dimères s’assemblent linéairement pour former des protofilaments, et les protofilaments s’assemblent à leur tour pour former le microtubule (Conde & Caceres, 2009). La formation des microtubules est hautement régulée par des protéines associées aux microtubules, les MAP. La présence de MAP fixées sur les microtubules influe sur leur vitesse de nucléation et leur stabilité.
Au début des années 2000, Murakami et al. (2000) ont découvert, à partir d’une préparation de cytosol de cerveau fœtal, que la PREG se liait à la MAP de type 2 (MAP2). MAP2 pouvait ainsi représenter un récepteur de ce neurostéroïde dont aucune cible n’avait été identifiée jusqu’alors. L’interaction entre la PREG et MAP2 a été confirmée par la suite avec l’utilisation d’une protéine recombinante MAP2C (isoforme courte de MAP2), sur laquelle le site de liaison du neurostéroïde a été localisé au niveau de son domaine N-terminal (Mizota & Ueda, 2008 ; Matsunaga et al., 2010). De même, la DHEA (Laurine et al., 2003) et la progestérone (Mizota & Ueda, 2008) ont montré une capacité de liaison à la protéine MAP2C recombinante également à ce niveau. Ces observations indiquent que MAP2 peut être la cible de plusieurs neurostéroïdes. Plus récemment, une autre protéine microtubulaire a été identifiée comme partenaire de la PREG. Il s’agit de la protéine de lien cytoplasmique-170 appelée CLIP-170. Cette protéine vient se fixer sur la tubuline, au niveau de l’extrémité dynamique (positive) du microtubule, où s’effectue l’ajout des dimères de tubuline liés au GTP. La liaison de CLIP-170 au microtubule favorise l’assemblage de la tubuline et, en conséquence, la croissance du microtubule. En se liant à CLIP-170, la PREG induit une modification de sa conformation, ce qui facilite l’interaction entre CLIP-170 et la tubuline, et favorise la croissance des microtubules (Weng et al., 2013).
Ainsi, une troisième catégorie de neurostéroïdes a pu être caractérisée : les neurostéroïdes microtubulaires, qui modulent le cytosquelette (Figure 2). Leur mécanisme d’action cellulaire reste cependant encore imprécis en raison du peu d’études sur le sujet. L’hypothèse proposée est que la fixation des neurostéroïdes sur les microtubules permettrait de stabiliser leur organisation en faisceau (bundling) et de favoriser leur croissance. Ces actions sont probablement à l’origine de l’effet stimulant exercé par la PREG sur la pousse neuritique (Fontaine-Lenoir et al., 2006 ; Matsunaga et al., 2010) et contribuent ainsi aux mécanismes sous-tendant la plasticité structurale dans le cerveau.
Potentialités thérapeutiques des neurostéroïdes naturels en psychiatrie
Très rapidement après leur découverte, les propriétés psychoactives de certains précurseurs d’hormones stéroïdes ont été décrites, bien avant qu’on ait caractérisé ces précurseurs comme neurostéroïdes. C’est le cas, en particulier, de la PREG, découverte dans les années 1930, qui avait montré sa capacité à réduire la fatigue des pilotes lors d’expériences menées sur simulateur de vol (Henderson et al., 1950). De même, dans les années 1950, des études cliniques ont rapporté des effets antidépresseurs et antipsychotiques pour la DHEA (Sands & Chamberlain, 1952). À cette même époque, a commencé l’utilisation de certains stéroïdes pour leurs propriétés sédatives et analgésiques dans les cocktails anesthésiques (Harbord & Wild, 1956). Mais c’est avec la découverte des différents types de neurostéroïdes (Corpechot et al., 1981, 1983) et de leurs propriétés pharmacologiques sur le SNC, que les potentialités thérapeutiques de ces molécules pour les maladies psychiatriques sont véritablement apparues. Ils furent testés d’abord sur des modèles animaux de maladies psychiatriques, puis, pour certaines d’entre elles, sur des patients, et ils continuent à l’être.
Études précliniques
Le principal neurostéroïde inhibiteur qui a été testé dans des modèles de pathologies psychiatriques est l’ALLOP. Son tropisme GABAergique laissait penser qu’elle pouvait posséder des propriétés anxiolytiques (Wieland et al., 1991). De fait, chez le rat, l’ALLOP produit un effet de type anxiolytique lorsqu’elle est infusée dans l’amygdale ou le cortex préfrontal (Akwa et al., 1999 ; Engin & Treit, 2007) et un effet de type antidépresseur lorsqu’elle est infusée dans l’hippocampe (Shirayama et al., 2011). Comme ces effets peuvent être bloqués par un ligand antagoniste des récepteurs GABA-A, il est probable qu’ils résultent d’une augmentation du tonus GABAergique.
Concernant les neurostéroïdes excitateurs, le plus étudié est le S-PREG, qui a montré des effets pro-mnésiques et/ou anti-amnésiques dans différents modèles animaux (Abdel-Hafiz et al., 2016). Ainsi, une administration intraventriculaire de faibles doses de S-PREG stimule la mémoire spatiale chez la souris (Flood et al., 1992) et s’oppose aux effets délétères de la scopolamine sur l’apprentissage (Meziane et al., 1996). Le S-PREG améliore également la mémoire spatiale chez le rat âgé (∼ 2 ans) ayant un déficit cognitif (Vallée et al., 1997). Plus récemment, l’amélioration de la mémoire par une administration intra-hippocampique de S-PREG a pu être attribuée à la stimulation de récepteurs NMDA et à une augmentation des taux cérébraux du facteur neurotrophique BDNF (Brain-derived neurotrophic factor) (Dastgheib et al., 2015). Cependant, d’autres études ont montré, au contraire, un effet amnésique de S-PREG lorsqu’il est administré à de plus fortes doses (Nanfaro et al., 2010). Ces données contradictoires pourraient s’expliquer par des actions pharmacologiques opposées sur les récepteurs du glutamate (activation des récepteurs NMDA versus inhibition des récepteurs AMPA) à de fortes concentrations de S-PREG. Par ailleurs, l’administration de S-PREG peut provoquer des effets pro-convulsivants (Reddy & Kulkarni, 1998), ce qui constitue un obstacle majeur pour son développement thérapeutique (voir section suivante). De son côté, le S-DHEA a également montré une capacité à promouvoir le potentiel de mémorisation et à réduire les altérations de mémoire induites par les antagonistes du récepteur NMDA (Maurice et al., 1997) ou par la β-amyloïde (Maurice et al., 1998) chez les rongeurs. Ces actions du S-DHEA seraient liées à son effet neuroexcitateur, via la stimulation des récepteurs σ-1 et l’inhibition des récepteurs GABA-A (Schverer et al., 2018).
Les formes non sulfatées, PREG et DHEA, souvent testées en parallèle à leurs formes sulfatées, ont finalement fait l’objet de peu d’études précliniques préalables aux essais cliniques utilisant ces molécules (voir section suivante). Ainsi, la DHEA, testée parallèlement au S-DHEA chez des souris rendues amnésiques par l’administration de β-amyloïde, a produit des effets anti-amnésiques (Maurice et al., 1998). Dans ce même modèle, la PREG testée en parallèle au S-PREG a montré elle aussi des effets positifs sur les capacités mnésiques. La PREG et la DHEA ont donc des propriétés pro-cognitives et pro-mnésiques avérées chez l’animal de laboratoire. Par ailleurs, la PREG a été testée chez la souris dépourvue du transporteur de la dopamine, un modèle animal de schizophrénie. Administrée chroniquement, elle a permis de réduire les symptômes négatifs de type schizophrénique induits par la mutation (Wong et al., 2012). Enfin, la PREG a montré une efficacité plus spécifique consistant à bloquer les effets néfastes du cannabis (Vallée et al., 2014). En particulier, la PREG aurait une potentialité thérapeutique pour réduire les états de type psychotique induits par le Δ9-tétra-hydro-cannabinol (Busquets-Garcia et al., 2017). Ces effets « anti-cannabis » seraient liés à une action inhibitrice de la PREG sur l’activité des récepteurs CB1 des endocannabinoïdes.
Études cliniques
De nombreuses observations cliniques ont mis en évidence une réduction des taux circulants des neurostéroïdes avec l’âge (Orentreich et al., 1984 ; Barrett-Connor et al., 1999 ; Hill et al., 1999 ; Lennartsson et al., 2015). Par ailleurs, des niveaux élevés de neurostéroïdes endogènes, comme la DHEA et le S-DHEA, sont parfois associés à de meilleures performances cognitives (Davis et al., 2008). Plus précisément, des baisses des taux sanguins et/ou cérébraux (i.e. dans le liquide céphalo-rachidien, LCR) de neurostéroïdes ont été observées chez des patients ayant des troubles de l’humeur et chez des patients schizophrènes. Ainsi, le principal neurostéroïde inhibiteur, l’ALLOP, présente des concentrations drastiquement abaissées dans le LCR de patients dépressifs (Uzunova et al., 1998) ou souffrant du syndrome de stress post-traumatique (Rasmusson et al., 2006). De même, des taux circulants anormalement bas de DHEA ont été rapportés chez des patients dépressifs ou schizophrènes (Ritsner, 2010). Enfin, une baisse conséquente (∼ −50 %) des concentrations plasmatiques et cérébrales (LCR) de PREG a également été mise en évidence en association avec la dépression, aussi bien unipolaire que bipolaire (George et al., 1994 ; Romeo et al., 1998). Chez des patients schizophrènes, Ritsner et al. (2007) ont aussi rapporté une diminution des taux sanguins de PREG, mais moins marquée que chez les déprimés sévères.
En regard des déficits en neurostéroïdes observés chez les patients atteints de pathologies psychiatriques, de nombreuses études cliniques ont été réalisées avec pour objectif de compenser le déficit de neurostéroïde naturel par un apport exogène. Récemment, l’ALLOP, autrement appelée brexanolone, a montré une efficacité concluante pour réduire la dépression sévère du post-partum (Kanes et al., 2017 ; Meltzer-Brody et al., 2018). Le brexanolone est actuellement commercialisé aux États-Unis pour cette indication sous le nom de Zulresso®. Des molécules synthétiques analogues de l’ALLOP sont actuellement en cours de développement pour le traitement de différents troubles de l’humeur (voir section suivante).
Les neurostéroïdes excitateurs n’ont, pour l’heure, encore jamais fait l’objet d’études cliniques dans le cadre de pathologies psychiatriques (selon les données disponibles dans la littérature). Ce manque de données cliniques est probablement lié à plusieurs raisons, à savoir (i) les effets contrastés de ces neurostéroïdes sulfatés dans les modèles animaux, (ii) la multiplicité de leurs cibles avec des effets opposés, (iii) leur difficile passage de la BHE, (iii) leur instabilité dans l’organisme et (iv) leurs potentiels effets indésirables, en particulier leur propension à déclencher des crises convulsives.
En revanche, les formes non sulfatées, PREG et DHEA, ont été testées dans de nombreux essais cliniques (surtout la DHEA ; Peixoto et al., 2014), qui ont permis de mettre en lumière des efficacités thérapeutiques intéressantes pour ces deux neurostéroïdes dans certaines pathologies psychiatriques. Au cours des années 1990, plusieurs essais cliniques ont montré que la DHEA permettait de réduire les symptômes dépressifs chez des patients souffrant de dépression majeure, en particulier des patients âgés (Wolkowitz et al., 1997, 1999). La DHEA a également été administrée chez des patients atteints de schizophrénie dans de nombreuses études, qui ont conclu à des efficacités contrastées pour réduire les symptômes négatifs (Ritsner, 2010 ; Cai et al., 2018). La PREG a fait, elle aussi, l’objet de plusieurs études cliniques chez des patients schizophrènes (Ritsner, 2010). En particulier, une récente étude menée sur 102 patients a conclu à une efficacité significative de ce neurostéroïde « microtubulaire », administré à des doses croissantes par paliers de 100 jusqu’à 300 mg, pour réduire les symptômes négatifs de la schizophrénie (amélioration des capacités fonctionnelles et des capacités de communication) (Marx et al., 2014). De plus, un bénéfice thérapeutique de l’administration de PREG a également été démontré chez 73 patients atteints de troubles bipolaires, en phase dépressive. Ainsi, Brown et al. (2014) ont rapporté que l’administration conjointe de PREG renforce l’efficacité d’antidépresseurs pour réduire les symptômes dépressifs chez ces patients.
Pourtant, l’utilisation des neurostéroïdes natifs, DHEA et PREG, pour le traitement de pathologies psychiatriques peut poser des problèmes en raison de leurs transformations métaboliques possibles (Figure 1), qui peuvent conduire à une surproduction d’hormones sexuelles et de leurs métabolites (cf. l’étude clinique de Brown et al. (2014), qui a montré que l’administration orale de PREG chez des patients dépressifs a entraîné des augmentations considérables des taux circulants d’ALLOP et de prégnanolone). Ces processus métaboliques pourraient réduire la biodisponibilité de la PREG et/ou de la DHEA, et être à l’origine d’une « dilution » de leurs effets thérapeutiques. En cas de production exagérée des formes sulfatées de la PREG ou la DHEA, pourraient se produire des effets secondaires très mal tolérés, liés à leurs actions neuroexcitatrices, potentiellement proconvulsivantes. Enfin, la surproduction d’hormones sexuelles, telles que la progestérone ou la testostérone, pourrait engendrer l’apparition de nombreux effets secondaires, notamment la masculinisation chez la femme ou la féminisation chez l’homme. C’est pourquoi la génération de molécules synthétiques stables, analogues des neurostéroïdes natifs, mais non métabolisables, représente aujourd’hui une stratégie intéressante pour le développement de thérapeutiques alternatives et innovantes en psychiatrie.
Développement de dérivés synthétiques
Des dérivés synthétiques de l’ALLOP sont actuellement développés par deux sociétés de biotechnologie américaines, Marinus Pharma et Sage Therapeutics. L’objectif est de synthétiser des produits ayant une meilleure biodisponibilité que l’ALLOP et une demi-vie dans l’organisme plus longue. La société Marinus Pharma développe la ganaxolone dans les troubles anxio-dépressifs. Administrée chez la souris isolée socialement, la ganaxolone réduit les comportements de type anxieux et l’agressivité qui sont générés dans cette condition de stress chronique (Pinna & Rasmusson, 2014). Cependant, une première étude de phase II évaluant l’efficacité de cette molécule sur le syndrome de stress post-traumatique s’est soldée par un échec (Rasmusson et al., 2017). Aujourd’hui, la ganaxolone est toujours en cours d’évaluation, mais seulement pour sa capacité à réduire la dépression du post-partum. De son côté, la société Sage Therapeutics développe un autre analogue de l’ALLOP, la zuranolone, non seulement pour le traitement de la dépression du post-partum mais aussi pour celui de la dépression majeure. Il est à noter que ces molécules sont également en développement pour l’épilepsie réfractaire. Leur efficacité dans cette indication semble avérée puisque la zuranolone est actuellement testée dans un essai de phase III.
Des dérivés synthétiques de la PREG, non métabolisables, en vue d’éviter la surproduction de métabolites actifs du neurostéroïde naturel, en particulier les hormones sexuelles, sont également en cours de développement pour des applications cliniques innovantes. C’est le cas du MAP4343 développé par la société Mapreg. Sur la base de travaux démontrant que la PREG est capable de favoriser l’assemblage des microtubules et de stimuler la pousse neuritique (Murakami et al., 2000), son dérivé synthétique stable a été testé sur la fonction microtubulaire et la plasticité structurale. Et, de fait, MAP4343 a montré des propriétés similaires à celles de la PREG (Fontaine-Lenoir et al., 2006), suggérant sa capacité à stimuler la neuroplasticité via une activation du système microtubulaire. Étant donné que la physiopathologie de la dépression comporte, entre autres, des altérations de la neuroplasticité (Duman et al., 2016) et de la dynamique microtubulaire (Bianchi et al., 2005), des effets potentiels de MAP4343 sur la symptomatologie dépressive ont été recherchés sur différents modèles animaux validés de dépression. De façon très intéressante, ce composé a montré une efficacité rapide pour prévenir le comportement de type dépressif et les perturbations cognitives observés chez le rat ayant subi un isolement social (Bianchi & Baulieu, 2012). Administré chez le toupaye soumis à un stress social, MAP4343 s’est également révélé efficace pour réduire le comportement d’évitement de l’animal et normaliser ses anomalies biologiques liées au stress, notamment celles affectant les concentrations urinaires de noradrénaline et de cortisol, le niveau de sommeil paradoxal ou encore la température corporelle (Paresys et al., 2016). À la suite de ces données précliniques ainsi que d’autres non encore publiées, MAP4343 fait actuellement l’objet d’un développement clinique pour le traitement de la dépression.
Conclusion
Rapidement après leur identification, précurseurs et métabolites des hormones stéroïdes ont fait l’objet d’études leur conférant des propriétés psychoactives et un possible intérêt pour le traitement de certaines maladies psychiatriques, sans que l’on puisse cependant expliquer le(s) mécanisme(s) associé(s). Avec leur caractérisation en tant que neurostéroïdes par le Pr Baulieu et ses équipes, de nombreuses recherches ont donc été entreprises en vue d’élucider leurs mécanismes d’action et préciser leurs potentialités thérapeutiques en psychiatrie.
Les neurostéroïdes ayant une cible moléculaire unique sont potentiellement plus aptes à un développement clinique car ils ont une meilleure efficacité pharmacologique et de moindres effets secondaires. C’est le cas de l’ALLOP (ganaxolone) qui a une action strictement GABAergique, et connaît un développement pour le traitement de la dépression du post-partum et des troubles anxieux (Figure 3). La PREG et la DHEA, précurseurs des hormones stéroïdes, ont fait l’objet de nombreuses études cliniques pour le traitement de la dépression et de la schizophrénie, contrairement à leurs dérivés sulfatés S-PREG et S-DHEA qui n’ont jamais dépassé le stade préclinique. Ces derniers semblent avoir une efficacité limitée et contrastée, probablement en raison de la multiplicité de leurs cibles, et leur développement clinique est bloqué dans la mesure où ils pourraient provoquer des crises convulsives (Figure 3). De même, la multiplicité des cibles activées par la DHEA et sa possible transformation en testostérone ont contribué à freiner l’aboutissement de son développement clinique. Pour ce qui est de la PREG (précurseur de l’ensemble des neurostéroïdes), bien que cette dernière n’ait qu’une cible unique, son administration peut conduire à la surproduction de nombreux métabolites actifs, avec, en conséquence, une multiplicité d’actions, parfois opposées. Ceci pourrait limiter l’efficacité de la PREG en elle-même (Figure 3). Ainsi, tout comme la DHEA, son développement clinique ne semble pas aboutir. En revanche, le développement d’analogues synthétiques de la PREG, tels que MAP4343, composé non transformable en hormone et ayant une cible unique, ouvre des perspectives prometteuses pour des traitements innovants des maladies psychiatriques.
Abréviations
AMPA : Acide aminométhylphosphonique (désigne l’un des récepteurs ionotropiques du glutamate)
AR : Récepteur nucléaire des androgènes
BDNF : Brain-derived neurotrophic factor
BHE : Barrière hémato-encéphalique
ER : Récepteur nucléaire des œstrogènes
GABA-A : Récepteur ionotropique du GABA de type A
LCR : Liquide céphalo-rachidien
MAP : Microtubule Associated Proteins
NMDA : N-méthyl-D-aspartate (désigne l’un des récepteurs ionotropiques du glutamate)
PR : Récepteur nucléaire de la progestérone
S-PREG : Sulfate de prégnénolone
THDOC : Tétrahydrodéoxycorticostérone
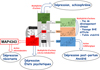 |
Figure 3 Développement clinique des neurostéroïdes en psychiatrie. Les dérivés sulfatés de la PREG et de la DHEA n’ont, pour l’heure, pas fait l’objet d’études cliniques, probablement en raison de leur faible sélectivité pharmacologique, de leur difficile passage de la barrière hémato-encéphalique, et de leur faible stabilité dans l’organisme. En revanche, l’ALLOP, par son action sélective GABAergique, a montré des potentialités thérapeutiques pour le traitement de la dépression du post-partum et de l’anxiété. La DHEA, bien qu’ayant une action pharmacologique peu sélective, a été testée pour le traitement de la dépression et de la schizophrénie. La PREG a également été explorée pour le traitement de ces pathologies psychiatriques, mais sa sélectivité pharmacologique reste limitée en raison de la production de métabolites actifs. Les dérivés synthétiques non métabolisables des neurostéroïdes constituent une nouvelle piste de recherche particulièrement prometteuse. Ainsi, le composé MAP4343, qui offre une meilleure sélectivité pharmacologique avec sa cible microtubulaire unique, est actuellement développé pour le traitement de la dépression. (Schéma modifié d’après Schverer et al., 2018). |
Références
- Abdel-Hafiz, L., Chao, O.Y., Huston, J.P., Nikolaus, S., Spieler, R.E., de Souza Silva, M.A., Mattern, C. (2016). Promnestic effects of intranasally applied pregnenolone in rats. Neurobiol Learn Mem, 133, 185-195. [CrossRef] [PubMed] [Google Scholar]
- Akwa, Y., Purdy, R.H., Koob, G.F., Britton, K.T. (1999). The amygdala mediates the anxiolytic-like effect of the neurosteroid allopregnanolone in rat. Behav Brain Res, 106, 119-125. [CrossRef] [PubMed] [Google Scholar]
- Alonso, G., Phan, V., Guillemain, I., Saunier, M., Legrand, A., Anoal, M., Maurice, T. (2000). Immunocytochemical localization of the sigma(1) receptor in the adult rat central nervous system. Neuroscience, 97, 155-170. [PubMed] [Google Scholar]
- Barrett-Connor, E., von Muhlen, D., Laughlin, G.A., Kripke, A. (1999). Endogenous levels of dehydroepiandrosterone sulfate, but not other sex hormones, are associated with depressed mood in older women: The Rancho Bernardo Study. J Am Geriatr Soc, 47, 685-691. [CrossRef] [PubMed] [Google Scholar]
- Baulieu, E.E. (1997). Neurosteroids: Of the nervous system, by the nervous system, for the nervous system. Recent Prog Horm Res, 52, 1-32. [Google Scholar]
- Baulieu, E.E. (1998). Neurosteroids: A novel function of the brain. Psychoneuroendocrinology, 23, 963-987. [CrossRef] [PubMed] [Google Scholar]
- Bianchi, M., Baulieu, E.E. (2012). 3beta-Methoxy-pregnenolone (MAP4343) as an innovative therapeutic approach for depressive disorders. Proc Natl Acad Sci USA, 109, 1713-1718. [CrossRef] [Google Scholar]
- Bianchi, M., Hagan, J.J., Heidbreder, C.A. (2005). Neuronal plasticity, stress and depression: Involvement of the cytoskeletal microtubular system ? Curr Drug Targets CNS Neurol Disord, 4, 597-611. [CrossRef] [PubMed] [Google Scholar]
- Brown, E.S., Park, J., Marx, C.E., Hynan, L.S., Gardner, C., Davila, D., Nakamura, A., Sunderajan, P., Lo, A., Holmes, T. (2014). A randomized, double-blind, placebo-controlled trial of pregnenolone for bipolar depression. Neuropsychopharmacology, 39, 2867-2873. [CrossRef] [PubMed] [Google Scholar]
- Busquets-Garcia, A., Soria-Gomez, E., Redon, B., Mackenbach, Y., Vallee, M., Chaouloff, F., Varilh, M., Ferreira, G., Piazza, P.V., Marsicano, G. (2017). Pregnenolone blocks cannabinoid-induced acute psychotic-like states in mice. Mol Psychiatry, 22, 1594-1603. [CrossRef] [PubMed] [Google Scholar]
- Cai, H., Cao, T., Zhou, X., Yao, J.K. (2018). Neurosteroids in schizophrenia: Pathogenic and therapeutic implications. Front Psychiatry, 9, 73. [CrossRef] [PubMed] [Google Scholar]
- Conde, C., Caceres, A. (2009). Microtubule assembly, organization and dynamics in axons and dendrites. Nat Neurosci, 10, 319-332. [Google Scholar]
- Corpechot, C., Robel, P., Axelson, M., Sjovall, J., Baulieu, E.E. (1981). Characterization and measurement of dehydroepiandrosterone sulfate in rat brain. Proc Natl Acad Sci USA, 78, 4704-4707. [CrossRef] [Google Scholar]
- Corpechot, C., Synguelakis, M., Talha, S., Axelson, M., Sjovall, J., Vihko, R., Baulieu, E.E., Robel, P. (1983). Pregnenolone and its sulfate ester in the rat brain. Brain Res, 270, 119-125. [CrossRef] [PubMed] [Google Scholar]
- Dastgheib, M., Dehpour, A.R., Heidari, M., Moezi, L. (2015). The effects of intra-dorsal hippocampus infusion of pregnenolone sulfate on memory function and hippocampal BDNF mRNA expression of biliary cirrhosis-induced memory impairment in rats. Neuroscience, 306, 1-9. [PubMed] [Google Scholar]
- Davis, S.R., Shah, S.M., McKenzie, D.P., Kulkarni, J., Davison, S.L., Bell, R.J. (2008). Dehydroepiandrosterone sulfate levels are associated with more favorable cognitive function in women. J Clin Endocrinol Metab, 93, 801-808. [CrossRef] [PubMed] [Google Scholar]
- Debonnel, G., Bergeron, R., de Montigny, C. (1996). Potentiation by dehydroepiandrosterone of the neuronal response to N-methyl-D-aspartate in the CA3 region of the rat dorsal hippocampus: An effect mediated via sigma receptors. J Endocrinol, 150 Suppl, S33-42. [CrossRef] [PubMed] [Google Scholar]
- Dent, E.W., Baas, P.W. (2014). Microtubules in neurons as information carriers. J Neurochem, 129, 235-239. [CrossRef] [PubMed] [Google Scholar]
- Duman, R.S., Aghajanian, G.K., Sanacora, G., Krystal, J.H. (2016). Synaptic plasticity and depression: New insights from stress and rapid-acting antidepressants. Nat Med, 22, 238-249. [CrossRef] [PubMed] [Google Scholar]
- Engin, E., Treit, D. (2007). The anxiolytic-like effects of allopregnanolone vary as a function of intracerebral microinfusion site: The amygdala, medial prefrontal cortex, or hippocampus. Behav Pharmacol, 18, 461-470. [CrossRef] [PubMed] [Google Scholar]
- Flood, J.F., Morley, J.E., Roberts, E. (1992). Memory-enhancing effects in male mice of pregnenolone and steroids metabolically derived from it. Proc Natl Acad Sci USA, 89, 1567-1571. [CrossRef] [Google Scholar]
- Fontaine-Lenoir, V., Chambraud, B., Fellous, A., David, S., Duchossoy, Y., Baulieu, E.E., Robel, P. (2006). Microtubule-associated protein 2 (MAP2) is a neurosteroid receptor. Proc Natl Acad Sci USA, 103, 4711-4716. [CrossRef] [Google Scholar]
- George, M.S., Guidotti, A., Rubinow, D., Pan, B., Mikalauskas, K., Post, R.M. (1994). CSF neuroactive steroids in affective disorders: Pregnenolone, progesterone, and DBI. Biol Psychiatry, 35, 775-780. [CrossRef] [PubMed] [Google Scholar]
- Harbord, R.P., Wild, W.N. (1956). Observations on steroid anaesthesia; a preliminary report. Proc Royal Soc Med, 49, 487-492. [CrossRef] [Google Scholar]
- Harrison, N.L., Simmonds, M.A. (1984). Modulation of the GABA receptor complex by a steroid anaesthetic. Brain Res, 323, 287-292. [CrossRef] [PubMed] [Google Scholar]
- Henderson, E., Weinberg, M., Wright, W.A. (1950). Pregnenolone. J Clin Endocrinol Metab, 10, 455-474. [CrossRef] [PubMed] [Google Scholar]
- Hill, M., Lukac, D., Lapcik, O., Sulcova, J., Hampl, R., Pouzar, V., Starka, L. (1999). Age relationships and sex differences in serum levels of pregnenolone and 17-hydroxypregnenolone in healthy subjects. Clin Chem Lab Med, 37, 439-447. [CrossRef] [PubMed] [Google Scholar]
- Hoogenraad, C.C., Bradke, F. (2009). Control of neuronal polarity and plasticity – A renaissance for microtubules ? Trends Cell Biol, 19, 669-676. [Google Scholar]
- Hosie, A.M., Wilkins, M.E., da Silva, H.M., Smart, T.G. (2006). Endogenous neurosteroids regulate GABAA receptors through two discrete transmembrane sites. Nature, 444, 486-489. [Google Scholar]
- Kanes, S.J., Colquhoun, H., Doherty, J., Raines, S., Hoffmann, E., Rubinow, D.R., Meltzer-Brody, S. (2017). Open-label, proof-of-concept study of brexanolone in the treatment of severe post-partum depression. Hum Psychopharmacol, 32(2). doi: 10.1002/hup.2576. [Google Scholar]
- Laurine, E., Lafitte, D., Gregoire, C., Seree, E., Loret, E., Douillard, S., Michel, B., Briand, C., Verdier, J.M. (2003). Specific binding of dehydroepiandrosterone to the N terminus of the microtubule-associated protein MAP2. J Biol Chem, 278, 29979-29986. [CrossRef] [PubMed] [Google Scholar]
- Lennartsson, A.K., Theorell, T., Kushnir, M.M., Jonsdottir, I.H. (2015). Low levels of dehydroepiandrosterone sulfate in younger burnout patients. PloS one, 10, e0140054. [CrossRef] [PubMed] [Google Scholar]
- Marx, C.E., Lee, J., Subramaniam, M., Rapisarda, A., Bautista, D.C., Chan, E., Kilts, J.D., Buchanan, R.W., Wai, E.P., Verma, S., Sim, K., Hariram, J., Jacob, R., Keefe, R.S., Chong, S.A. (2014). Proof-of-concept randomized controlled trial of pregnenolone in schizophrenia. Psychopharmacology, 231, 3647-3662. [CrossRef] [PubMed] [Google Scholar]
- Matsunaga, H., Mizota, K., Uchida, H., Uchida, T., Ueda, H. (2010). Endocrine disrupting chemicals bind to a novel receptor, microtubule-associated protein 2, and positively and negatively regulate dendritic outgrowth in hippocampal neurons. J Neurochem, 114, 1333-1343. [PubMed] [Google Scholar]
- Maurice, T., Junien, J.L., Privat, A. (1997). Dehydroepiandrosterone sulfate attenuates dizocilpine-induced learning impairment in mice via sigma 1-receptors. Behav Brain Res, 83, 159-164. [CrossRef] [PubMed] [Google Scholar]
- Maurice, T., Su, T.P., Privat, A. (1998). Sigma1 (sigma 1) receptor agonists and neurosteroids attenuate B25-35-amyloid peptide-induced amnesia in mice through a common mechanism. Neuroscience, 83, 413-428. [PubMed] [Google Scholar]
- Meltzer-Brody, S., Colquhoun, H., Riesenberg, R., Epperson, C.N., Deligiannidis, K.M., Rubinow, D.R., Li, H., Sankoh, A.J., Clemson, C., Schacterle, A., Jonas, J., Kanes, S. (2018). Brexanolone injection in post-partum depression: Two multicentre, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet, 392, 1058-1070. [CrossRef] [PubMed] [Google Scholar]
- Meziane, H., Mathis, C., Paul, S.M., Ungerer, A. (1996). The neurosteroid pregnenolone sulfate reduces learning deficits induced by scopolamine and has promnestic effects in mice performing an appetitive learning task. Psychopharmacology, 126, 323-330. [CrossRef] [PubMed] [Google Scholar]
- Mizota, K., Ueda, H. (2008). N-terminus of MAP2C as a neurosteroid-binding site. Neuroreport, 19, 1529-1533. [CrossRef] [PubMed] [Google Scholar]
- Monnet, F.P., Maurice, T. (2006). The sigma1 protein as a target for the non-genomic effects of neuro(active)steroids: Molecular, physiological, and behavioral aspects. J Pharmacol Sci, 100, 93-118. [CrossRef] [PubMed] [Google Scholar]
- Morales-Lazaro, S.L., Gonzalez-Ramirez, R., Rosenbaum, T. (2019). Molecular interplay between the Sigma-1 receptor, steroids, and ion channels. Front Pharmacol, 10, 419. [CrossRef] [PubMed] [Google Scholar]
- Murakami, K., Fellous, A., Baulieu, E.E., Robel, P. (2000). Pregnenolone binds to microtubule-associated protein 2 and stimulates microtubule assembly. Proc Natl Acad Sci USA, 97, 3579-3584. [CrossRef] [Google Scholar]
- Nanfaro, F., Cabrera, R., Bazzocchini, V., Laconi, M., Yunes, R. (2010). Pregnenolone sulfate infused in lateral septum of male rats impairs novel object recognition memory. Pharmacol Rep, 62, 265-272. [CrossRef] [PubMed] [Google Scholar]
- Orentreich, N., Brind, J.L., Rizer, R.L., Vogelman, J.H. (1984). Age changes and sex differences in serum dehydroepiandrosterone sulfate concentrations throughout adulthood. J Clin Endocrinol Metab, 59, 551-555. [CrossRef] [PubMed] [Google Scholar]
- Paresys, L., Hoffmann, K., Froger, N., Bianchi, M., Villey, I., Baulieu, E.E., Fuchs, E. (2016). Effects of the synthetic neurosteroid: 3beta-methoxypregnenolone (MAP4343) on behavioral and physiological alterations provoked by chronic psychosocial stress in tree shrews. Int J Neuropsychopharmacol, 19, 1-12. [Google Scholar]
- Peixoto, C., Devicari Cheda, J.N., Nardi, A.E., Veras, A.B., Cardoso, A. (2014). The effects of dehydroepiandrosterone (DHEA) in the treatment of depression and depressive symptoms in other psychiatric and medical illnesses: A systematic review. Curr Drug Targets, 15, 901-914. [CrossRef] [PubMed] [Google Scholar]
- Pinna, G., Rasmusson, A.M. (2014). Ganaxolone improves behavioral deficits in a mouse model of post-traumatic stress disorder. Front Cell Neurosci, 8, 256. [Google Scholar]
- Rasmusson, A.M., Pinna, G., Paliwal, P., Weisman, D., Gottschalk, C., Charney, D., Krystal, J., Guidotti, A. (2006). Decreased cerebrospinal fluid allopregnanolone levels in women with post-traumatic stress disorder. Biol Psychiatry, 60, 704-713. [CrossRef] [PubMed] [Google Scholar]
- Rasmusson, A.M., Marx, C.E., Jain, S., Farfel, G.M., Tsai, J., Sun, X., Geracioti, T.D., Hamner, M.B., Lohr, J., Rosse, R., Summerall, L., Naylor, J.C., Cusin, C., Lang, A.J., Raman, R., Stein, M.B. (2017). A randomized controlled trial of ganaxolone in post-traumatic stress disorder. Psychopharmacology, 234, 2245-2257. [CrossRef] [PubMed] [Google Scholar]
- Reddy, D.S., Kulkarni, S.K. (1998). Proconvulsant effects of neurosteroids pregnenolone sulfate and dehydroepiandrosterone sulfate in mice. Eur J Pharmacol, 345, 55-59. [CrossRef] [PubMed] [Google Scholar]
- Ritsner, M.S. (2010). Pregnenolone, dehydroepiandrosterone, and schizophrenia: Alterations and clinical trials. CNS Neurosci Ther, 16, 32-44. [Google Scholar]
- Ritsner, M., Maayan, R., Gibel, A., Weizman, A. (2007). Differences in blood pregnenolone and dehydroepiandrosterone levels between schizophrenia patients and healthy subjects. Eur Neuropsychopharmacol, 17, 358-365. [CrossRef] [PubMed] [Google Scholar]
- Romeo, E., Strohle, A., Spalletta, G., di Michele, F., Hermann, B., Holsboer, F., Pasini, A., Rupprecht, R. (1998). Effects of antidepressant treatment on neuroactive steroids in major depression. Am J Psychiatry, 155, 910-913. [CrossRef] [PubMed] [Google Scholar]
- Sands, D.E., Chamberlain, G.H. (1952). Treatment of inadequate personality in juveniles by dehydroisoandrosterone; preliminary report. Brit Med J, 2, 66-68. [CrossRef] [Google Scholar]
- Schverer, M., Lanfumey, L., Baulieu, E.E., Froger, N., Villey, I. (2018). Neurosteroids: Non-genomic pathways in neuroplasticity and involvement in neurological diseases. Pharmacol Ther, 191, 190-206. [CrossRef] [PubMed] [Google Scholar]
- Shirayama, Y., Muneoka, K., Fukumoto, M., Tadokoro, S., Fukami, G., Hashimoto, K., Iyo, M. (2011). Infusions of allopregnanolone into the hippocampus and amygdala, but not into the nucleus accumbens and medial prefrontal cortex, produce antidepressant effects on the learned helplessness rats. Hippocampus, 21, 1105-1113. [CrossRef] [PubMed] [Google Scholar]
- Uzunova, V., Sheline, Y., Davis, J.M., Rasmusson, A., Uzunov, D.P., Costa, E., Guidotti, A. (1998). Increase in the cerebrospinal fluid content of neurosteroids in patients with unipolar major depression who are receiving fluoxetine or fluvoxamine. Proc Natl Acad Sci USA, 95, 3239-3244. [CrossRef] [Google Scholar]
- Vallée, M., Mayo, W., Darnaudery, M., Corpechot, C., Young, J., Koehl, M., Le Moal, M., Baulieu, E.E., Robel, P., Simon, H. (1997). Neurosteroids: Deficient cognitive performance in aged rats depends on low pregnenolone sulfate levels in the hippocampus. Proc Natl Acad Sci USA, 94, 14865-14870. [CrossRef] [Google Scholar]
- Vallée, M., Vitello, S., Bellochio, L., Hébert-Chatelain, E., Monlezun, S., Martin-Garcia, E., Kasanetz, F., Baillie, G.L., Panin, F., Cathala, A., Roullot-Lacarrière, V., Fabre, S., Hurst, D.P., Lynch, D.L., Shore, D.M., Deroche-Gamonet, V., Spampinato, U., Revest, J.M., Maldonado, R., Reggio, P.H., Ross, R.A., Marsicano, G., Piazza, P.V. (2014). Pregnenolone can protect the brain from cannabis intoxication. Science, 343, 94-98. [Google Scholar]
- Walczak, C.E., Heald, R. (2008). Mechanisms of mitotic spindle assembly and function. Int Rev Cytol, 265, 111-158. [Google Scholar]
- Weng, J.H., Chung, B.C. (2016). Nongenomic actions of neurosteroid pregnenolone and its metabolites. Steroids, 111, 54-59. [CrossRef] [PubMed] [Google Scholar]
- Weng, J.H., Liang, M.R., Chen, C.H., Tong, S.K., Huang, T.C., Lee, S.P., Chen, Y.R., Chen, C.T., Chung, B.C. (2013). Pregnenolone activates CLIP-170 to promote microtubule growth and cell migration. Nat Chem Biol, 9, 636-642. [Google Scholar]
- Wieland, S., Lan, N.C., Mirasedeghi, S., Gee, K.W. (1991). Anxiolytic activity of the progesterone metabolite 5 alpha-pregnan-3 alpha-o1-20-one. Brain Res, 565, 263-268. [CrossRef] [PubMed] [Google Scholar]
- Wolkowitz, O.M., Reus, V.I., Roberts, E., Manfredi, F., Chan, T., Raum, W.J., Ormiston, S., Johnson, R., Canick, J., Brizendine, L., Weingartner, H. (1997). Dehydroepiandrosterone (DHEA) treatment of depression. Biol Psychiatry, 41, 311-318. [CrossRef] [PubMed] [Google Scholar]
- Wolkowitz, O.M., Reus, V.I., Keebler, A., Nelson, N., Friedland, M., Brizendine, L., Roberts, E. (1999). Double-blind treatment of major depression with dehydroepiandrosterone. Am J Psychiatry, 156, 646-649. [PubMed] [Google Scholar]
- Wong, P., Chang, C.C., Marx, C.E., Caron, M.G., Wetsel W.C., Zhang X. (2012). Pregnenolone rescues schizophrenia-like behavior in dopamine transporter knockout mice. PloS one, 7, e51455. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Froger, N. (2019). Potentialités thérapeutiques des neurostéroïdes en psychiatrie. Biologie Aujourd’hui, 213, 131-140
Liste des figures
 |
Figure 1 Voies métaboliques de la stéroïdogénèse montrant les neurostéroïdes actifs dans le système nerveux central, représentés soit par les hormones stéroïdes elles-mêmes (cadres rouges), soit par leurs précurseurs (cadres bleus), ou leurs métabolites (cadres verts). DHDOC : Dihydrodéoxycorticostérone ; DHEA : Déhydroépiandrostérone ; DHEA-S : Sulfate de déhydroépiandrostérone ; DHT : Dihydrotestostérone; DHP : Dihydroprogestérone ; DOC : Déoxycorticostérone ; PREG : Prégnénolone ; PREG-S : Sulfate de prégnénolone ; THDOC : Tétrahydrodéoxycorticostérone. |
| Dans le texte | |
 |
Figure 2 Multiplicité des actions pharmacologiques des neurostéroïdes dans le cerveau. Outre les voies génomiques activées par les neurostéroïdes de type hormone, des voies non génomiques spécifiques du système nerveux central peuvent également être activées par les neurostéroïdes. Selon la nature de ces voies, on peut distinguer (i) les neurostéroïdes inhibiteurs qui stimulent les récepteurs ionotropiques du GABA (GABA-A), (ii) les neurostéroïdes excitateurs, qui activent – directement ou indirectement – les récepteurs ionotropiques du glutamate de type NMDA, et inhibent les récepteurs GABA-A, et (iii) les neurostéroïdes microtubulaires qui vont se lier aux protéines microtubulaires, en particulier MAP2, pour renforcer la plasticité structurale. GABA-A : Récepteur ionotropique du GABA de type A ; PR : Récepteur nucléaire de la progestérone ; ER : Récepteur nucléaire des œstrogènes ; AR : Récepteur nucléaire des androgènes ; NMDA : N-Méthyl-D-aspartate, désigne un type de récepteur ionotropique du glutamate. |
| Dans le texte | |
 |
Figure 3 Développement clinique des neurostéroïdes en psychiatrie. Les dérivés sulfatés de la PREG et de la DHEA n’ont, pour l’heure, pas fait l’objet d’études cliniques, probablement en raison de leur faible sélectivité pharmacologique, de leur difficile passage de la barrière hémato-encéphalique, et de leur faible stabilité dans l’organisme. En revanche, l’ALLOP, par son action sélective GABAergique, a montré des potentialités thérapeutiques pour le traitement de la dépression du post-partum et de l’anxiété. La DHEA, bien qu’ayant une action pharmacologique peu sélective, a été testée pour le traitement de la dépression et de la schizophrénie. La PREG a également été explorée pour le traitement de ces pathologies psychiatriques, mais sa sélectivité pharmacologique reste limitée en raison de la production de métabolites actifs. Les dérivés synthétiques non métabolisables des neurostéroïdes constituent une nouvelle piste de recherche particulièrement prometteuse. Ainsi, le composé MAP4343, qui offre une meilleure sélectivité pharmacologique avec sa cible microtubulaire unique, est actuellement développé pour le traitement de la dépression. (Schéma modifié d’après Schverer et al., 2018). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


