| Numéro |
Biologie Aujourd’hui
Volume 215, Numéro 3-4, 2021
|
|
|---|---|---|
| Page(s) | 95 - 106 | |
| DOI | https://doi.org/10.1051/jbio/2021011 | |
| Publié en ligne | 11 mars 2022 | |
Article
Les protéines G : les transducteurs privilégiés des récepteurs à sept domaines transmembranaires
G proteins: privileged transducers of 7-transmembrane spanning receptors
Laboratoire de Pharmacologie Moléculaire, GIGA-Molecular Biology of Diseases, Université de Liège, CHU, B34, Tour GIGA (+4),
Avenue de l’Hôpital 11,
B-4000
Liège, Belgique
* Auteur correspondant : j.hanson@uliege.be
Reçu :
4
Novembre
2021
Les récepteurs couplés aux protéines G ou RCPG sont les récepteurs membranaires les plus abondants de notre génome avec environ 800 membres. Ils jouent un rôle essentiel dans la plupart des phénomènes physiologiques et physiopathologiques. De plus, ils constituent 30 % des cibles de médicaments actuellement commercialisés et restent un réservoir important pour de nouvelles thérapies innovantes. Leurs principaux effecteurs sont les protéines G hétérotrimériques. Celles-ci sont composées de 3 sous-unités, α, β et γ qui, lors du couplage avec un RCPG, se dissocient en Gα et Gβγ pour activer de nombreuses voies de signalisation. Cet article décrit certaines des avancées récentes dans la compréhension du fonctionnement et du rôle des protéines G hétérotrimériques. Après une courte introduction sur les RCPG, l’historique de la découverte des protéines G est décrit succinctement. Ensuite, les mécanismes fondamentaux de l’activation, la signalisation et la régulation des protéines G sont passés en revue. Les nouveaux paradigmes qui concernent la signalisation intracellulaire, la reconnaissance spécifique des protéines G par les RCPG ainsi que la signalisation biaisée sont également abordés.
Abstract
G protein-coupled receptors or GPCR are the most abundant membrane receptors in our genome with around 800 members. They play an essential role in most physiological and pathophysiological phenomena. In addition, they constitute 30% of the targets of currently marketed drugs and remain an important reservoir for new innovative therapies. Their main effectors are heterotrimeric G proteins. These are composed of 3 subunits, α, β and γ, which, upon coupling with a GPCR, dissociate into Gα and Gβγ to activate numerous signaling pathways. This article describes some of the recent advances in understanding the function and role of heterotrimeric G proteins. After a short introduction to GPCRs, the history of the discovery of G proteins is briefly described. Then, the fundamental mechanisms of activation, signaling and regulation of G proteins are reviewed. New paradigms concerning intracellular signaling, specific recognition of G proteins by GPCRs as well as biased signaling are also discussed.
Mots clés : Récepteurs couplés aux protéines G / RCPG / protéines G / signalisation intracellulaire / signalisation biaisée
Key words: G protein-coupled receptors / GPCR / G protein / intracellular signaling / biased signaling
© Société de Biologie, 2022
Introduction
Les récepteurs couplés aux protéines G ou RCPG (GPCR pour l’acronyme anglais) sont des récepteurs membranaires qui constituent la plus vaste famille de protéines codées par notre génome (Lander et al., 2001). Ces récepteurs ont en commun une structure à 7 domaines transmembranaires qui sont reliés par trois boucles extracellulaires et trois boucles intracellulaires (Katritch et al., 2013). On en dénombre environ 800, avec ∼ 365 récepteurs fonctionnels et ∼ 435 récepteurs « sensitifs » (olfaction, vision, goût, phéromones) (Alexander et al., 2021). D’après les analyses phylogénétiques les plus récentes, ils peuvent être répartis en 5 familles: Glutamate, Rhodopsin, Adhesion, Frizzled, Secretin (Nomenclature « GRAFS ») (Fredriksson et al., 2003). Un système plus ancien, qui reste régulièrement utilisé, les distribue en 6 classes : A (semblables à la Rhodopsine), B (famille des récepteurs de la Sécrétine), C (récepteurs Glutamate métabotropiques), D (récepteurs des phéromones), E (récepteurs de l’AMPc), F (récepteurs de type Frizzled/Smoothened), les classes D et E n’étant pas présentes chez les vertébrés (Alexander et al., 2021).
Lorsqu’ils sont activés par un agoniste (ils peuvent également présenter une activité constitutive, c’est-à-dire déclencher des voies de signalisation en l’absence de ligand), les RCPG adoptent une conformation qui leur permet de lier une protéine G hétérotrimérique et de transmettre un signal. De plus, cette activation entraîne généralement une phosphorylation interne du récepteur par des kinases spécifiques des récepteurs activés (G protein-coupled receptor kinases ou GRK) ou polyvalentes (PKA, PKC,…) (Tobin, 2008), ce qui promeut l’interaction avec d’autres partenaires intracellulaires, principalement les arrestines. Celles-ci mettent fin au couplage avec les protéines G et initient la formation d’un complexe protéique déclenchant l’internalisation (endocytose) des récepteurs. De plus, bien que le rôle des protéines G semble essentiel pour initier la signalisation (O’Hayre et al., 2017 ; Grundmann et al., 2018), les arrestines peuvent contribuer de manière significative à la signalisation des RCPG (Peterson & Luttrell, 2017). En soustrayant les récepteurs de la surface, l’endocytose marque la fin de la signalisation classique, mais certains récepteurs peuvent adopter des modes de signalisation intracellulaires (voir ci-dessous). Il faut néanmoins préciser que ce paradigme central n’est pas exempt d’exceptions. En effet, certains RCPG ne se lient pas aux protéines G mais recrutent les arrestines, par exemple le récepteur du complément C5aR2 (Okinaga et al., 2003 ; Pandey et al., 2021), certains récepteurs de chimiokines atypiques tels que ACKR3/CXCR7 (Rajagopal et al., 2010 ; Szpakowska et al., 2018) et D6 (Pandey et al., 2021) ou encore le récepteur orphelin GPR27 (Dupuis et al., 2017). L’inverse, une absence de recrutement des arrestines avec une signalisation par les protéines G, a également été observé notamment dans les cas du récepteur du gastric inhibitory polypeptide ou GIP (Al-Sabah et al., 2014), des récepteurs adrénergiques β3 (Cao et al., 2000) et α2A (DeGraff et al., 1999) ou encore de celui du GnRH1 (Hislop et al., 2005). Plus récemment, des récepteurs fonctionnels qui ne s’associent ni aux protéines G, ni aux arrestines ont été décrits (Le Mercier et al., 2021). Ces récepteurs, qualifiés d’atypiques ou non-canoniques, sont de plus en plus étudiés car ils peuvent être utilisés comme modèles pour mieux comprendre la signalisation des RCPG, en particulier leurs fonctions indépendantes des protéines G.
D’autres niveaux de régulation existent et font de la pharmacologie des RCPG un système sophistiqué, diversifié et particulièrement complexe. En effet, d’autres partenaires de signalisation existent et permettent l’activation de nombreuses voies de signalisation au sein de la cellule (Magalhaes et al., 2012). Les RCPG peuvent former des homo- ou des héterodimères, voire des oligomères qui engendrent de nouvelles entités pharmacologiques (Milligan et al., 2019 ; Sleno & Hébert, 2019). Ces complexes peuvent être indispensables au bon fonctionnement du récepteur – le récepteur métabotropique GABAB étant l’exemple typique (Marshall et al., 1999) –, ou bien former des associations plus transitoires et réversibles (Sleno & Hébert, 2019).
L’importance des RCPG en médecine est considérable car ils sont au cœur de la plupart des phénomènes physiologiques. Assez logiquement, ils constituent la cible primaire d’environ 30 % des médicaments actuellement commercialisés (Hauser et al., 2017 ; Sriram & Insel, 2018). Cependant, sur les ∼ 365 récepteurs connus, seule une portion réduite est bien caractérisée et utilisée comme cible (une centaine environ). De plus, il reste une centaine de récepteurs dits « orphelins », qui n’ont pas de ligands endogènes connus (Davenport & Harmar, 2013 ; Laschet et al., 2018). C’est pourquoi on estime que le potentiel de cette famille pour la découverte de nouveaux agents thérapeutiques demeure très important.
Cet article décrit certaines des avancées récentes dans la compréhension du fonctionnement et du rôle des protéines G hétérotrimériques dans la signalisation des RCPG. Le texte est adapté d’un séminaire donné dans le cadre des activités de la Société de Biologie. Notre but n’est pas de dresser un état des lieux exhaustif du sujet mais d’introduire les bases pour des lecteurs qui ne sont pas nécessairement spécialistes et de se concentrer sur certaines avancées conceptuelles récentes et marquantes. Le lecteur intéressé pourra trouver de nombreux exemples d’articles de revue parmi les références afin de pouvoir approfondir certains aspects si nécessaire.
Découverte des protéines G
L’histoire de la découverte des protéines G est une aventure scientifique passionnante dont certains épisodes méritent d’être racontés. En effet, cette révolution conceptuelle majeure en pharmacologie, biochimie et biologie a profondément changé notre façon d’envisager la manière dont les cellules transmettent l’information à travers la membrane cellulaire. Il est impossible de décrire ici, en détail, la contribution de tous les acteurs qui ont contribué à ces travaux. Le lecteur intéressé pourra trouver des informations détaillées dans divers articles qui font référence (Sutherland, 1971 ; Milligan & Kostenis, 2006 ; Gilman, 2012 ; Lefkowitz, 2018).
Les travaux de Earl W. Sutherland (Prix Nobel de Physiologie ou Médecine en 1971) sur l’AMPc ont été parmi les étapes fondamentales qui ont permis la découverte des protéines G (Sutherland, 1971). Il paraissait alors clair que certaines hormones étaient capables de stimuler la production d’AMPc, mais le mécanisme précis de cet effet restait méconnu. Le fait que ce phénomène soit la conséquence de la liaison de ces hormones sur des récepteurs membranaires n’était pas encore le modèle qui faisait consensus. D’ailleurs, il est étonnant, rétrospectivement, de constater que lors de l’exposé donné à l’occasion de la remise du Prix Nobel, Sutherland n’excluait pas un mode d’action direct de l’hormone sur l’adénylate cyclase (AC), l’enzyme responsable de la synthèse d’AMPc. En effet, il pensait, comme d’autres, que l’AC pouvait être directement le récepteur de la noradrénaline dans la plupart des tissus (Figure 1) (Sutherland & Robison, 1966 ; Sutherland, 1971 ; Lefkowitz, 2018). Deux scientifiques ont été reconnus comme les principaux découvreurs des protéines G et ont reçu le prix Nobel de Physiologie ou Médecine en 1994 pour cela, il s’agit d’Alfred G. Gilman et de Martin Rodbell. C’est ce dernier qui a proposé le premier que le GTP était indispensable à la stimulation de l’AC (Rodbell et al., 1971). En effet, les tampons utilisés à l’époque contenaient de l’ATP qui, en raison d’une pureté insuffisante, renfermait également des traces conséquentes de GTP (Milligan & Kostenis, 2006 ; Gilman, 2012). L’amélioration de la pureté des réactifs a révélé la nécessité de la présence de ce substrat. Ensuite, un des modèles les plus importants pour la compréhension du système de couplage entre le récepteur, la protéine G et l’AC a été une lignée cellulaire dérivée du lymphome murin S49 qui avait perdu la capacité de répondre aux agonistes β-adrénergiques (qui activent Gs). L’hypothèse initiale postulait que ces cellules n’exprimaient plus l’AC et elles avaient logiquement reçu le nom de cyc− ou AC− (Bourne et al., 1975 ; Coffino et al., 1975). Cependant, les analyses biochimiques conduites sur cette lignée ont infirmé cette hypothèse puisque des extraits membranaires contenaient à la fois les récepteurs β et l’AC (Ross & Gilman, 1977). L’élément qui faisait défaut était en réalité la protéine liant le GTP, appelée « protéine G » pour cette raison (dans ce cas-ci, Gs). La validité de ce modèle a été définitivement démontrée après purification de la protéine Gs et la reconstitution d’un système fonctionnel dans les cellules S49 cyc− (Northup et al., 1980). Au même moment, le modèle, visionnaire et encore utilisé aujourd’hui avec quelques adaptations, de complexe ternaire (ligand-récepteur-protéine G) a été proposé par Robert Lefkowitz et son équipe (De Lean et al., 1980 ; Samama et al., 1993).
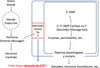 |
Figure 1 Modèle proposé par Earl W. Sutherland pour la génération d’AMPc par l’adénylate cyclase en réponse à diverses hormones. Adapté de Sutherland E.W., « Studies on the Mechanism of Hormone Action », présenté à la remise du prix Nobel de Physiologie ou Médecine 1971. |
Activation, signalisation et régulation des protéines G
Activation
D’un point de vue biochimique, les protéines G sont des GTPases qui ont la capacité d’hydrolyser le GTP en GDP (Figure 2). Il convient de distinguer les petites protéines G monomériques, qui appartiennent à la superfamille Ras (Rat Sarcoma virus) (Qu et al., 2019), des protéines G hétérotrimériques qui nous intéressent ici. Ces deux catégories de protéines G ont en commun de fonctionner en alternant entre une forme active (liée au GTP) et une forme inactive (liée au GDP) et de participer à de nombreuses voies de signalisation (Figure 3). Les protéines G qui se lient aux RCPG sont composées de trois sous-unités : α, β et γ. La sous-unité α est celle qui est apparentée aux petites protéines G de type Ras mais s’en distingue par la présence d’un domaine additionnel caractérisé par la présence de nombreuses hélices α (appelé α-helical domain ou parfois H-domain dans la littérature) en plus du domaine GTPase (Ras-like domain ou G-domain) qui est semblable pour toutes les protéines G (Figure 4). Les sous-unités β et γ forment un complexe indissociable, Gβγ (Hepler & Gilman, 1992). Après fixation au récepteur activé, la sous-unité Gα échange une molécule de GDP pour une de GTP. Cet échange provoque la dissociation des sous-unités Gα et Gβγ qui peuvent chacune inhiber ou activer différents effecteurs cellulaires. La protéine hétérotrimérique reste active jusqu’à ce que l’activité GTPase de la sous-unité α hydrolyse le GTP pour former du GDP, plaçant le système dans un état inactif, disponible pour une nouvelle stimulation (Oldham & Hamm, 2008). Le mécanisme précis par lequel le récepteur activé induit un changement d’état de la protéine G est resté longtemps mal compris et certaines questions restent ouvertes. Toutefois, des progrès récents en biologie structurale, biophysique et modélisation ont permis de mieux comprendre les mécanismes moléculaires à l’œuvre dans ce processus (décrits en détail dans différentes revues plus complètes: Oldham et al., 2006 ; Preininger et al., 2013 ; Mahoney & Sunahara, 2016 ; Sprang, 2016 ; Duc et al., 2017 ; Martemyanov, 2021). Le réarrangement allostérique qui se déclenche au contact du récepteur dans sa partie intracellulaire semble conservé pour toutes les familles de protéines G (Flock et al., 2015). En effet, la plupart des résidus qui participent à la réorganisation interne de la sous-unité Gα lors de son activation sont présents dans tous les sous-types de protéines Gα et conservés au cours de l’évolution (Flock et al., 2015). À l’état inactif, deux hélices α du domaine G/Ras, α1 et α5, entretiennent des contacts importants et le GDP est enfoui à l’interface entre les deux domaines. Lors de l’activation, c’est l’hélice α5 qui va interagir principalement avec les domaines transmembranaires et les boucles intracellulaires ouvertes du récepteur (Oldham et al., 2006 ; Oldham & Hamm, 2007). On note également une contribution significative de la partie N-terminale qui entretient des interactions importantes avec le récepteur activé (Rasmussen et al., 2011 ; Mahoney & Sunahara, 2016). Ce premier réarrangement provoque une perte de contacts partielle entre α5 et α1 ainsi que des processus de structuration de α5 et de déstructuration de α1 (Flock et al., 2015). L’interaction avec le récepteur va entraîner l’ouverture du domaine à hélices α, qui est une étape nécessaire mais non suffisante (Van Eps et al., 2011 ; Dror et al., 2015) pour libérer le nucléotide. En effet, il doit se produire également un changement dans la configuration du site de liaison du GDP (Mahoney & Sunahara, 2016). Le récepteur joue donc le rôle de facilitateur et accélérateur de la dissociation du GDP qui est typiquement l’étape limitante de l’activation de la protéine G. Il se forme ensuite un complexe intermédiaire du récepteur activé (+ ligand éventuellement) – protéine G vide (Rasmussen et al., 2011 ; DeVree et al., 2016). Ce complexe est stable (il peut d’ailleurs être isolé en l’absence de GTP, Figure 4) mais la sous-unité α ne reste pas longtemps inoccupée dans les conditions physiologiques car la concentration de GTP dans la cellule est très importante (200–300 μM) (McKee et al., 1999). Lorsque le GTP se fixe, de nouvelles modifications se mettent en place et entraînent la dissociation entre Gα-GTP et le dimère Gβγ. Une étude récente a mis en évidence un motif conservé au sein de toutes les protéines G, « Gly – Arg – Glu » (GRE), qui effectue la jonction conformationnelle entre le site de liaison du GTP (en particulier son phosphate γ qui n’est pas présent au niveau du GDP) et l’interface avec Gβγ (Knight et al., 2021 ; Martemyanov, 2021). Après l’hydrolyse du GTP, l’affinité de la sous-unité Gα pour ses effecteurs diminue légèrement mais elle augmente considérablement pour le dimère Gβγ (Sprang, 2016), de telle sorte que se forme à nouveau la protéine G hétérotrimérique inactive.
De manière remarquable, certaines mutations qui affectent les acides aminés impliqués dans ces mécanismes entraînent une activation ou une inhibition constitutive des protéines G et mènent à certaines pathologies (Iiri et al., 1994 ; Schwindinger et al., 1994 ; Flock et al., 2015), y compris des cancers (Dorsam & Gutkind, 2007 ; Arang & Gutkind, 2020).
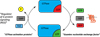 |
Figure 2 Cycle d’activation-désactivation des protéines G. Les protéines G sont des GTPases dont l’activité est modulée positivement par les Guanine exchange factors ou « GEF » (typiquement, les RCPG) qui facilitent l’échange du GDP par le GTP et négativement par les GTPase-activating proteins ou « GAP » (ex: Regulators of G protein signaling ou RGS). |
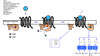 |
Figure 3 Différentes voies de signalisation activées par les protéines G. |
 |
Figure 4 Structure 3D des protéines G. A. Sous-unité Gαs, seule, avec son domaine Ras et à « hélices α ». La protéine G a été cristallisée avec une molécule de GTP-γ-S afin de bloquer la sous-unité dans sa forme active (ce dérivé de GTP n’est pas hydrolysable). B. Récepteur β2AR en complexe avec la protéine Gαs. On peut distinguer l’hélice 5α qui forme des contacts importants avec le cœur du récepteur. |
Signalisation
À ce jour, seize gènes (certains donnant lieu à plusieurs isoformes) codant pour les sous-unités Gα, cinq pour les Gβ et douze pour les Gγ (Wettschureck & Offermanns, 2005 ; Syrovatkina et al., 2016) ont été identifiés. Les protéines G sont regroupées en quatre familles principales sur la base de leurs séquences et de leurs propriétés fonctionnelles (Figure 3) (Wettschureck & Offermanns, 2005 ; Milligan & Kostenis, 2006 ; Syrovatkina et al., 2016).
Les sous-unités α de la famille Gs ont comme caractéristique de stimuler l’AC pour augmenter les taux d’AMPc et sont codées par deux gènes : GNAS pour Gαs et Gαslong, et GNAL pour Gαolf. Alors que l’expression de Gαs est ubiquitaire, la forme longue Gαslong a un profil plus particulier. Bien que cette dernière soit capable de s’associer à Gβγ et de stimuler l’AC, sa fonction précise reste peu étudiée. La protéine Gαolf a une séquence très proche de celle de Gαs. Sa fonction principale est d’être la protéine G effectrice des RCPG olfactifs au sein de neurones spécialisés. Néanmoins, Gαolf est également exprimée dans certaines régions du cerveau et, dans une moindre mesure, dans des tissus périphériques qui n’ont pas de lien avec l’olfaction (Flegel et al., 2013). En particulier au niveau du striatum, l’expression de Gαolf est plus importante que celle de Gs (Zhuang et al., 2000). La fonction non olfactive de Gαolf est peu étudiée mais un travail récent a mis en évidence que Gαolf présente dans le striatum pouvait modifier la réponse à des agonistes du récepteur dopaminergique D1, comparativement au cortex où celui-ci est couplé à Gs (Yano et al., 2018). Ce type de signalisation biaisée pourrait être mis à profit pour concevoir des médicaments plus sélectifs pour certains tissus.
La famille Gi/o contient les protéines Gαi1 (GNAI1), Gαi2 (GNAI2) et Gαi3 (GNAI3) ainsi que les protéines Gαo (GNAO1, qui produit 2 isoformes, Gαoa et Gαob), Gαz (GNAZ), Gαt1 (GNAT1), Gαt2 (GNAT2) et Gαg (GNAT3). Elles ont comme caractéristique d’inactiver l’adénylate cyclase et, ce faisant, d’induire une diminution des niveaux d’AMPc. Elles sont toutes sensibles à l’action de la toxine pertussique (PTX), à l’exception notable de Gαz (Fong et al., 1988 ; Fields & Casey, 1997). Les protéines Gαt1 et Gαt2 sont présentes au niveau de la rétine où elles sont impliquées dans la perception de la lumière et des couleurs (Wettschureck & Offermanns, 2005). La protéine Gαg contribue à la perception du goût (Wettschureck & Offermanns, 2005 ; Syrovatkina et al., 2016). Les protéines Gαi1-3 ont une expression ubiquitaire tandis Gαo est principalement présente dans le système nerveux et possède des fonctions spécifiques comme par exemple dans la pathophysiologie des troubles du mouvement (Muntean et al., 2021). De plus, Gαo semble moduler l’AC de manière indirecte, par l’intermédiaire de Gβγ plutôt que par une interaction directe comme dans le cas de Gαi (Wong et al., 1992 ; Taussig et al., 1994 ; Wettschureck & Offermanns, 2005 ; Muntean et al., 2021). La protéine Gαz a un profil d’expression particulier, principalement dans le cerveau (Fong et al., 1988) et aussi dans certains tissus périphériques bien précis (Yang et al., 2000), mais elle est relativement peu étudiée. Différentes fonctions physiologiques lui ont néanmoins été attribuées, par exemple dans l’agrégation plaquettaire (Yang et al., 2000), le contrôle de la sécrétion d’insuline (Kimple et al., 2008) ou encore celui des rythmes circadiens (Doi et al., 2016).
La famille Gq/11 inclut les sous-unités Gαq (GNAQ), Gα11 (GNA11), Gα15 (GNA15) et Gα16 (GNA16), qui est l’orthologue chez l’Homme de la forme murine Gα15. Elles sont toutes couplées à l’activation de la phospholipase (PL)C-β, ce qui conduit à l’hydrolyse du phosphatidylinositol-4, 5-bisphosphate (PiP2) et à la production d’inositol triphosphate (IP3) et de diacylglycérol (DAG). La propriété principale de l’IP3 est de libérer les ions calcium (Ca2+) des réserves intracellulaires situées dans le réticulum endoplasmique. Le DAG agit comme un activateur de la protéine kinase C (PKC) qui est un régulateur important de plusieurs processus cellulaires. Alors que les sous-unités Gαq/11 ont une expression quasi ubiquitaire, les protéines Gα15/16 sont principalement présentes dans les cellules hématopoiétiques et les Gα14 ne sont exprimées que dans quelques tissus, notamment le rein, les poumons et la rate (Wettschureck & Offermanns, 2005). La différence de fonction entre les sous-unités Gαq et Gα11 n’est pas encore bien comprise car leurs expressions respectives se recouvrent et elles se lient aux mêmes récepteurs. Les rôles spécifiques de Gα15/16 et Gα14 restent à préciser même si certaines de leurs fonctions individuelles ont été rapportées (Avasarala et al., 2013 ; Sugino et al., 2016 ; Zou et al., 2019).
Enfin, la famille Gα12/13, qui comprend Gα12 et Gα13, a été, jusqu’à présent, moins bien étudiée en comparaison des autres familles de protéines G. D’un point de vue fonctionnel, ces deux sous-unités ont la capacité d’activer indirectement RhoA, une petite GTPase (Worzfeld et al., 2008), par l’intermédiaire d’un groupe de Guanine Exchange Factors, les RhoGEF. De plus, Gα12 et Gα13 interagissent directement avec d’autres effecteurs. Elles affectent principalement la régulation du cytosquelette et de la contraction actine-myosine et jouent un rôle dans les processus cellulaires qui en dépendent, telles la forme de la cellule, la migration, la contractilité et l’adhésion (Worzfeld et al., 2008).
Le complexe Gβγ forme une entité fonctionnelle qui affecte ses propres cibles, au même titre que les sous-unités Gα. Un des effecteurs directs le mieux connu de Gβγ est le canal GIRK qui joue un rôle important dans la régulation du potentiel membranaire neuronal. Un autre rôle important qui a été assigné à Gβγ est le recrutement des GRK2/3 lors de l’activation des récepteurs. La PLC-β a longtemps été considérée comme un effecteur de Gβγ libéré par Gi mais une élégante étude a récemment remis en cause ce paradigme. En effet, en l’absence de Gαq, Gβγ ne peut, seule, activer la PLC-β (Pfeil et al., 2020). Par ailleurs, l’évolution des technologies permet à présent de prendre en considération la multitude de combinaisons possibles pour Gβγ, soixante en tout (avec 5 Gβ et 12 Gγ). Par exemple, Masuho et al. (2021) ont développé récemment une série de biosenseurs qui permettent de mesurer spécifiquement l’activation du dimère Gβγ. Grâce à ces outils, les auteurs ont pu observer que les types de Gβ et Gγ qui composent le dimère déterminent la cinétique et l’efficacité des réponses des RCPG. De plus, la nature du dimère Gβγ influence la manière dont celui-ci se distribue dans différents compartiments cellulaires après l’activation.
Régulation
On peut envisager les RCPG comme des Guanine Exchange Factors (GEF) qui favorisent l’échange de GDP pour du GTP dans les protéines G par un effet allostérique consécutif à leur interaction avec celles-ci (voir ci-dessus et Figure 2). Des protéines GEF existent également pour toutes les protéines RAS (nous en avons vu un exemple avec Rho-GEF). D’autres partenaires, les GTPase-activating proteins (GAP) ont l’effet inverse car, en accélérant l’hydrolyse du GTP, elles favorisent leur inactivation. Dans le cas des protéines G hétérotrimériques, les principales protéines GAP sont les Regulators of G protein signaling (RGS), dont on connaît une trentaine de membres (Hollinger & Hepler, 2002). Alors que les récepteurs permettent de différencier le signal et que les protéines G assurent la spécificité des répercussions cellulaires, les RGS déterminent en partie la durée de la signalisation (Masuho et al., 2020). Ces régulateurs indirects interviennent dans de nombreux processus physiologiques et offrent un potentiel important en tant que cibles de médicaments innovants. Ils font l’objet de recherches particulièrement actives comme le soulignent de nombreux articles de revue (Hollinger & Hepler, 2002 ; Magalhaes et al., 2012 ; Sjögren, 2017 ; Almutairi et al., 2020 ; Doyen et al., 2020).
Spécificité des protéines G pour les RCPG
Bien que les protéines G soient en nombre relativement restreint, elles interagissent avec de nombreux récepteurs qui peuvent être très différents (Hermans, 2003). Plusieurs domaines sont impliqués dans ces interactions (Okashah et al., 2019), mais c’est l’hélice α5 située dans la partie C-terminale des protéines G qui a une influence importante sur leur spécificité pour un récepteur donné (Kostenis et al., 2005). Il est d’ailleurs remarquable que l’échange de seulement trois acides aminés de la partie C-terminale de Gαq par ceux de Gαi permette le couplage de cette protéine chimère Gq/i à des récepteurs qui n’interagissent normalement qu’avec Gαi (Conklin et al., 1993). Cette propriété des protéines G a permis le développement d’outils qui ont grandement facilité la mise en place de tests pour la détection de l’activation des récepteurs ainsi que pour découvrir de nouveaux ligands ou apparier des récepteurs orphelins à leur ligand endogène (Kostenis et al., 2005).
Par ailleurs, les RCPG sont capables d’activer une, plusieurs ou bien toutes les familles de protéines G (Hermans, 2003 ; Wettschureck & Offermanns, 2005 ; Syrovatkina et al., 2016 ; Abboud et al., 2020 ; Hauser et al., 2021). Le terme de « promiscuité », pour illustrer le manque de « fidélité » de certains récepteurs, est souvent utilisé dans ce contexte. On parle également de promiscuité pour les protéines G qui peuvent se lier à la plupart des récepteurs, ce qui peut prêter à confusion (Kostenis et al., 2005). Les acides aminés qui déterminent la sélectivité du côté des protéines G peuvent être si peu nombreux qu’il était attendu qu’il en soit de même du côté des récepteurs, quelqu’en soit le type. Pourtant, les mécanismes ou les éléments structuraux qui expliquent la sélectivité ou la promiscuité de certains récepteurs envers les différentes familles de protéines G sont encore mal compris. Des études récentes ont apporté un éclairage sur ce problème essentiel pour comprendre la signalisation des RCPG. Les données structurales sur les complexes RCPG-Protéines G étant de plus en plus abouties (Moreira, 2014 ; Carpenter & Tate, 2017 ; García-Nafría & Tate, 2019), certaines avancées conceptuelles ont pu être récemment proposées. Par exemple, en analysant plusieurs interfaces connues, Flock et al. (2017) ont proposé que la capacité d’un récepteur donné à s’associer à une protéine G soit acquise (ou perdue) au cours de processus liés à l’évolution ou à la co-évolution. Dans ce modèle astucieux, les auteurs proposent que les motifs des protéines G reconnus par les récepteurs sont identiques mais que chaque récepteur utilise des résidus différents, comme lorsque des clés différentes ouvrent la même serrure. De plus, ce mécanisme serait la conséquence d’une évolution parallèle, deux récepteurs différents convergeant vers la reconnaissance d’une même protéine G par des processus distincts. D’autres auteurs ont réalisé une analyse exhaustive du profil de couplage de l’ensemble des récepteurs, qui est maintenant connu avec plus de précision (Inoue et al., 2019 ; Okashah et al., 2019 ; Hauser et al., 2021). Il ressort de ces études plus systématiques que, bien que l’on observe beaucoup de variabilité, certaines séquences de reconnaissance des protéines G sont communes, ce qui peut permettre de prédire, au moins dans certains cas, à quelle protéine G un récepteur va se lier. Par ailleurs, les récepteurs couplés à la famille Gq et Gs semblent présenter plus de promiscuité que les autres. À l’inverse, les récepteurs qui s’associent à la famille Gi sont plus sélectifs (Okashah et al., 2019).
Signalisation intracellulaire par les protéines G
Il était généralement admis que la signalisation des RCPG prenait place au niveau de la membrane cellulaire – assez logiquement puisque les protéines G sont ancrées dans la membrane – et que les arrestines étaient sensées empêcher toute liaison avec les protéines G. Toutefois ce paradigme a été modifié quand plusieurs équipes ont montré que certains récepteurs pouvaient se coupler aux protéines G dans des compartiments intracellulaires tels que les endosomes (Hanyaloglu & von Zastrow, 2008 ; Calebiro et al., 2010 ; Irannejad & von Zastrow, 2014 ; Lohse & Hofmann, 2015 ; Calebiro & Koszegi, 2019 ; von Zastrow & Sorkin, 2021). Cela a d’abord été observé pour des récepteurs couplés à Gs tels que le récepteur de la thyréostimuline (TSH) (Calebiro et al., 2009), celui de l’hormone parathyroïdienne (PTH) (Ferrandon et al., 2009) et le récepteur adrénergique β2AR (Irannejad et al., 2013 ; Lohse & Calebiro, 2013). De nombreux autres travaux sont venus corroborer ces observations et la liste de récepteurs capables de signaler de manière intracellulaire ne cesse de s’allonger. On peut citer par exemple les récepteurs dopaminergiques (Kotowski et al., 2011), ceux de la vasopressine (V2R) (Feinstein et al., 2013), du Glucagon-like peptide 1 (GLP-1R) (Kuna et al., 2013), de l’hormone lutéinisante (LHCGR) (Lyga et al., 2016) ou encore le récepteur du GIP (Ismail et al., 2016). Plus récemment, la signalisation intracellulaire de récepteurs couplés à Gq/11 a été mise en évidence (Wright et al., 2021). De plus, certains investigateurs ont proposé que les RCPG puissent signaler à partir d’autres compartiments tels les mitochondries (Hebert-Chatelain et al., 2016) et le noyau (Tadevosyan et al., 2012). Les implications de ces découvertes sont importantes tant au niveau physiologique que thérapeutique. En effet, s’ajoute alors un niveau de régulation spatial et temporel à la signalisation des RCPG, permettant de mieux comprendre certains processus physiologiques dans le temps. De plus, des possibilités de traitements ciblés uniquement sur certains processus cellulaires déclenchés par l’activation des RCPG pourraient aussi être envisagées.
Signalisation biaisée et protéines G
Il est à présent établi que certains ligands peuvent biaiser la signalisation des RCPG. Du fait de leur nature allostérique, les RCPG peuvent adopter des conformations distinctes en fonction du ligand qui s’y fixe. Chaque conformation peut se comporter différemment envers les partenaires intracellulaires et donc activer les voies de signalisation de manière distincte. Ce phénomène a pour le moment été principalement mesuré expérimentalement sur les biais entre protéines G et arrestines par exemple (Kenakin, 2011, 2013 ; Kolb et al., 2021). Cependant, cette signalisation biaisée pourrait être mise à profit également pour cibler des récepteurs qui s’associent à plusieurs sous-types de protéines G. Cela nécessite la mise en place de tests qui permettent le profilage des protéines G pour un même récepteur (Laschet et al., 2019 ; Laschet & Hanson, 2021 ; Mancini et al., 2021 ; Wright & Bouvier, 2021). Un des systèmes les mieux étudiés concerne les récepteurs dopaminergiques. Dès la fin des années 1990, certaines études ont relevé que, bien que le récepteur D2 ne se lie qu’à une famille de protéines G (Gi/o), l’activation des différentes protéines G variait en fonction du ligand (Cordeaux et al., 2001 ; Gazi et al., 2003). En utilisant un test de complémentation pour chaque protéine G, notre groupe a montré que des agonistes D2 utilisés comme antiparkinsoniens avaient un profil différent pour Gi1 ou Go (Laschet et al., 2019). Des résultats similaires ont également été obtenus par d’autres investigateurs pour les antipsychotiques, qui ciblent également les récepteurs D2 (Von Moo et al., 2021). Le biais entre différentes protéines G a aussi été observé pour d’autres récepteurs tels que le récepteur cannabinoïde CB1 (Mukhopadhyay & Howlett, 2005) ou le récepteur de la thrombine PAR1 (McLaughlin et al., 2005). Ces phénomènes de biais peuvent être particulièrement pertinents dans la physiopathologie de quelques maladies. Par exemple, certaines mutations du récepteur de la mélatonine MT2 sont associées à un risque accru pour le diabète de type 2. Karamitri et al. (2018) ont montré sur 40 variants que ces mutations affectaient le profil d’activation des protéines G et de l’arrestine.
Conclusions
Depuis leur découverte au début des années 1980, les protéines G n’ont pas cessé de montrer leur importance au niveau de la signalisation cellulaire. La complexité de leur fonctionnement commence à peine à être révélée, notamment dans la dimension temporelle et spatiale de la signalisation. Le domaine de recherche des protéines G va continuer à se développer dans le futur dans de nombreuses directions. On peut raisonnablement estimer que les données structurelles de RCPG en complexes avec les protéines G vont continuer à s’accumuler, ce qui va entraîner une meilleure compréhension des facteurs qui déterminent la spécificité et la dynamique du couplage. Ces données devraient également contribuer à répondre aux questions liées à l’activation des protéines G au contact des récepteurs. De plus, de nombreux outils sont à présent disponibles pour mieux investiguer les nouvelles fonctions, notamment intracellulaires, des protéines G. Ces différents progrès vont permettre d’établir une cartographie complète des voies de signalisation prenant en compte la diversité des fonctions liées aux protéines G et aux RCPG. En effet, en intégrant les signaux venant de différents récepteurs, les protéines G font converger les informations vers une réponse cellulaire ciblée, spécifique et extrêmement précise. C’est pourquoi elles peuvent avoir un rôle important dans la physiopathologie de différentes maladies et sont régulièrement proposées comme cibles thérapeutiques (Arang & Gutkind, 2020 ; Kostenis et al., 2020 ; Li et al., 2020). Enfin, des mesures plus précises des biais liés aux protéines G sont aujourd’hui possibles et ne manqueront pas d’amener des avancées importantes dans le développement de nouveaux médicaments innovants agissant sur les RCPG.
Références
- Abboud, D., Daly, A.F., Dupuis, N., Bahri, M.A., Inoue, A., Chevigné, A., Ectors, F., Plenevaux, A., Pirotte, B., Beckers, A. Hanson, J. (2020). GPR101 drives growth hormone hypersecretion and gigantism in mice via constitutive activation of Gs and Gq/11. Nat Commun, 11, 4752. [CrossRef] [PubMed] [Google Scholar]
- Alexander, S.P., Christopoulos, A., Davenport, A.P., Kelly, E., Mathie, A., Peters, J.A., Veale, E.L., Armstrong, J.F., Faccenda, E., Harding, S.D., Pawson, A.J., Southan, C., Davies, J.A., Abbracchio, M.P., Alexander, W., Al-Hosaini, K., Bäck, M., Barnes, N.M., Bathgate, R., Beaulieu, J.-M., Bernstein, K.E., Bettler, B., Birdsall, N.J.M., Blaho, V., Boulay, F., Bousquet, C., Bräuner-Osborne, H., Burnstock, G., Calé, G., Castaño, J.P., Catt, K.J., Ceruti, S., Chazot, P., Chiang, N., Chini, B., Chun, J., Cianciulli, A., Civelli, O., Clapp, L.H., Couture, R., Csaba, Z., Dahlgren, C., Dent, G., Singh, K.D., Douglas, S.D., Dournaud, P., Eguchi, S., Escher, E., Filardo, E.J., Fong, T., Fumagalli, M., Gainetdinov, R.R., Gasparo, M. de, Gerard, C., Gershengorn, M., Gobeil, F., Goodfriend, T.L., Goudet, C., Gregory, K.J., Gundlach, A.L., Hamann, J., Hanson, J., Hauger, R.L., Hay, D.L., Heinemann, A., Hollenberg, M.D., Holliday, N.D., Horiuchi, M., Hoyer, D., Hunyady, L., Husain, A., Ijzerman, A.P., Inagami, T., Jacobson, K.A., Jensen, R.T., Jockers, R., Jonnalagadda, D., Karnik, S., Kaupmann, K., Kemp, J., Kennedy, C., Kihara, Y., Kitazawa, T., Kozielewicz, P., Kreienkamp, H.-J., Kukkonen, J.P., Langenhan, T., Leach, K., Lecca, D., Lee, J.D., Leeman, S.E., Leprince, J., Li, X.X., Williams, T.L., Lolait, S.J., Lupp, A., Macrae, R., Maguire, J., Mazella, J., McArdle, C.A., Melmed, S., Michel, M.C., Miller, L.J., Mitolo, V., Mouillac, B., Müller, C.E., Murphy, P., Nahon, J.-L., Ngo, T., Norel, X., Nyimanu, D., O’Carroll, A.-M., Offermanns, S., Panaro, M.A., Parmentier, M., Pertwee, R.G., Pin, J.-P., Prossnitz, E.R., Quinn, M., Ramachandran, R., Ray, M., Reinscheid, R.K., Rondard, P., Rovati, G.E., Ruzza, C., Sanger, G.J., Schöneberg, T., Schulte, G., Schulz, S., Segaloff, D.L., Serhan, C.N., Stoddart, L.A., Sugimoto, Y., Summers, R., Tan, V.P., Thal, D., Thomas, W.W., Timmermans, P.B.M.W.M., Tirupula, K., Tulipano, G., Unal, H., Unger, T., Valant, C., Vanderheyden, P., Vaudry, D., Vaudry, H., Vilardaga, J.-P., Walker, C.S., Wang, J.M., Ward, D.T., Wester, H.-J., Willars, G.B., Woodruff, T.M., Yao, C., Ye, R.D. (2021). The Concise Guide to Pharmacology 2021/22: G protein-coupled receptors. Br J Pharmacol, 178(Suppl 1), S27-S156. [PubMed] [Google Scholar]
- Almutairi, F., Lee, J.-K. Rada, B. (2020). Regulator of G protein signaling 10: Structure, expression and functions in cellular physiology and diseases. Cell Signal, 75, 109765. [CrossRef] [PubMed] [Google Scholar]
- Al-Sabah, S., Al-Fulaij, M., Shaaban, G., Ahmed, H.A., Mann, R.J., Donnelly, D., Bünemann, M. Krasel, C. (2014). The GIP receptor displays higher basal activity than the GLP-1 receptor but does not recruit GRK2 or arrestin3 effectively. PLoS One, 9(9), e106890. [CrossRef] [PubMed] [Google Scholar]
- Arang, N., Gutkind, J.S. (2020). G protein-coupled receptors and heterotrimeric G proteins as cancer drivers. FEBS Lett, 594, 4201-4232. [CrossRef] [PubMed] [Google Scholar]
- Avasarala, S., Bikkavilli, R.K., Van Scoyk, M., Zhang, W., Lapite, A., Hostetter, L., Byers, J.T., Heasley, L.E., Sohn, J.W., Winn, R.A. (2013). Heterotrimeric G-protein, Gα16, is a critical downstream effector of non-canonical Wnt signaling and a potent inhibitor of transformed cell growth in non small cell lung cancer. PLoS One, 8(10), e76895. [CrossRef] [PubMed] [Google Scholar]
- Bourne, H.R., Coffino, P., Tomkins, G.M. (1975). Selection of a variant lymphoma cell deficient in adenylate cyclase. Science, 187, 750-752. [CrossRef] [PubMed] [Google Scholar]
- Calebiro, D., Koszegi, Z. (2019). The subcellular dynamics of GPCR signaling. Mol Cell Endocrinol, 483, 24-30. [CrossRef] [PubMed] [Google Scholar]
- Calebiro, D., Nikolaev, V.O., Gagliani, M.C., de Filippis, T., Dees, C., Tacchetti, C., Persani, L., Lohse, M.J. (2009). Persistent CAMP-signals triggered by internalized G-protein–coupled receptors. PLoS Biol, 7(8), e1000172. [CrossRef] [PubMed] [Google Scholar]
- Calebiro, D., Nikolaev, V.O., Persani, L., Lohse, M.J. (2010). Signaling by internalized G-protein-coupled receptors. Trends Pharmacol Sci, 31, 221-228. [CrossRef] [PubMed] [Google Scholar]
- Cao, W., Luttrell, L.M., Medvedev, A.V., Pierce, K.L., Daniel, K.W., Dixon, T.M., Lefkowitz, R.J., Collins, S. (2000). Direct binding of activated C-Src to the Β3-adrenergic receptor is required for MAP kinase activation. J Biol Chem, 275, 38131-38134. [CrossRef] [PubMed] [Google Scholar]
- Carpenter, B., Tate, C.G. (2017). Active state structures of G protein-coupled receptors highlight the similarities and differences in the G protein and arrestin coupling interfaces. Curr Opin Struct Biol, 45, 124-132. [CrossRef] [PubMed] [Google Scholar]
- Coffino, P., Bourne, H.R., Tomkins, G.M. (1975). Somatic genetic analysis of cyclic AMP action: Selection of unresponsive mutants. J Cell Physiol, 85, 603-610. [CrossRef] [PubMed] [Google Scholar]
- Conklin, B.R., Farfel, Z., Lustig, K.D., Julius, D., Bourne, H.R. (1993). Substitution of three amino acids switches receptor specificity of Gq alpha to that of Gi alpha. Nature, 363, 274-276. [CrossRef] [PubMed] [Google Scholar]
- Cordeaux, Y., Nickolls, S.A., Flood, L.A., Graber, S.G., Strange, P.G. (2001). Agonist regulation of D(2) dopamine receptor/G protein interaction. Evidence for agonist selection of G protein subtype. J Biol Chem, 276, 28667-28675. [CrossRef] [PubMed] [Google Scholar]
- Davenport, A.P., Harmar, A.J. (2013). Evolving pharmacology of orphan GPCRs: IUPHAR commentary. Br J Pharmacol, 170, 693-695. [CrossRef] [PubMed] [Google Scholar]
- De Lean, A., Stadel, J.M., Lefkowitz, R.J. (1980). A ternary complex model explains the agonist-specific binding properties of the adenylate cyclase-coupled beta-adrenergic receptor. J Biol Chem, 255, 7108-7117. [CrossRef] [PubMed] [Google Scholar]
- DeGraff, J.L., Gagnon, A.W., Benovic, J.L., Orsini, M.J. (1999). Role of arrestins in endocytosis and signaling of α2-adrenergic receptor subtypes. J Biol Chem, 274, 11253-11259. [CrossRef] [PubMed] [Google Scholar]
- DeVree, B.T., Mahoney, J.P., Vélez-Ruiz, G.A., Rasmussen, S.G.F., Kuszak, A.J., Edwald, E., Fung, J.-J., Manglik, A., Masureel, M., Du, Y., Matt, R.A., Pardon, E., Steyaert, J., Kobilka, B.K., Sunahara, R.K. (2016). Allosteric coupling from G protein to the agonist-binding pocket in GPCRs. Nature, 535, 182-186. [CrossRef] [PubMed] [Google Scholar]
- Doi, M., Murai, I., Kunisue, S., Setsu, G., Uchio, N., Tanaka, R., Kobayashi, S., Shimatani, H., Hayashi, H., Chao, H.-W., Nakagawa, Y., Takahashi, Y., Hotta, Y., Yasunaga, J.-I., Matsuoka, M., Hastings, M.H., Kiyonari, H., Okamura, H. (2016). Gpr176 is a Gz-linked orphan G-protein-coupled receptor that sets the pace of circadian behaviour. Nat Commun, 7, 10583. [CrossRef] [PubMed] [Google Scholar]
- Dorsam, R.T., Gutkind, J.S. (2007). G-protein-coupled receptors and cancer. Nat Rev Cancer, 7, 79-94. [CrossRef] [PubMed] [Google Scholar]
- Doyen, P.J., Beckers, P., Brook, G.A., Hermans, E. (2020). Regulators of G protein signalling as pharmacological targets for the treatment of neuropathic pain. Pharmacol Res, 160, 105148. [CrossRef] [PubMed] [Google Scholar]
- Dror, R.O., Mildorf, T.J., Hilger, D., Manglik, A., Borhani, D.W., Arlow, D.H., Philippsen, A., Villanueva, N., Yang, Z., Lerch, M.T., Hubbell, W.L., Kobilka, B.K., Sunahara, R.K., Shaw, D.E. (2015). Signal transduction. Structural basis for nucleotide exchange in heterotrimeric G proteins. Science, 348, 1361-1365. [CrossRef] [PubMed] [Google Scholar]
- Duc, N.M., Kim, H.R., Chung, K.Y. (2017). Recent progress in understanding the conformational mechanism of heterotrimeric G protein activation. Biomol Ther, 25, 4-11. [CrossRef] [PubMed] [Google Scholar]
- Dupuis, N., Laschet, C., Franssen, D., Szpakowska, M., Gilissen, J., Geubelle, P., Soni, A., Parent, A.-S., Pirotte, B., Chevigné, A., Twizere, J.-C., Hanson, J. (2017). Activation of the orphan G protein-coupled receptor GPR27 by surrogate ligands promotes β-arrestin 2 recruitment. Mol Pharmacol, 91, 595-608. [CrossRef] [PubMed] [Google Scholar]
- Feinstein, T.N., Yui, N., Webber, M.J., Wehbi, V.L., Stevenson, H.P., King, J.D. Jr, Hallows, K.R., Brown, D., Bouley, R., Vilardaga, J.-P. (2013). Noncanonical control of vasopressin receptor type 2 signaling by retromer and arrestin. J Biol Chem, 288, 27849-27860. [CrossRef] [PubMed] [Google Scholar]
- Ferrandon, S., Feinstein, T.N., Castro, M., Wang, B., Bouley, R., Potts, J.T., Gardella, T.J., Vilardaga, J.-P. (2009). Sustained cyclic AMP production by parathyroid hormone receptor endocytosis. Nat Chem Biol, 5, 734-742. [CrossRef] [PubMed] [Google Scholar]
- Fields, T.A., Casey, P.J. (1997). Signalling functions and biochemical properties of pertussis toxin-resistant G-proteins. Biochem J, 321, 561-571. [CrossRef] [PubMed] [Google Scholar]
- Flegel, C., Manteniotis, S., Osthold, S., Hatt, H., Gisselmann, G. (2013). Expression profile of ectopic olfactory receptors determined by deep sequencing. PLoS One, 8, e55368. [CrossRef] [PubMed] [Google Scholar]
- Flock, T., Ravarani, C.N.J., Sun, D., Venkatakrishnan, A.J., Kayikci, M., Tate, C.G., Veprintsev, D.B., Babu, M.M. (2015). Universal allosteric mechanism for Gα activation by GPCRs. Nature, 524, 173-179. [CrossRef] [PubMed] [Google Scholar]
- Flock, T., Hauser, A.S., Lund, N., Gloriam, D.E., Balaji, S., Babu, M.M. (2017). Selectivity determinants of GPCR-G-protein binding. Nature, 545, 317-322. [CrossRef] [PubMed] [Google Scholar]
- Fong, H.K., Yoshimoto, K.K., Eversole-Cire, P., Simon, M.I. (1988). Identification of a GTP-binding protein alpha subunit that lacks an apparent ADP-ribosylation site for pertussis toxin. Proc Natl Acad Sci USA, 85, 3066-3070. [CrossRef] [PubMed] [Google Scholar]
- Fredriksson, R., Lagerström, M.C., Lundin, L.-G., Schiöth, H.B. (2003). The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol, 63, 1256-1272. [CrossRef] [PubMed] [Google Scholar]
- García-Nafría, J., Tate, C.G. (2019). Cryo-EM structures of GPCRs coupled to Gs, Gi and Go. Mol Cell Endocrinol, 488, 1-13. [CrossRef] [PubMed] [Google Scholar]
- Gazi, L., Nickolls, S.A.: Strange, P.G. (2003). Functional coupling of the human dopamine D2 receptor with G alpha I1, G alpha I2, G alpha I3 and G alpha o G proteins: Evidence for agonist regulation of G protein selectivity. Br J Pharmacol, 138, 775-786. [CrossRef] [PubMed] [Google Scholar]
- Gilman, A.G. (2012). Silver spoons and other personal reflections. Annu Rev Pharmacol Toxicol, 52, 1-19. [Google Scholar]
- Grundmann, M., Merten, N., Malfacini, D., Inoue, A., Preis, P., Simon, K., Rüttiger, N., Ziegler, N., Benkel, T., Schmitt, N.K., Ishida, S., Müller, I., Reher, R., Kawakami, K., Inoue, A., Rick, U., Kühl, T., Imhof, D., Aoki, J., König, G.M., Hoffmann, C., Gomeza, J., Wess, J. Kostenis, E. (2018). Lack of beta-arrestin signaling in the absence of active G proteins. Nat Commun, 9(341), 1-16. [CrossRef] [PubMed] [Google Scholar]
- Hanyaloglu, A.C., von Zastrow, M. (2008). Regulation of GPCRs by endocytic membrane trafficking and its potential implications. Annu Rev Pharmacol Toxicol, 48, 537-568. [CrossRef] [PubMed] [Google Scholar]
- Hauser, A.S., Attwood, M.M., Rask-Andersen, M., Schiöth, H.B., Gloriam, D.E. (2017). Trends in GPCR drug discovery: New agents, targets and indications. Nat Rev Drug Discov, 16, 829-842. [CrossRef] [PubMed] [Google Scholar]
- Hauser, A.S., Avet, C., Normand, C., Manchini, A., Inoue, A., Bouvier, M., Gloriam, D. (2021). GPCR-G Protein Selectivity − a Unified Meta-Analysis. https://doi.org/10.1101/2021.09.07.459250. [Google Scholar]
- Hebert-Chatelain, E., Desprez, T., Serrat, R., Bellochio, L., Grandes, P., Benard, G., Marsicano, G. (2016). A cannabinoid link between mitochondria and memory. Biochim Biophys Acta Bioenerg, 1857, e118. [CrossRef] [Google Scholar]
- Hepler, J.R., Gilman, A.G. (1992). G proteins. Trends Biochem Sci, 17, 383-387. [CrossRef] [PubMed] [Google Scholar]
- Hermans, E. (2003). Biochemical and pharmacological control of the multiplicity of coupling at G-protein-coupled receptors. Pharmacol Ther, 99, 25-44. [CrossRef] [PubMed] [Google Scholar]
- Hislop, J.N., Caunt, C.J., Sedgley, K.R., Kelly, E., Mundell, S., Green, L.D. McArdle, C.A. (2005). Internalization of gonadotropin-releasing hormone receptors (GnRHRs): Does arrestin binding to the C-terminal tail target GnRHRs for dynamin-dependent internalization? J Mol Endocrinol, 35, 177-189. [CrossRef] [PubMed] [Google Scholar]
- Hollinger, S., Hepler, J.R. (2002). Cellular regulation of RGS proteins: Modulators and integrators of G protein signaling. Pharmacol Rev, 54, 527-559. [CrossRef] [PubMed] [Google Scholar]
- Iiri, T., Herzmark, P., Nakamoto, J.M., van Dop, C., Bourne, H.R. (1994). Rapid GDP release from Gs alpha in patients with gain and loss of endocrine function. Nature, 371, 164-168. [CrossRef] [PubMed] [Google Scholar]
- Inoue, A., Raimondi, F., Kadji, F.M.N., Singh, G., Kishi, T., Uwamizu, A., Ono, Y., Shinjo, Y., Ishida, S., Arang, N., Kawakami, K., Gutkind, J.S., Aoki, J., Russell, R.B. (2019). Illuminating G-protein-coupling selectivity of GPCRs. Cell, 177, 1933-1947. [CrossRef] [PubMed] [Google Scholar]
- Irannejad, R., Tomshine, J.C., Tomshine, J.R., Chevalier, M., Mahoney, J.P., Steyaert, J., Rasmussen, S.G.F., Sunahara, R.K., El-Samad, H., Huang, B., von Zastrow, M. (2013). Conformational biosensors reveal GPCR signalling from endosomes. Nature, 495, 534-538. [CrossRef] [PubMed] [Google Scholar]
- Irannejad, R., von Zastrow, M. (2014). GPCR signaling along the endocytic pathway. Curr Opin Cell Biol, 27, 109-116. [CrossRef] [PubMed] [Google Scholar]
- Ismail, S., Gherardi, M.-J., Froese, A., Zanoun, M., Gigoux, V., Clerc, P., Gaits-Iacovoni, F., Steyaert, J., Nikolaev, V.O., Fourmy, D. (2016). Internalized receptor for glucose-dependent insulinotropic peptide stimulates adenylyl cyclase on early endosomes. Biochem Pharmacol, 120, 33-45. [CrossRef] [PubMed] [Google Scholar]
- Karamitri, A., Plouffe, B., Bonnefond, A., Chen, M., Gallion, J., Guillaume, J.-L., Hegron, A., Boissel, M., Canouil, M., Langenberg, C., Wareham, N.J., Le Gouill, C., Lukasheva, V., Lichtarge, O., Froguel, P., Bouvier, M., Jockers, R. (2018). Type 2 diabetes-associated variants of the MT2 melatonin receptor affect distinct modes of signaling. Sci Signal, 11(eaan6622), 1-14. [CrossRef] [Google Scholar]
- Katritch, V., Cherezov, V., Stevens, R.C. (2013). Structure-function of the G protein-coupled receptor superfamily. Annu Rev Pharmacol Toxicol, 53, 531-556. [CrossRef] [PubMed] [Google Scholar]
- Kenakin, T. (2011). Functional selectivity and biased receptor signaling. J Pharmacol Exp Ther, 336, 296-302. [CrossRef] [PubMed] [Google Scholar]
- Kenakin, T. (2013). New concepts in pharmacological efficacy at 7TM receptors: IUPHAR review 2. Br J Pharmacol, 168, 554-575. [CrossRef] [PubMed] [Google Scholar]
- Kimple, M.E., Joseph, J.W., Bailey, C.L., Fueger, P.T., Hendry, I.A., Newgard, C.B., Casey, P.J. (2008). Gαz negatively regulates insulin secretion and glucose clearance. J Biol Chem, 283, 4560-4567. [CrossRef] [PubMed] [Google Scholar]
- Knight, K.M., Ghosh, S., Campbell, S.L., Lefevre, T.J., Olsen, R.H.J., Smrcka, A.V., Valentin, N.H., Yin, G., Vaidehi, N., Dohlman, H.G. (2021). A universal allosteric mechanism for G protein activation. Mol Cell, 81, 1384-1396. [CrossRef] [PubMed] [Google Scholar]
- Kolb, P., Kenakin, T., Alexander, S., Bermudez, M., Bohn, L., Breinholt, C., Bouvier, M., Ehlert, F., Hill, S.J., Martemyanov, K., Neubig, R., Onaran, O.H., Rajagopal, S., Roth, B.L., Selent, J., Shukla, A.K., Sommer, M.E., Gloriam, D.E. (2021). International Union of Basic and Clinical Pharmacology. Recommendations for GPCR ligand bias. Authorea, September. https://doi.org/10.22541/au.163129851.17708337/v1. [Google Scholar]
- Kostenis, E., Waelbroeck, M., Milligan, G. (2005). Techniques: Promiscuous Gα proteins in basic research and drug discovery. Trends Pharmacol Sci, 26, 595-602. [CrossRef] [PubMed] [Google Scholar]
- Kostenis, E., Pfeil, E.M., Annala, S. (2020). Heterotrimeric Gq proteins as therapeutic targets? J Biol Chem, 295, 5206-5215. [CrossRef] [PubMed] [Google Scholar]
- Kotowski, S.J., Hopf, F.W., Seif, T., Bonci, A., von Zastrow, M. (2011). Endocytosis promotes rapid dopaminergic signaling. Neuron, 71, 278-290. [CrossRef] [PubMed] [Google Scholar]
- Kuna, R.S., Girada, S.B., Asalla, S., Vallentyne, J., Maddika, S., Patterson, J.T., Smiley, D.L., DiMarchi, R.D., Mitra, P. (2013). Glucagon-like peptide-1 receptor-mediated endosomal cAMP generation promotes glucose-stimulated insulin secretion in pancreatic β-cells. Am J Physiol Endocrinol Metab, 305, E161-E170. [CrossRef] [PubMed] [Google Scholar]
- Lander, E.S., Linton, L.M., Birren, B., Nusbaum, C., Zody, M.C., Baldwin, J., Devon, K., Dewar, K., Doyle, M., FitzHugh, W., Funke, R., Gage, D., Harris, K., Heaford, A., Howland, J., Kann, L., Lehoczky, J., LeVine, R., McEwan, P., McKernan, K., Meldrim, J., Mesirov, J.P., Miranda, C., Morris, W., Naylor, J., Raymond, C., Rosetti, M., Santos, R., Sheridan, A., Sougnez, C., Stange-Thomann, Y., Stojanovic, N., Subramanian, A., Wyman, D., Rogers, J., Sulston, J., Ainscough, R., Beck, S., Bentley, D., Burton, J., Clee, C., Carter, N., Coulson, A., Deadman, R., Deloukas, P., Dunham, A., Dunham, I., Durbin, R., French, L., Grafham, D., Gregory, S., Hubbard, T., Humphray, S., Hunt, A., Jones, M., Lloyd, C., McMurray, A., Matthews, L., Mercer, S., Milne, S., Mullikin, J.C., Mungall, A., Plumb, R., Ross, M., Shownkeen, R., Sims, S., Waterston, R.H., Wilson, R.K., Hillier, L.W., McPherson, J.D., Marra, M.A., Mardis, E.R., Fulton, L.A., Chinwalla, A.T., Pepin, K.H., Gish, W.R., Chissoe, S.L., Wendl, M.C., Delehaunty, K.D., Miner, T.L., Delehaunty, A., Kramer, J.B., Cook, L.L., Fulton, R.S., Johnson, D.L., Minx, P.J., Clifton, S.W., Hawkins, T., Branscomb, E., Predki, P., Richardson, P., Wenning, S., Slezak, T., Doggett, N., Cheng, J.F., Olsen, A., Lucas, S., Elkin, C., Uberbacher, E., Frazier, M., Gibbs, R.A., Muzny, D.M., Scherer, S.E., Bouck, J.B., Sodergren, E.J., Worley, K.C., Rives, C.M., Gorrell, J.H., Metzker, M.L., Naylor, S.L., Kucherlapati, R.S., Nelson, D.L., Weinstock, G.M., Sakaki, Y., Fujiyama, A., Hattori, M., Yada, T., Toyoda, A., Itoh, T., Kawagoe, C., Watanabe, H., Totoki, Y., Taylor, T., Weissenbach, J., Heilig, R., Saurin, W., Artiguenave, F., Brottier, P., Bruls, T., Pelletier, E., Robert, C., Wincker, P., Smith, D.R., Doucette-Stamm, L., Rubenfield, M., Weinstock, K., Lee, H.M., Dubois, J., Rosenthal, A., Platzer, M., Nyakatura, G., Taudien, S., Rump, A., Yang, H., Yu J., Wang J., Huang, G., Gu, J., Hood, L., Rowen, L., Madan, A., Qin, S., Davis, R.W., Federspiel, N.A., Abola, A.P., Proctor, M.J., Myers, R.M., Schmutz, J., Dickson, M., Grimwood, J., Cox, D.R., Olson, M.V., Kaul, R., Raymond, C., Shimizu, N., Kawasaki, K., Minoshima, S., Evans, G.A., Athanasiou, M., Schultz, R., Roe, B.A., Chen, F., Pan, H., Ramser, J., Lehrach, H., Reinhardt, R., McCombie, W.R., de la Bastide, M., Dedhia, N., Blöcker, H., Hornischer, K., Nordsiek, G., Agarwala, R., Aravind, L., Bailey, J.A., Bateman, A., Batzoglou, S., Birney, E., Bork, P., Brown, D.G., Burge, C.B., Cerutti, L., Chen, H.C., Church, D., Clamp, M., Copley, R.R., Doerks, T., Eddy, S.R., Eichler, E.E., Furey, T.S., Galagan, J., Gilbert, J.G., Harmon, C., Hayashizaki, Y., Haussler, D., Hermjakob, H., Hokamp, K., Jang, W., Johnson, L.S., Jones, T.A., Kasif, S., Kaspryzk, A., Kennedy, S., Kent, W.J., Kitts, P., Koonin, E.V., Korf, I., Kulp, D., Lancet, D., Lowe, T.M., McLysaght, A., Mikkelsen, T., Moran, J.V., Mulder, N., Pollara, V.J., Ponting, C.P., Schuler, G., Schultz, J., Slater, G., Smit, A.F., Stupka, E., Szustakowki, J., Thierry-Mieg, D., Thierry-Mieg, J., Wagner, L., Wallis, J., Wheeler, R., Williams, A., Wolf, Y.I., Wolfe, K.H., Yang, S.P., Yeh, R.F., Collins, F., Guyer, M.S., Peterson, J., Felsenfeld, A., Wetterstrand, K.A., Patrinos, A., Morgan, M.J., de Jong, P., Catanese, J.J., Osoegawa, K., Shizuya, H., Choi, S., Chen, Y.J., Szustakowki, J., International Human Genome Sequencing Consortium. (2001). Initial sequencing and analysis of the human genome. Nature, 409, 860-921. [CrossRef] [PubMed] [Google Scholar]
- Laschet, C., Dupuis, N., Hanson, J. (2018). The G protein-coupled receptors deorphanization landscape. Biochem Pharmacol, 153, 62-74. [CrossRef] [PubMed] [Google Scholar]
- Laschet, C., Dupuis, N., Hanson, J. (2019). A dynamic and screening-compatible nanoluciferase-based complementation assay enables profiling of individual GPCR-G protein interactions. J Biol Chem, 294, 4079-4090. [CrossRef] [PubMed] [Google Scholar]
- Laschet, C., Hanson, J. (2021). Nanoluciferase-based complementation assay to detect GPCR-G protein interaction. Methods Mol Biol, 2268, 149-157. [CrossRef] [PubMed] [Google Scholar]
- Le Mercier, A., Bonnavion, R., Yu, W., Alnouri, M.W., Ramas, S., Zhang, Y., Jäger, Y., Roquid, K.A., Jeong, H.-W., Sivaraj, K.K., Cho, H., Chen, X., Strilic, B., Sijmonsma, T., Adams, R., Schroeder, T., Rieger, M.A., Offermanns, S. (2021). GPR182 is an endothelium-specific atypical chemokine receptor that maintains hematopoietic stem cell homeostasis. Proc Natl Acad Sci USA, 118(e2021596118), 1-10. [Google Scholar]
- Lefkowitz, R.J. (2018). A serendipitous scientist. Annu Rev Pharmacol Toxicol, 58, 17-32. [CrossRef] [PubMed] [Google Scholar]
- Li, J., Ge, Y., Huang, J.-X., Strømgaard, K., Zhang, X., Xiong, X.-F. (2020). Heterotrimeric G proteins as therapeutic targets in drug discovery. J Med Chem, 63, 5013-5030. [CrossRef] [PubMed] [Google Scholar]
- Lohse, M.J., Calebiro, D. (2013). Cell biology: Receptor signals come in waves. Nature, 495, 457-458. [CrossRef] [PubMed] [Google Scholar]
- Lohse, M.J., Hofmann, K.P. (2015). Spatial and temporal aspects of signaling by G-protein-coupled receptors. Mol Pharmacol, 88, 572-578. [CrossRef] [PubMed] [Google Scholar]
- Lyga, S., Volpe, S., Werthmann, R.C., Götz, K., Sungkaworn, T., Lohse, M.J., Calebiro, D. (2016). Persistent CAMP signaling by internalized LH receptors in ovarian follicles. Endocrinology, 157, 1613-1621. [PubMed] [Google Scholar]
- Magalhaes, A.C., Dunn, H. Ferguson, S.S. (2012). Regulation of GPCR activity, trafficking and localization by GPCR-interacting proteins. Br J Pharmacol, 165, 1717-1736. [CrossRef] [PubMed] [Google Scholar]
- Mahoney, J.P., Sunahara, R.K. (2016). Mechanistic insights into GPCR-G protein interactions. Curr Opin Struct Biol, 41, 247-254. [CrossRef] [PubMed] [Google Scholar]
- Mancini, A., Avet, C., Breton, B., Le Gouill, C., Hauser, A., Normand, C., Gross, F., Lukasheva, V., Hogue, M., Morissette, S., Fauman, E., Fortin, J., Schann, S., Leroy, X., Gloriam, D., Bouvier, M. (2021). Use of novel EbBRET biosensors for comprehensive signaling profiling of one hundred therapeutically relevant human GPCRs. FASEB J, 35(S1). https://doi.org/10.1096/fasebj.2021.35.s1.01694. [Google Scholar]
- Marshall, F.H., Jones, K.A., Kaupmann, K., Bettler, B. (1999). GABAB receptors − the first 7TM heterodimers. Trends Pharmacol Sci, 20, 396-399. [CrossRef] [PubMed] [Google Scholar]
- Martemyanov, K.A. (2021). Mechanisms of Gβγ release upon GPCR activation. Trends Biochem Sci, 46, 703-704. [CrossRef] [PubMed] [Google Scholar]
- Masuho, I., Balaji, S., Muntean, B.S., Skamangas, N.K., Chavali, S., Tesmer, J.J.G., Babu, M.M., Martemyanov, K.A. (2020). A global map of G protein signaling regulation by RGS proteins. Cell, 183, 503-521. [CrossRef] [PubMed] [Google Scholar]
- Masuho, I., Skamangas, N.K., Muntean, B.S., Martemyanov, K.A. (2021). Diversity of the Gβγ complexes defines spatial and temporal bias of GPCR signaling. Cell Syst, 12, 324-337. [CrossRef] [PubMed] [Google Scholar]
- McKee, E.E., Bentley, A.T., Smith, R.M. Jr, Ciaccio, C.E. (1999). Origin of guanine nucleotides in isolated heart mitochondria. Biochem Biophys Res Commun, 257, 466-472. [CrossRef] [PubMed] [Google Scholar]
- McLaughlin, J.N., Shen, L., Holinstat, M., Brooks, J.D., Dibenedetto, E., Hamm, H.E. (2005). Functional selectivity of G protein signaling by agonist peptides and thrombin for the protease-activated receptor-1. J Biol Chem, 280, 25048-25059. [CrossRef] [PubMed] [Google Scholar]
- Milligan, G. Kostenis, E. (2006). Heterotrimeric G-proteins: A short history. Br J Pharmacol, 147, Suppl 1, S46-S55. [CrossRef] [PubMed] [Google Scholar]
- Milligan, G., Ward, R.J., Marsango, S. (2019). GPCR homo-oligomerization. Curr Opin Cell Biol, 57, 40-47. [CrossRef] [PubMed] [Google Scholar]
- Moreira, I.S. (2014). Structural features of the G-protein/GPCR interactions. Biochim Biophys Acta, 1840, 16-33. [CrossRef] [PubMed] [Google Scholar]
- Mukhopadhyay, S., Howlett, A.C. (2005). Chemically distinct ligands promote differential CB1 cannabinoid receptor-Gi protein interactions. Mol Pharmacol, 67, 2016-2024. [CrossRef] [PubMed] [Google Scholar]
- Muntean, B.S., Masuho, I., Dao, M., Sutton, L.P., Zucca, S., Iwamoto, H., Patil, D.N., Wang, D., Birnbaumer, L., Blakely, R.D., Grill, B., Martemyanov, K.A. (2021). Gαo is a major determinant of cAMP signaling in the pathophysiology of movement disorders. Cell Rep, 34, 1-18. [Google Scholar]
- Northup, J.K., Sternweis, P.C., Smigel, M.D., Schleifer, L.S., Ross, E.M., Gilman, A.G. (1980). Purification of the regulatory component of adenylate cyclase. Proc Natl Acad Sci USA, 77, 6516-6520. [CrossRef] [PubMed] [Google Scholar]
- O’Hayre, M., Eichel, K., Avino, S., Zhao, X., Steffen, D.J., Feng, X., Kawakami, K., Aoki, J., Messer, K., Sunahara, R., Inoue, A., von Zastrow, M., Gutkind, J.S. (2017). Genetic evidence that β-arrestins are dispensable for the initiation of β2-adrenergic receptor signaling to ERK. Sci Signal, 10(eaal3395), 1-13. [Google Scholar]
- Okashah, N., Wan, Q., Ghosh, S., Sandhu, M., Inoue, A., Vaidehi, N., Lambert, N.A. (2019). Variable G protein determinants of GPCR coupling selectivity. Proc Natl Acad Sci USA, 116, 12054-12059. [CrossRef] [PubMed] [Google Scholar]
- Okinaga, S., Slattery, D., Humbles, A., Zsengeller, Z., Morteau, O., Kinrade, M.B., Brodbeck, R.M., Krause, J.E., Choe, H.-R., Gerard, N.P. Gerard, C. (2003). C5L2: A nonsignaling C5A binding protein. Biochemistry, 42, 9406-9415. [CrossRef] [PubMed] [Google Scholar]
- Oldham, W.M., Van Eps, N., Preininger, A.M., Hubbell, W.L., Hamm, H.E. (2006). Mechanism of the receptor-catalyzed activation of heterotrimeric G proteins. Nat Struct Mol Biol, 13, 772-777. [CrossRef] [PubMed] [Google Scholar]
- Oldham, W.M., Hamm, H.E. (2007). How do receptors activate G proteins? Adv Protein Chem, 74, 67-93. [CrossRef] [PubMed] [Google Scholar]
- Oldham, W.M., Hamm, H.E. (2008). Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol, 9, 60-71. [CrossRef] [PubMed] [Google Scholar]
- Pandey, S., Kumari, P., Baidya, M., Kise, R., Cao, Y., Dwivedi-Agnihotri, H., Banerjee, R., Li, X.X., Cui, C.S., Lee, J.D., Kawakami, K., Maharana, J., Ranjan, A., Chaturvedi, M., Jhingan, G.D., Laporte, S.A., Woodruff, T.M., Inoue, A., Shukla, A.K. (2021). Intrinsic bias at non-canonical, β-arrestin-coupled seven transmembrane receptors. Mol Cell, 81, 4605-4621. [CrossRef] [PubMed] [Google Scholar]
- Peterson, Y.K., Luttrell, L.M. (2017). The diverse roles of arrestin scaffolds in G protein-coupled receptor signaling. Pharmacol Rev, 69, 256-297. [CrossRef] [PubMed] [Google Scholar]
- Pfeil, E.M., Brands, J., Merten, N., Vögtle, T., Vescovo, M., Rick, U., Albrecht, I.-M., Heycke, N., Kawakami, K., Ono, Y., Ngako Kadji, F.M., Hiratsuka, S., Aoki, J., Häberlein, F., Matthey, M., Garg, J., Hennen, S., Jobin, M.-L., Seier, K., Calebiro, D., Pfeifer, A., Heinemann, A., Wenzel, D., König, G.M., Nieswandt, B., Fleischmann, B.K., Inoue, A., Simon, K., Kostenis, E. (2020). Heterotrimeric G protein subunit Gαq is a master switch for Gβγ-mediated calcium mobilization by Gi-coupled GPCRs. Mol Cell, 80, 940-954. [CrossRef] [PubMed] [Google Scholar]
- Preininger, A.M., Meiler, J., Hamm, H.E. (2013). Conformational flexibility and structural dynamics in GPCR-mediated G protein activation: A perspective. J Mol Biol, 425, 2288-2298. [CrossRef] [PubMed] [Google Scholar]
- Qu, L., Pan, C., He, S.-M., Lang, B., Gao, G.-D., Wang, X.-L., Wang, Y. (2019). The Ras superfamily of small GTPases in non-neoplastic cerebral diseases. Front Mol Neurosci, 12, 121. [CrossRef] [PubMed] [Google Scholar]
- Rajagopal, S., Kim, J., Ahn, S., Craig, S., Lam, C.M., Gerard, N.P., Gerard, C., Lefkowitz, R.J. (2010). β-arrestin- but not G protein-mediated signaling by the “Decoy” receptor CXCR7. Proc Natl Acad Sci USA, 107, 628-632. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Rasmussen, S.G.F., DeVree, B.T., Zou, Y., Kruse, A.C., Chung, K.Y., Kobilka, T.S., Thian, F.S., Chae, P.S., Pardon, E., Calinski, D., Mathiesen, J.M., Shah, S.T.A., Lyons, J.A., Caffrey, M., Gellman, S.H., Steyaert, J., Skiniotis, G., Weis, W.I., Sunahara, R.K., Kobilka, B.K. (2011). Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature, 477, 549-555. [CrossRef] [PubMed] [Google Scholar]
- Rodbell, M., Birnbaumer, L., Pohl, S.L. Krans, H.M. (1971). The glucagon-sensitive adenyl cyclase system in plasma membranes of rat liver. V. An obligatory role of guanyl nucleotides in glucagon action. J Biol Chem, 246, 1877-1882. [CrossRef] [PubMed] [Google Scholar]
- Ross, E.M. Gilman, A.G. (1977). Reconstitution of catecholamine-sensitive adenylate cyclase activity: Interactions of solubilized components with receptor-replete membranes. Proc Natl Acad Sci USA, 74, 3715-3719. [CrossRef] [PubMed] [Google Scholar]
- Samama, P., Cotecchia, S., Costa, T. Lefkowitz, R.J. (1993). A mutation-induced activated state of the beta 2-adrenergic receptor. Extending the ternary complex model. J Biol Chem, 268, 4625-4636. [CrossRef] [PubMed] [Google Scholar]
- Schwindinger, W.F., Miric, A., Zimmerman, D., Levine, M.A. (1994). A novel Gs alpha mutant in a patient with Albright hereditary osteodystrophy uncouples cell surface receptors from adenylyl cyclase. J Biol Chem, 269, 25387-25391. [CrossRef] [PubMed] [Google Scholar]
- Sjögren, B. (2017). The evolution of regulators of G protein signalling proteins as drug targets − 20 years in the making: IUPHAR review 21. Br J. Pharmacol, 174, 427-437. [CrossRef] [Google Scholar]
- Sleno, R., Hébert, T.E. (2019). Shaky ground − The nature of metastable GPCR signalling complexes. Neuropharmacology, 152, 4-14. [CrossRef] [PubMed] [Google Scholar]
- Sprang, S.R. (2016). Invited review: Activation of G proteins by GTP and the mechanism of Gα-catalyzed GTP hydrolysis. Biopolymers, 105, 449-462. [CrossRef] [PubMed] [Google Scholar]
- Sriram, K., Insel, P.A. (2018). G protein-coupled receptors as targets for approved drugs: How many targets and how many drugs? Mol Pharmacol, 93, 251-258. [CrossRef] [PubMed] [Google Scholar]
- Sugino, S., Farrag, M. Ruiz-Velasco, V. (2016). Gα14 subunit-mediated inhibition of voltage-gated Ca2+ and K+ channels via neurokinin-1 receptors in rat celiac-superior mesenteric ganglion neurons. J Neurophysiol, 115, 1577-1586. [CrossRef] [PubMed] [Google Scholar]
- Sutherland, E.W., Robison, G.A. (1966). The role of cyclic-3’,5’-AMP in responses to catecholamines and other hormones. Pharmacol Rev, 18, 145-161. [PubMed] [Google Scholar]
- Sutherland, E.W. (1971). Studies on the mechanism of hormone action. Presented at the Nobel Prize lecture, Stockholm, Sweden. [Google Scholar]
- Syrovatkina, V., Alegre, K.O., Dey, R., Huang, X.-Y. (2016). Regulation, signaling, and physiological functions of G-proteins. J Mol Biol, 428, 3850-3868. [CrossRef] [PubMed] [Google Scholar]
- Szpakowska, M., Nevins, A.M., Meyrath, M., Rhainds, D., D’huys, T., Guité-Vinet, F., Dupuis, N., Gauthier, P.-A., Counson, M., Kleist, A., St-Onge, G., Hanson, J., Schols, D., Volkman, B.F., Heveker, N., Chevigné, A. (2018). Different contributions of chemokine N-terminal features attest to a different ligand binding mode and a bias towards activation of ACKR3/CXCR7 compared with CXCR4 and CXCR3. Br J Pharmacol, 175, 1419-1438. [CrossRef] [PubMed] [Google Scholar]
- Tadevosyan, A., Vaniotis, G., Allen, B.G., Hébert, T.E., Nattel, S. (2012). G protein-coupled receptor signalling in the cardiac nuclear membrane: Evidence and possible roles in physiological and pathophysiological function. J Physiol, 590, 1313-1330. [CrossRef] [PubMed] [Google Scholar]
- Taussig, R., Tang, W.J., Hepler, J.R., Gilman, A.G. (1994). Distinct patterns of bidirectional regulation of mammalian adenylyl cyclases. J Biol Chem, 269, 6093-6100. [CrossRef] [PubMed] [Google Scholar]
- Tobin, A.B. (2008). G-protein-coupled receptor phosphorylation: Where, when and by whom. Br J Pharmacol, 153(Suppl 1), S167-S176. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Van Eps, N., Preininger, A.M., Alexander, N., Kaya, A.I., Meier, S., Meiler, J., Hamm, H.E, Hubbell, W.L. (2011). Interaction of a G protein with an activated receptor opens the interdomain interface in the alpha subunit. Proc Natl Acad Sci USA, 108, 9420-9424. [CrossRef] [PubMed] [Google Scholar]
- Von Moo, E., Harpsøe, K., Hauser, A.S., Masuho, I., Bräuner-Osborne, H., Gloriam, D.E., Martemyanov, K.A. (2021). Ligand-directed bias of G protein signaling at the dopamine D2 receptor. Cell Chem Biol. https://doi.org/10.1016/j.chembiol.2021.07.004. [Google Scholar]
- von Zastrow, M., Sorkin, A. (2021). Mechanisms for regulating and organizing receptor signaling by endocytosis. Annu Rev Biochem, 90, 709-737. [CrossRef] [PubMed] [Google Scholar]
- Wettschureck, N., Offermanns, S. (2005). Mammalian G proteins and their cell type specific functions. Physiol Rev, 85, 1159-1204. [CrossRef] [PubMed] [Google Scholar]
- Wong, Y.H., Conklin, B.R., Bourne, H.R. (1992). Gz-mediated hormonal inhibition of cyclic AMP accumulation. Science, 255, 339-342. [CrossRef] [PubMed] [Google Scholar]
- Worzfeld, T., Wettschureck, N., Offermanns, S. (2008). G(12)/G(13)-mediated signalling in mammalian physiology and disease. Trends Pharmacol Sci, 29, 582-589. [CrossRef] [PubMed] [Google Scholar]
- Wright, S.C. Bouvier, M. (2021). Illuminating the complexity of GPCR pathway selectivity − Advances in biosensor development. Curr Opin Struct Biol, 69, 142-149. [CrossRef] [PubMed] [Google Scholar]
- Wright, S.C., Lukasheva, V., Le Gouill, C., Kobayashi, H., Breton, B., Mailhot-Larouche, S., Blondel-Tepaz, É., Antunes Vieira, N., Costa-Neto, C., Héroux, M., Lambert, N.A., Parreiras-E-Silva, L.T., Bouvier, M. (2021). BRET-based effector membrane translocation assay monitors GPCR-promoted and endocytosis-mediated Gq activation at early endosomes. Proc Natl Acad Sci USA, 118, e2025846118. [CrossRef] [PubMed] [Google Scholar]
- Yang, J., Wu, J., Kowalska, M.A., Dalvi, A., Prevost, N., O’Brien, P.J., Manning, D., Poncz, M., Lucki, I., Blendy, J.A. Brass, L.F. (2000). Loss of signaling through the G protein, Gz, results in abnormal platelet activation and altered responses to psychoactive drugs. Proc Natl Acad Sci USA, 97, 9984-9989. [CrossRef] [PubMed] [Google Scholar]
- Yano, H., Cai, N.-S., Xu, M., Verma, R.K., Rea, W., Hoffman, A.F., Shi, L., Javitch, J.A., Bonci, A., Ferré, S. (2018). Gs- versus Golf-dependent functional selectivity mediated by the dopamine D1 receptor. Nat Commun, 9, 486. [CrossRef] [PubMed] [Google Scholar]
- Zhuang, X., Belluscio, L., Hen, R. (2000). Golfα mediates dopamine D1 receptor signaling. J Neurosci, 20, RC91 (1-5). [CrossRef] [PubMed] [Google Scholar]
- Zou, Q.-Y., Zhao, Y.-J., Zhou, C., Liu, A.-X., Zhong, X.-Q., Yan, Q., Li, Y., Yi, F.-X., Bird, I.M., Zheng, J. (2019). G Protein α subunit 14 mediates fibroblast growth factor 2-induced cellular responses in human endothelial cells. J Cell Physiol, 234, 10184-10195. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article: Hanson, J. (2021). Les protéines G : les transducteurs privilégiés des récepteurs à sept domaines transmembranaires. Biologie Aujourd’hui, 215, 95-106
Liste des figures
 |
Figure 1 Modèle proposé par Earl W. Sutherland pour la génération d’AMPc par l’adénylate cyclase en réponse à diverses hormones. Adapté de Sutherland E.W., « Studies on the Mechanism of Hormone Action », présenté à la remise du prix Nobel de Physiologie ou Médecine 1971. |
| Dans le texte | |
 |
Figure 2 Cycle d’activation-désactivation des protéines G. Les protéines G sont des GTPases dont l’activité est modulée positivement par les Guanine exchange factors ou « GEF » (typiquement, les RCPG) qui facilitent l’échange du GDP par le GTP et négativement par les GTPase-activating proteins ou « GAP » (ex: Regulators of G protein signaling ou RGS). |
| Dans le texte | |
 |
Figure 3 Différentes voies de signalisation activées par les protéines G. |
| Dans le texte | |
 |
Figure 4 Structure 3D des protéines G. A. Sous-unité Gαs, seule, avec son domaine Ras et à « hélices α ». La protéine G a été cristallisée avec une molécule de GTP-γ-S afin de bloquer la sous-unité dans sa forme active (ce dérivé de GTP n’est pas hydrolysable). B. Récepteur β2AR en complexe avec la protéine Gαs. On peut distinguer l’hélice 5α qui forme des contacts importants avec le cœur du récepteur. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


