| Numéro |
Biologie Aujourd’hui
Volume 217, Numéro 1-2, 2023
|
|
|---|---|---|
| Page(s) | 79 - 87 | |
| DOI | https://doi.org/10.1051/jbio/2023020 | |
| Publié en ligne | 6 juillet 2023 | |
Article
Les sciences des réseaux appliquées à l’étude du Trouble de Stress Post-Traumatique
The dynamic brain-network model of PTSD
Normandie Université, UNICAEN, PSL Research University, EPHE, INSERM, U1077, CHU de Caen, Neuropsychologie et Imagerie de la Mémoire Humaine, 14000 Caen, France
* Auteur correspondant : berengere.guillery@unicaen.fr
Reçu :
23
Avril
2023
Cet article expose la manière dont les sciences des réseaux peuvent contribuer à la compréhension du Trouble de Stress Post-Traumatique (TSPT). Nous soulignons l’intérêt de concevoir le cerveau comme un système complexe et dynamique pour affiner la description et la prédiction des réponses cérébrales après exposition à un évènement traumatique. À partir des modèles de résilience au stress et sous le prisme des sciences des réseaux, nous proposons une ligne temporelle du TSPT, partant des facteurs de résilience intrinsèques au réseau, présents avant l’évènement traumatique, jusqu’à la réponse cérébrale ayant lieu après l’évènement traumatique. Dans ce cadre, il est essentiel de considérer la topologie du cerveau et les dynamiques cérébrales dans des processus permettant d’utiliser ces facteurs de résilience. Ainsi, nous proposons un cadre concret, autorisant la formulation d’hypothèses explicites sur des aspects potentiellement critiques de l’organisation et des dynamiques des réseaux cérébraux impliqués dans le TSPT.
Abstract
The brain is a highly complex system whose functioning is critical for our interaction with the world. Neural elements, from single cells to brain systems, constantly fluctuate in their dynamics, accompanying the plethora of possible exchanges between our environment and ourselves. However, sometimes things go awry. An unfortunate example is post-traumatic stress disorder (PTSD), a debilitating clinical condition that can appear after exposure to a threatening life event. In this work, using complexity as a framework, we aim to introduce the dynamic brain network model of PTSD. We hope this model will allow the generation of novel specific hypotheses concerning brain organization and dynamics in PTSD research. We first introduce how the network framework complements the localizationist approach centered in specific brain regions or subsets of brain regions, with a whole brain approach considering brain regions’ dynamic relationships. Then, we review key concepts in network neuroscience, focusing on the importance of the network topology and dynamics to understand the organizational principles of the brain, that is, functional segregation and integration. In the third part, we apply this knowledge to describe the possible trajectories conducting a brain system to present PTSD alterations. Accordingly, we introduce the Dynamic Brain Network Model (DBNM) of PTSD, a concrete framework built on the network approach and resilience theory to study the transition of a brain network from state 1 (e.g., before the traumatic event) to state 2 (e.g., after the traumatic event). To conclude, we provide a summary of metrics for quantifying elements on the DBNM and its potential use in computational models of PTSD.
Mots clés : TSPT / réseaux cérébraux / évènement traumatique / résilience
Key words: PTSD / brain networks / traumatic event / resilience
© Société de Biologie, 2023
Abréviations
CPFm : Cortex préfrontal médian
DBNM : Dynamic Brain Network Model
DTI : Diffusion Tensor Imaging
IRMf : Imagerie par Résonance Magnétique fonctionnelle
TSPT : Trouble de Stress Post-Traumatique
Introduction
Le cerveau est un système hautement complexe, dont le fonctionnement conditionne nos interactions avec l’environnement. Ses composants neuronaux, de la cellule aux réseaux cérébraux, présentent des fluctuations dynamiques au cours du temps, permettant de sous-tendre la variété d’échanges possibles entre l’individu et l’environnement. Toutefois, cette organisation dynamique peut être perturbée. C’est notamment le cas dans le Trouble de Stress Post-Traumatique (TSPT), un trouble psychiatrique pouvant survenir après l’exposition à un évènement traumatique. Dans cet article, nous analysons le TSPT sous le prisme de la complexité des systèmes, et formulons un cadre de recherche spécifique sur l’organisation et les dynamiques cérébrales liées à cette pathologie.
Dans un premier temps, nous introduirons la façon dont l’étude des réseaux cérébraux peut être utilisée de manière complémentaire à l’approche centrée sur des régions cérébrales spécifiques et définies (i.e., localisationnisme), en utilisant une approche « cerveau entier » prenant en compte les relations dynamiques entre ces régions. Dans un second temps, nous ferons l’inventaire des concepts centraux en neurosciences des réseaux, en nous focalisant sur l’importance de la topologie et des dynamiques des réseaux pour comprendre les principes au cœur de l’organisation cérébrale, à savoir ses propriétés d’intégration et de ségrégation fonctionnelles. Dans un troisième temps, nous appliquerons ces concepts théoriques au TSPT, afin de proposer une description des différentes trajectoires pouvant conduire au dysfonctionnement cérébral associé à ce syndrome. À cette fin, nous appliquons le modèle des réseaux cérébraux dynamiques (Dynamic Brain Network Model ; DBNM) au TSPT afin d’étudier les mécanismes de transition par lesquels un réseau cérébral évolue d’un état 1 (e.g., avant l’évènement traumatique) à un état 2 (e.g., après l’évènement traumatique). Enfin, nous introduisons des mesures permettant de quantifier et modéliser les variables composant le DBNM.
Des régions cérébrales aux réseaux cérébraux du TSPT
Le TSPT est un trouble psychiatrique, à haut retentissement fonctionnel, pouvant se développer après l’exposition à un évènement portant atteinte à l’intégrité physique ou psychologique de l’individu. Les facteurs impliqués dans l’apparition et la persistance des symptômes de TSPT sont multiples. Ils comprennent notamment le type d’évènement traumatique, le patrimoine génétique et son expression, ainsi que les expériences de vie individuelles (e.g., antécédents d’exposition à des traumatismes : Ressler et al., 2022). Bien qu’il soit difficile de quantifier les contributions respectives du patrimoine génétique et de l’environnement dans l’étiologie du TSPT, ils participent tous deux à modifier le fonctionnement des réseaux cérébraux.
Les approches théoriques et empiriques cherchant à décrire et expliquer les aspects comportementaux, psychologiques et neuronaux du TSPT se sont centrées sur l’étude de la réponse au stress et à la menace. Le cadre expérimental de conditionnement à la peur et les procédures d’induction de stress dans des protocoles de recherche préclinique chez des animaux ont notamment permis d’élucider les mécanismes de la réponse à la peur. Dans ce contexte, le TSPT a été décrit comme une dysrégulation du traitement de la peur, et interprété en termes de mécanismes psychophysiologiques d’encodage et de consolidation d’un évènement traumatique, ainsi que de leur extinction ou expression subséquente (Yehuda et al., 2015 ; Dunsmoor et al., 2022 ; Ressler et al., 2022). En plus des réponses à la peur, le TSPT a été associé à une dysrégulation émotionnelle et à une perturbation de la mémorisation des informations liées aux traumatismes (Yehuda et al., 2015 ; Ressler et al., 2022), conduisant à une perception aberrante des informations de l’environnement, se manifestant par l’hypervigilance, l’hyperréactivité et la généralisation de la peur.
Se développant de manière complémentaire aux études sur modèles animaux, les premières études en neuroimagerie humaine du TSPT se sont focalisées sur les régions cérébrales impliquées dans le circuit neuronal sous-tendant les réponses au stress et à la peur (Pitman et al., 2012), à savoir le complexe impliquant l’hippocampe, l’amygdale et le cortex préfrontal médian (CPFm). Dans ce modèle, une activité exacerbée de l’amygdale est associée à une augmentation du niveau d’éveil physiologique et à une réponse exagérée à la peur. Une diminution de l’activité dans le CPFm est, quant à elle, associée à un déficit d’inhibition descendante. Enfin, une dysrégulation de l’activité hippocampique a été associée à un déficit d’identification des éléments de l’environnement non menaçants (Shin et al., 2006).
Cependant, depuis la fin du XXe siècle, des études soulignent que les processus cognitifs de haut niveau dépendent de l’intégration de systèmes neuronaux multiples et spatialement distribués (Fornito et al., 2015). De ce fait, et grâce à l’introduction et au succès des études de connectivité fonctionnelle, le modèle centré sur quelques régions cérébrales a été reformulé en termes de réseaux intrinsèques. Dans ce paradigme, un ensemble de régions serait lié à un domaine fonctionnel particulier. Par exemple, le réseau du mode par défaut (Default Mode Network ; DMN), centré sur le cortex ventro-médian, serait responsable des processus liés au self ; le réseau de contrôle, centré sur le cortex dorso-latéral, soutiendrait des processus de contrôle ; le réseau de la saillance, mobilisant le cortex cingulaire antérieur, serait lié à la détection de stimuli venant de l’environnement (Menon, 2011). En ce sens, il a été proposé que les symptômes associés au TSPT soient expliqués en termes d’une connectivité aberrante à l’intérieur et entre ces différents réseaux. Ainsi, le TSPT résulterait d’une sous-connectivité dans le DMN, responsable de symptômes intrusifs et d’un sens altéré du soi. Une sous-connectivité du réseau de contrôle serait liée au manque de contrôle et d’inhibition. Enfin, une activité accrue du réseau de la saillance rendrait compte de la détection aberrante de stimuli menaçants (Akiki et al., 2017).
Les réseaux neuronaux au repos (e.g., DMN) ont été observés sur des échelles temporelles courtes (de l’ordre de quelques secondes) (Bassett et al., 2011 ; Allen et al., 2014) à intermédiaires (e.g., durée entre deux tâches en laboratoire) (Cole et al., 2014 ; Bassett et al., 2015 ; Mattar et al., 2015), jusqu’à des échelles temporelles plus grandes (e.g. périodes de vie : Puxeddu et al., 2020). Ces réseaux neuronaux peuvent être observés à l’aide de techniques de neuroimagerie couplées à des analyses temporelles (Power et al., 2011 ; Yeo et al., 2011 ; Cole et al., 2014), et leur structure et leur fonctionnement ont été associés à la cognition et au comportement (Bassett & Sporns, 2017 ; Uddin et al., 2019). De plus, des altérations au sein et entre ces réseaux ont été associées à l’apparition et à la persistance de troubles psychiatriques (Alexander-Bloch et al., 2012 ; Akiki et al., 2017)
Cependant, le couplage fixe d’une structure ou d’un réseau (e.g., hippocampe, DMN) avec une fonction (e.g., mémoire, self) ne permettrait pas d’expliquer la complexité, la flexibilité et la diversité du fonctionnement cérébral. L’approche localisationniste a permis de caractériser des structures cérébrales importantes dans le cadre du TSPT. Cependant, il a été montré que le cerveau est configuré comme un système complexe dynamique et « multi-échelles » (Bullmore & Sporns, 2009 ; Avena-Koenigsberger et al., 2018 ; de Schotten & Forkel, 2022 ; Sporns, 2022). Ceci implique que pour le comprendre, il n’est pas possible d’isoler ses constituants pour les étudier séparément car la somme des composantes n’est pas égale à l’ensemble. En d’autres termes, dans un système complexe, il existe une dépendance entre les aspects globaux et locaux. De plus, l’aspect « multi-échelles » du cerveau nécessite une conception plus large de l’organisation cérébrale ne se limitant pas à l’existence de quelques réseaux cérébraux et leurs interactions. De ce fait, au lieu de parler des réseaux cérébraux (DMN, saillance, etc.), nous préférons utiliser le terme « assemblage neuronal » pour designer l’intégration transitoire d’éléments neuronaux (Varela et al., 2001 ; Anderson et al., 2013 ; Tognoli & Kelso, 2014 ; Anderson & Chemero, 2016).
Dans cette perspective et concernant le TSPT, des études ont montré qu’il existerait une « rigidification » des assemblages neuronaux (Jin et al., 2017 ; Rangaprakash et al., 2017 ; Wen et al., 2022 ; Dai et al., 2023 ; Suo et al., 2023). Dans ces travaux, il est montré qu’un facteur essentiel du TSPT est la réduction de la reconfiguration de la connectivité entre des régions cérébrales. Jin et al. (2017) ont ainsi montré que les mesures de connectivité dynamique étaient des meilleurs prédicteurs du diagnostic du TSPT, par rapport à des mesures statiques.
L’ensemble de ces données montre que pour rendre pleinement compte de l’évolution temporelle et de la nature « multi-échelles » du cerveau, il est nécessaire de passer d’une approche localisationniste à une approche dynamique du « cerveau entier » pour étudier la façon dont les éléments constitutifs de ce système complexe interagissent d’une manière dépendante du temps. Cette transition a notamment été rendue possible par l’intérêt croissant porté à la représentation du cerveau comme un ensemble de réseaux dynamiques au cours des 20 dernières années (Varela et al., 2001 ; Bullmore & Bassett, 2011 ; Tognoli & Kelso, 2014 ; Fornito et al., 2015 ; Bassett & Sporns, 2017 ; Breakspear, 2017 ; Avena-Koenigsberger et al., 2018). En accord avec ces travaux, l’application du cadre des sciences des réseaux à l’étude du TSPT permettrait de re-conceptualiser les théories localisationnistes au travers d’une perspective complexe, prenant en compte l’enchevêtrement dynamique de l’architecture et de la fonction des régions cérébrales.
Néanmoins, avant de présenter les avantages de l’utilisation des neurosciences des réseaux pour l’étude du TSPT, il convient de rappeler les avancées conceptuelles et méthodologiques que l’approche par réseaux a apporté pour la compréhension du fonctionnement cérébral. Nous développons ici les concepts clés pour comprendre la manière dont la réorganisation continue entre régions cérébrales a lieu.
Les réseaux cérébraux
La coexistence d’unités spécialisées mais interdépendantes s’explique facilement en considérant le cerveau comme un système complexe composé d’unités distinctes (nœuds), connectées entre elles (arêtes). Adopter cette perspective implique qu’il n’est pas suffisant de considérer isolément les éléments individuels pour expliquer et étudier les réseaux cérébraux, puisque leurs propriétés émergent de l’interaction dynamique et réciproque de ces unités. La complexité et la théorie des systèmes dynamiques fournissent le vocabulaire et les outils nécessaires pour étudier le cerveau comme un réseau dynamique.
Au contraire des approches connexionnistes initiales, l’approche en réseau souligne l’importance de l’organisation topologique du réseau pour comprendre l’activité locale et globale du système cérébral (Sporns, 2013). En effet, l’empreinte topologique d’une région cérébrale, à savoir l’ensemble des connexions afférentes et efférentes qu’elle établit avec le reste du réseau, joue un rôle fondamental dans l’identité de cette région, et dans la façon avec laquelle elle échange de l’information avec le reste du réseau (Ito et al., 2020). Les méthodes de visualisation de la connectivité structurale in vivo ont permis l’accès à cette topologie cérébrale. Par exemple, l’imagerie par tenseur de diffusion (Diffusion Tensor Imaging ; DTI) permet de visualiser la localisation et l’intégrité des fibres de matière blanche, et de cartographier les faisceaux reliant les structures corticales et sous-corticales. Cette cartographie des faisceaux constitue ce qu’on appelle le connectome (i.e., réseau cérébral structurel).
Au sein de cette architecture structurelle, le flux de signalisation neuronale et des dynamiques de coordination émerge (Avena-Koenigsberger et al., 2018). Le flux de signalisation renvoie à la distribution des échanges neuronaux dans un contexte spatio-temporel défini (Avena-Koenigsberger et al., 2018). En IRMf, ce flux d’information est observable au travers de la distribution des amplitudes d’activation dans les différentes régions cérébrales (Cole et al., 2016). De plus, les dynamiques de coordination représentent la tendance à former et à dissoudre des patterns structurés de (quasi)synchronisations entre des régions cérébrales (Kelso, 2012 ; Tognoli & Kelso, 2014). Les mécanismes sous-tendant la relation entre signalisation neuronale et dynamique de coordination de réseaux neuronaux à grande échelle sont encore méconnus. Cependant, ces deux processus se déroulent au sein du réseau neuronal structurel, faisant de la topologie du réseau un élément clef, imposant des contraintes spatiales qui permettent les dynamiques cérébrales et produisent les dépendances statistiques qu’on observe en IRMf (i.e., connectivité fonctionnelle).
Ainsi, une propriété essentielle des assemblages neuronaux à grande échelle est qu’ils se reconfigurent constamment. De fait, étudier ces évolutions dans le temps permet d’appréhender la façon dont l’information est distribuée et organisée au sein du cerveau. Par exemple, leur reconfiguration continue, reflétée par le couplage (i.e., intégration) et découplage (i.e., ségrégation) de régions cérébrales au sein de chaque assemblage, témoigne des dynamiques de la connectivité fonctionnelle (Shine et al., 2016 ; Wang et al., 2021).
Ces changements résultent de propriétés endogènes (issues des antécédents du système) et des stimuli exogènes (issus de l’extérieur du système). Ainsi, la tendance des régions cérébrales à être couplées et découplées dépend du contexte et est critique pour la façon dont le système cérébral répond aux contingences de l’environnement. Les systèmes biologiques sont des exemples prototypiques de réseaux devant préserver leur viabilité au cours du temps, tout en s’adaptant et intégrant de l’information issue d’un environnement hautement dynamique et imprédictible. Il est possible qu’au cours de son existence un organisme biologique doive faire face à un évènement menaçant sa survie. Chez l’humain, un tel évènement déclenche un ensemble de réponses psychologiques et physiologiques, qui ont été extensivement décrites depuis le début de l’étude des effets des évènements traumatiques. Toutefois, il n’existe à ce jour aucune description des réponses au traumatisme du point de vue des systèmes complexes dynamiques.
La loi de la variété requise d’Ashby postule qu’afin de maximiser les options pour répondre de manière adéquate à une perturbation externe, un système doit posséder un éventail suffisamment conséquent de réponses internes pour maintenir sa stabilité (Sporns, 2013). Quel est l’éventail de réponses dont dispose le cerveau pour faire face au traumatisme ? Autrement dit, quelles sont les propriétés fondamentales du réseau pour assurer la résilience cérébrale, permettant de faire face à une forte perturbation externe, jamais rencontrée auparavant ? À partir de travaux sur la complexité cérébrale, nous insisterons sur l’importance de la redondance fonctionnelle (degeneracy) et de la réserve neuronale (Fornito et al., 2015), ainsi que sur leur étroite association avec la topologie du réseau, ses dynamiques de coordination, et son flux d’informations.
Le modèle dynamique des réseaux neuronaux du TSPT
L’approche en réseaux dynamiques représente un cadre intéressant pour formaliser l’impact de l’exposition à un évènement traumatique au niveau cérébral. Les sciences des réseaux fournissent un cadre formel pour étudier la transition d’un système neuronal d’un état 1 (e.g., avant perturbation) à un état 2 (e.g., après perturbation), prenant en compte les propriétés locales et globales du réseau ainsi que ses propriétés structurelles et fonctionnelles.
Quels facteurs seraient pertinents pour comprendre la réponse cérébrale à un évènement traumatique ? Pour répondre à cette question, nous utilisons un modèle de la résilience au stress (Kalisch et al., 2017), couplé à l’approche complexe dynamique présentée précédemment. Concrètement, nous cherchons à adapter l’approche connectomique (en réseau) aux troubles du système nerveux central (Fornito et al., 2015), dans le but d’affiner la description et la prédiction des réponses cérébrales associées, avec la mise en place de mécanismes adaptatifs pour faire face à un évènement traumatique.
Nous prenons en compte la distinction proposée par Kalisch et al. (2017) entre facteurs de résilience (i.e., caractéristiques individuelles présentes avant l’évènement traumatique susceptibles d’intervenir dans la réponse adaptative à un évènement stressant) et la résilience en elle-même (i.e., la réponse adaptative après exposition à un évènement stressant).
Au cours et à la suite d’un évènement traumatique, un individu exposé doit faire face à un stress intense, affectant le réseau neuronal. Pour répondre à cette perturbation, des mécanismes dévolus à la préservation de l’intégrité de l’individu sont déclenchés. L’efficacité de ces mécanismes déterminerait ainsi la tendance du système neuronal à adopter une trajectoire adaptative (i.e., résiliente) ou mal-adaptative (i.e., pathologique). Il est important de noter que l’efficacité de la réponse elle-même est partiellement conditionnée par les propriétés du réseau avant l’évènement traumatique (i.e., facteurs de résilience) (Figure 1). De plus, l’évolution des réponses cérébrales au cours du temps serait également critique pour persévérer dans une même trajectoire, ou pour la modifier (i.e., temps d’atténuation) (Figure 2).
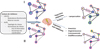 |
Figure 1 Modèle dynamique des réseaux neuronaux (DBNM) du TSPT. La topologie des réseaux, représentée par des liens (traits noirs), contraint la manière dont l’information se propage à l’intérieur du réseau (flèches roses) et les patterns de coordination qui apparaissent (similarité de dégradé de la couleur bleue entre les nœuds, i.e., une similarité dans la couleur représente une coordination importante). Avant une éventuelle expérience traumatique, des facteurs de résilience sont présents sous la forme de facteurs latents ou actifs. La partie I représente un réseau avec des facteurs de résilience importants : l’assemblage a-b-c et l’assemblage h-g-d montrent une redondance fonctionnelle, représentée par l’entourage violet de deux assemblages. De plus, les régions a et b présentent une réserve neuronale importante (taille du nœud). Après l’exposition au trauma affectant les régions a et b, ce réseau neuronal tendra plus facilement vers une trajectoire adaptative car il a accès, grâce aux dynamiques de communication efficaces (flèches violettes), à des facteurs de résilience latents. L’assemblage redondant h-g-d + c pourra prendre provisoirement le relais (couleur verte entourant les nœuds). Au contraire, si le réseau ne dispose pas de suffisamment de facteurs de résilience latents, ou si ceux-ci ne sont pas accessibles à cause de l’inefficacité des facteurs de résilience actifs, des réponses mal-adaptatives peuvent survenir après la perturbation. Dans cet exemple, après la perturbation, le réseau annoté II, déjà fragile, entre dans une trajectoire mal-adaptative, avec une affectation générale du fonctionnement du réseau y compris des assemblages plus distants (représentés ici par le changement de couleurs entourant les nœuds). L’image du cerveau est libre d’utilisation (Creative Commons Attribution 4.0) et a été extraite du site https://www.injurymap.com/free-human-anatomy-illustrations. |
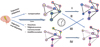 |
Figure 2 Évolution du profil de la réponse à la perturbation avec le temps. En réponse à la perturbation, le temps d’atténuation est un facteur essentiel dans l’évolution du comportement du réseau. Une trajectoire adaptative qui permet au système de retrouver un état d’équilibre constituerait l’aboutissement de la réponse à la perturbation (trajectoire I). Au contraire, si la réponse persiste dans le temps, le réseau ne retrouve pas un état d’équilibre, le système peut finir par entrer dans une trajectoire mal-adaptative (trajectoire II). De même, une trajectoire mal-adaptative qui se maintient dans le temps peut engendrer des altérations fonctionnelles et structurelles de plus en plus sévères (trajectoire IV). Figure une dernière trajectoire possible et essentielle d’un point de vue thérapeutique, celle de la réincorporation dans une trajectoire adaptative alors que le système était « engagé » dans une trajectoire mal-adaptative (trajectoire III). |
La trajectoire adaptative
Facteurs de résilience
L’approche de Fornito et al. (2015) propose la réserve neuronale et la redondance neuronale comme prédicateurs principaux d’une trajectoire adaptative du réseau neuronal après une perturbation. La redondance fonctionnelle renvoie à une organisation fonctionnelle polyvalente, avec une distribution des fonctions chevauchant différents éléments du réseau. Plutôt que la définition centrée sur une région proposée par ces auteurs, nous préférons utiliser une définition appliquée au système : « Il est possible d’arriver au même résultat ou à la même fonction en utilisant différentes composantes, et de différentes façons » (Kelso, 2012). Ainsi, si des assemblages neuronaux optimisés pour une fonction sont endommagés, d’autres assemblages (redondants) peuvent prendre le relais.
La réserve neuronale, quant à elle, renvoie à la réserve disponible de tissu neuronal ; elle est particulièrement importante pour les systèmes biologiques, au sein desquels les contraintes physiques et physiologiques sont des éléments moteurs (par exemple, le cerveau dispose d’un espace limité au sein de la boîte crânienne, et requiert un approvisionnement constant en nutriments).
La redondance fonctionnelle et la réserve neuronale sont des facteurs de résilience latents. Comme leur nom l’indique, ces facteurs ne sont mobilisés qu’en réponse à une perturbation. Quelles sont les conditions nécessaires pour que le système neuronal puisse accéder à ces ressources latentes ? En effet, l’accès à la réserve neuronale et l’implémentation de la redondance fonctionnelle requièrent une configuration spatio-temporelle de régions cérébrales spécifiques. Comme exposé précédemment, cette configuration dépend de la propagation du flux de signalisation neuronale et des capacités de coordination, qui, à leur tour, dépendent du connectome. De ce fait, nous proposons trois facteurs de résilience actifs, impliqués dans la capacité à accéder aux facteurs de résilience latents : l’état de la topologie du réseau, les dynamiques de communication et les dynamiques de coordination.
Résilience
Quand un système complexe subit une perturbation dans son fonctionnement, plusieurs réponses sont possibles. D’une part, le système peut déclencher une série de réponses adaptatives afin de compenser le dysfonctionnement des régions affectées par la perturbation et limiter ainsi la propagation de l’insulte. Concernant le système cérébral, cette compensation a lieu grâce à la modification de l’activité et la reconfiguration d’assemblages neuronaux. La compensation dépend à la fois des facteurs de résilience latents et actifs. En effet, l’accès à la réserve neuronale stockée et la mobilisation de la redondance fonctionnelle dépendent des facteurs de résilience actifs. Néanmoins, des dynamiques efficaces pour accéder aux ressources latentes sont inutiles, si ces ressources sont insuffisantes.
La trajectoire mal-adaptative
Comme proposé par Fornito et al. (2015), le diaschisis, la dégénérescence transneuronale et la dédifférenciation sont des réponses mal-adaptatives du réseau neuronal, possibles après une perturbation. L’entrée dans une trajectoire mal-adaptative est la conséquence de l’incapacité du système cérébral à se reconfigurer pour limiter la propagation de la perturbation. Ainsi, le diaschisis correspond à la désynchronisation fonctionnelle ou au dysfonctionnement de régions cérébrales non nécessairement connectées directement à la région cérébrale touchée par la perturbation. La dégénérescence transneuronale antérograde ou rétrograde peut faire suite au phénomène de diaschisis, et renvoie à la détérioration physique de régions neuronales distantes, résultant de la perturbation d’autres neurones à proximité. Enfin, la dédifférenciation renvoie à une perte de l’identité fonctionnelle des régions. Bien que déjà importante, cette liste des réponses mal-adaptatives possibles d’un réseau neuronal après avoir été exposé à une perturbation n’est pas exhaustive.
Temps d’atténuation
Un élément supplémentaire figurant dans la manière dont un système neuronal répond à une perturbation est le temps d’atténuation de sa réponse (Figure 2). À la suite d’un évènement traumatique, la même réponse cérébrale peut être normale ou pathologique en fonction du temps d’atténuation (de la même façon qu’une réponse accrue à la peur à la suite d’un évènement stressant est adaptative, sous réserve d’une diminution subséquente de l’intensité de cette réponse). Le phénomène de diaschisis et la compensation modifient également les patterns de synchronicité entre les régions cérébrales. En revanche, la dégénérescence transneuronale et la dédifférenciation n’apparaissent qu’en cas de pérennisation de ces modifications (Fornito et al., 2015).
En résumé, au cours et à la suite d’un évènement traumatique, le profil de dynamique cérébrale est modifié. Les modifications correspondantes reflètent la tendance du système neural à adopter une trajectoire résiliente ou pathologique. La capacité du système à compenser les dysfonctionnements grâce à une réorganisation efficace, permettant de contrer sa défaillance (dégénérescence), est centrale pour l’orientation vers une trajectoire résiliente. Au total, l’efficacité de la réponse du système cérébral dépend de l’état de son organisation topologique structurelle, et de l’efficacité des dynamiques de communication et de coordination. Ainsi, une procédure hautement efficace permettrait une diminution du temps nécessaire pour faire face à l’évènement traumatique, limitant de fait la susceptibilité de développer un état pathologique.
Mesures et simulations
L’avantage principal du DBNM du TSPT est l’introduction d’un cadre théorique permettant d’envisager de nouvelles façons de quantifier l’impact cérébral de l’exposition à un évènement traumatique. Dans cette section, nous présenterons brièvement les mesures existantes pour, d’une part, quantifier les différentes variables apparaissant dans le DBNM, et d’autre part, les utiliser pour nourrir les travaux de modélisation computationnelle du TSPT.
Concernant la topologie du réseau cérébral et sa relation avec les dynamiques de communication, il est possible d’utiliser des mesures quantitatives, allant des analyses topologiques générales (e.g., efficience, modularité) à des mesures plus sophistiquées du flux d’informations à travers le connectome (Goni et al., 2014 ; Amico et al., 2021). Par exemple, il pourrait être possible de quantifier les dynamiques de communication en testant la perturbation du flux d’informations dans le TSPT en termes d’une perte de sa « directionnalité » à travers des routes préférentielles [e.g., efficacité de la transmission dirigée (routing efficiency) ; recherche d’informations plus importante (search information) : Goni et al., 2014] ou de l’augmentation d’une transmission étendue similaire à la diffusion [e.g., augmentation de la diffusion d’une voie topologique (path broadcasting) : Amico et al., 2021]. Ces mesures permettraient donc d’avoir des informations concernant les dynamiques de communication au sein du connectome (i.e., facteurs de résilience actifs).
De façon complémentaire, de récentes études se sont intéressées à l’évolution temporelle des configurations des assemblages neuronaux, par exemple en utilisant des mesures en IRMf (Cole et al., 2016 ; Deco et al., 2017 ; Murphy et al., 2020 ; Amico et al., 2021 ; van De Ville et al., 2021 ; Fransson & Strindberg, 2023 ; Santoro et al., 2023), et particulièrement dans l’étude du TSPT (Suo et al., 2023). Il est ainsi possible de clarifier le profil dynamique de la balance ségrégation/intégration (Deco & Kringelbach, 2014 ; Deco et al., 2015 ; Lord et al., 2017 ; Wig, 2017). La reconfiguration des assemblages neuronaux étant directement liée à la résilience neuronale, elle est un élément critique au cœur du DBNM. Pour accéder à cette balance, la théorie des graphes, et plus spécifiquement les analyses de modularité dynamique, ont été utilisées (Bassett et al., 2011 ; Betzel et al., 2016 ; Shine et al., 2016 ; Murphy et al., 2020).
Néanmoins, ces analyses ne fournissent pas d’informations sur les mécanismes sous-jacents aux dynamiques temporelles associées au TSPT. Pour ce faire, il serait nécessaire de manipuler directement les variables d’intérêt (région cérébrales, réseaux, dynamiques) et d’en observer les conséquences. Toutefois, pour des raisons éthiques et méthodologiques, il est impossible de réaliser ce genre de manipulation sur le cerveau humain. En revanche, il est aujourd’hui possible de simuler la topologie et les dynamiques cérébrales in-silico (connectomes computationnels) (Lord et al., 2017).
Le but de la modélisation computationnelle est de produire des données neuronales simulées afin de les comparer avec des données réelles (empiriques). Pour permettre des estimations réalistes, les données simulées doivent être contraintes par des facteurs biologiques (e.g., fréquence de décharge des neurones ; topologie cérébrale). Elles peuvent être manipulées dans le but d’étudier la façon dont une perturbation pourrait influencer un réseau neuronal (Mišić et al., 2015), et ainsi contribuer au diagnostic, à l’estimation du pronostic, et à la prédiction et l’évaluation des interventions cliniques (Lord et al., 2017).
Conclusions et perspectives
La recherche en neurosciences des dernières décennies a permis l’acquisition de connaissances substantielles sur les processus neurobiologiques fondamentaux sous-tendant les réponses à la peur et à la menace. Ainsi, des régions cérébrales spécifiques ont été identifiées comme jouant un rôle critique dans les réponses (mal)adaptatives à un évènement traumatique (Dunsmoor et al., 2022). De plus, des travaux définissant des régions d’intérêt a priori, notamment au sein de « réseaux au repos » tels que le réseau de la saillance, le réseau du mode par défaut, ainsi que le réseau de contrôle fronto-pariétal, ont permis d’identifier des marqueurs statiques cérébraux associés au TSPT.
Cependant, bien que les approches se focalisant sur des circuits neuronaux ou des régions spécifiques soient nécessaires et instructives, elles laissent de côté des informations importantes sur le fonctionnement cérébral global. Ainsi, des études tenant compte du cerveau entier (Breukelaar et al., 2021 ; Lebois et al., 2021 ; Shaw et al., 2022) et dynamique (Jin et al., 2017 ; Dai et al., 2023 ; Suo et al., 2023) commencent à donner des indices détaillés sur le TSPT.
Un cadre théorique précis pour envisager l’impact d’un évènement traumatique sur les réseaux neuronaux n’avait pas encore été proposé. Ainsi, nous introduisons le modèle dynamique des réseaux neuronaux (DBNM) appliqué au TSPT donnant un nouveau vocabulaire pour formuler des hypothèses relatives à l’évolution de ce syndrome. Dans cette perspective, il est essentiel de développer des études longitudinales, telles que celle présente dans le Programme 13-Novembre, étudiant sur trois temps différents la connectivité structurale et fonctionnelle à la suite des traumatismes du 13 Novembre 2015 (http://www.memoire13novembre.fr/).
Remerciements
Les auteurs remercient Michel Hamon, consultant et Evelyne Vila-Porcile, rédactrice de Biologie Aujourd’hui, pour leur relecture détaillée et les corrections apportées à ce manuscrit.
Références
- Akiki, T.J., Averill, C.L., Abdallah, C.G. (2017). A network-based neurobiological model of PTSD: Evidence from structural and functional neuroimaging studies. Curr Psychiatry Rep, 19, 81. [CrossRef] [PubMed] [Google Scholar]
- Alexander-Bloch, A., Lambiotte, R., Roberts, B., Giedd, J., Gogtay, N., Bullmore, E. (2012). The discovery of population differences in network community structure: New methods and applications to brain functional networks in schizophrenia. NeuroImage, 59, 3889-3900. [CrossRef] [PubMed] [Google Scholar]
- Allen, E.A., Damaraju, E., Plis, S.M., Erhardt, E.B., Eichele, T., Calhoun, V.D. (2014). Tracking whole-brain connectivity dynamics in the resting state. Cerebral Cortex, 24, 663-676. [CrossRef] [PubMed] [Google Scholar]
- Amico, E., Abbas, K., Duong-Tran, D.A., Tipnis, U., Rajapandian, M., Chumin, E., Ventresca, M., Harezlak, J., Goñi, J. (2021). Toward an information theoretical description of communication in brain networks. Netw Neurosci, 5, 646-665. [PubMed] [Google Scholar]
- Anderson, M., Chemero, A., The brain evolved to guide action, in: The Wiley handbook of evolutionary neuroscience, John Wiley & Sons Ltd, 2016, pp. 1-20. [Google Scholar]
- Anderson, M.L., Kinnison, J., Pessoa, L. (2013). Describing functional diversity of brain regions and brain networks. NeuroImage, 73, 50-58. [CrossRef] [PubMed] [Google Scholar]
- Avena-Koenigsberger, A., Misic, B., Sporns, O. (2018). Communication dynamics in complex brain networks. Nat Rev Neurosci, 19, 17-33. [CrossRef] [Google Scholar]
- Bassett, D.S., Sporns, O. (2017). Network neuroscience. Nat Neurosci, 20, 353-364. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Bassett, D.S., Wymbs, N.F., Porter, M.A., Mucha, P.J., Carlson, J.M., Grafton, S.T. (2011). Dynamic reconfiguration of human brain networks during learning. Proc Natl Acad Sci USA, 108, 7641-7646. [CrossRef] [PubMed] [Google Scholar]
- Bassett, D.S., Yang, M., Wymbs, N.F., Grafton, S.T. (2015). Learning-induced autonomy of sensorimotor systems. Nat Neurosci, 18, 744-751. [CrossRef] [PubMed] [Google Scholar]
- Betzel, R.F., Fukushima, M., He, Y., Zuo, X.-N., Sporns, O. (2016). Dynamic fluctuations coincide with periods of high and low modularity in resting-state functional brain networks. NeuroImage, 127, 287-297. [CrossRef] [PubMed] [Google Scholar]
- Breakspear, M. (2017). Dynamic models of large-scale brain activity. Nat Neurosci, 20, 340-352. [CrossRef] [PubMed] [Google Scholar]
- Breukelaar, I.A., Bryant, R.A., Korgaonkar, M.S. (2021). The functional connectome in post-traumatic stress disorder. Neurobiol Stress, 14, 100321. [CrossRef] [PubMed] [Google Scholar]
- Bullmore, E., Sporns, O. (2009). Complex brain networks: Graph theoretical analysis of structural and functional systems. Nat Rev Neurosci, 10, 186-198. [CrossRef] [MathSciNet] [Google Scholar]
- Bullmore, E.T., Bassett, D.S. (2011). Brain graphs: Graphical models of the human brain connectome. Ann Rev Clin Psychol, 7, 113-140. [CrossRef] [PubMed] [Google Scholar]
- Cole, M.W., Bassett, D.S., Power, J.D., Braver, T.S., Petersen, S.E. (2014). Intrinsic and task-evoked network architectures of the human brain. Neuron, 83, 238-251. [CrossRef] [PubMed] [Google Scholar]
- Cole, M.W., Ito, T., Bassett, D.S., Schultz, D.H. (2016). Activity flow over resting-state networks shapes cognitive task activations. Nat Neurosci, 19, 1718-1726. [CrossRef] [PubMed] [Google Scholar]
- Dai, Y., Zhou, Z., Chen, F., Zhang, L., Ke, J., Qi, R., Lu, G., Zhong, Y. (2023). Altered dynamic functional connectivity associates with post-traumatic stress disorder. Brain Imaging Behav, 17, 294-305. [CrossRef] [PubMed] [Google Scholar]
- Deco, G., Kringelbach, M.L. (2014). Great expectations: Using whole-brain computational connectomics for understanding neuropsychiatric disorders. Neuron, 84, 892-905. [CrossRef] [PubMed] [Google Scholar]
- Deco, G., Tononi, G., Boly, M., Kringelbach, M.L. (2015). Rethinking segregation and integration: contributions of whole-brain modelling. Nat Rev Neurosci, 16, 430-439. [CrossRef] [MathSciNet] [Google Scholar]
- Deco, G., Kringelbach, M.L., Jirsa, V.K., Ritter, P. (2017). The dynamics of resting fluctuations in the brain: Metastability and its dynamical cortical core. Sci Rep, 7, 3095. [Google Scholar]
- Dunsmoor, J.E., Cisler, J.M., Fonzo, G.A., Creech, S.K., Nemeroff, C.B. (2022). Laboratory models of post-traumatic stress disorder: The elusive bridge to translation. Neuron, 110, 1754-1776. [CrossRef] [PubMed] [Google Scholar]
- Fornito, A., Zalesky, A., Breakspear, M. (2015). The connectomics of brain disorders. Nat Rev Neurosci, 16, 159-172. [CrossRef] [PubMed] [Google Scholar]
- Fransson, P., Strindberg, M. (2023). Brain network integration, segregation and quasi-periodic activation and deactivation during tasks and rest. NeuroImage, 268, 119890. [CrossRef] [PubMed] [Google Scholar]
- Goni, J., van den Heuvel, M.P., Avena-Koenigsberger, A., Velez de Mendizabal, N., Betzel, R.F., Griffa, A., Hagmann, P., Corominas-Murtra, B., Thiran, J.-P., Sporns, O. (2014). Resting-brain functional connectivity predicted by analytic measures of network communication. Proc Natl Acad Sci USA, 111, 833-838. [CrossRef] [PubMed] [Google Scholar]
- Ito, T., Hearne, L., Mill, R., Cocuzza, C., Cole, M.W. (2020). Discovering the computational relevance of brain network organization. Trends Cogn Sci, 24, 25-38. [Google Scholar]
- Jin, C., Jia, H., Lanka, P., Rangaprakash, D., Li, L., Liu, T., Hu, X., Deshpande, G. (2017). Dynamic brain connectivity is a better predictor of PTSD than static connectivity. Hum Brain Mapp, 38, 4479-4496. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Kalisch, R, Baker, D.G., Basten, U., Boks, M.P., Bonanno, G.A., Brummelman, E., Chmitorz, A., Fernàndez, G., Fiebach, C.J., Galatzer-Levy, I., Geuze, E., Groppa, S., Helmreich, I., Hendler, T., Hermans, E.J., Jovanovic, T., Kubiak, T., Lieb, K., Lutz, B., Müller, M.B., Murray, R.J., Nievergelt, C.M., Reif, A., Roelofs, K., Rutten, B.P.F., Sander, D., Schick, A., Tüscher, O., Diest, I.V., Harmelen, A.V., Veer, I.M., Vermetten, E., Vinkers, C.H., Wager, T.D., Walter, H., Wessa, M., Wibral, M., Kleim, B. (2017). The resilience framework as a strategy to combat stress-related disorders. Nat Hum Behav, 1, 784-790. [CrossRef] [PubMed] [Google Scholar]
- Kelso, J.A.S. (2012). Multistability and metastability: Understanding dynamic coordination in the brain. Philos Trans R Soc Lond, B, Biol Sci, 367, 906-918. [CrossRef] [PubMed] [Google Scholar]
- Lebois, L.A.M., Li, M., Baker, J.T., Wolff, J.D., Wang, D., Lambros, A.M., Grinspoon, E., Winternitz, S., Ren, J., Gönenç, A., Gruber, S.A., Ressler, K.J., Liu, H., Kaufman, M.L. (2021). Large-scale functional brain network architecture changes associated with trauma-related dissociation. Am J Psychiatry, 178, 165-173. [CrossRef] [PubMed] [Google Scholar]
- Lord, L.-D., Stevner, A.B., Deco, G., Kringelbach, M.L. (2017). Understanding principles of integration and segregation using whole-brain computational connectomics: Implications for neuropsychiatric disorders. Philos Trans Royal Soc, 375, 20160283. [MathSciNet] [Google Scholar]
- Mattar, M.G., Cole, M.W., Thompson-Schill, S.L., Bassett, D.S. (2015). A functional cartography of cognitive systems. PLoS Comput Biol, 11, e1004533. [CrossRef] [PubMed] [Google Scholar]
- Menon, V. (2011). Large-scale brain networks and psychopathology: A unifying triple network model. Trends Cogn Sci, 15, 483-506. [Google Scholar]
- Murphy, A.C., Bertolero, M.A., Papadopoulos, L., Lydon-Staley, D.M., Bassett, D.S. (2020). Multimodal network dynamics underpinning working memory. Nat Commun, 11, 3035. [CrossRef] [PubMed] [Google Scholar]
- Pitman, R.K., Rasmusson, A.M., Koenen, K.C., Shin, L.M., Orr, S.P., Gilbertson, M.W., Milad, M.R., Liberzon, I. (2012). Biological studies of post-traumatic stress disorder. Nat Rev Neurosci, 13, 769-787. [CrossRef] [PubMed] [Google Scholar]
- Power, J.D., Cohen, A.L., Nelson, S.M., Wig, G.S., Barnes, K.A., Church, J.A., Vogel, A.C., Laumann, T.O., Miezin, F.M., Schlaggar, B.L., Petersen, S.E. (2011). Functional network organization of the human brain. Neuron, 72, 665-678. [CrossRef] [PubMed] [Google Scholar]
- Puxeddu, M.G., Faskowitz, J., Betzel, R.F., Petti, M., Astolfi, L., Sporns, O. (2020). The modular organization of brain cortical connectivity across the human lifespan. NeuroImage, 218, 116974. [CrossRef] [PubMed] [Google Scholar]
- Rangaprakash, D., Dretsch, M.N., Venkataraman, A., Katz, J.S., Denney, T.S., Deshpande, G. (2017). Identifying disease foci from static and dynamic effective connectivity networks: Illustration in soldiers with trauma. Hum Brain Mapp, 39, 264-287. [Google Scholar]
- Ressler, K.J., Berretta, S., Bolshakov, V.Y., Rosso, I.M., Meloni, E.G., Rauch, S.L., Carlezon, W.A. (2022). Post-traumatic stress disorder: Clinical and translational neuroscience from cells to circuits. Nat Rev Neurol, 18, 273-288. [CrossRef] [PubMed] [Google Scholar]
- Santoro, A., Battiston, F., Petri, G., Amico, E. (2023). Higher-order organization of multivariate time series. Nature Physics, 19, 221-229. [Google Scholar]
- Schotten de, T.M., Forkel, S.J. (2022). The emergent properties of the connected brain. Science, 378, 505-510. [CrossRef] [PubMed] [Google Scholar]
- Shaw, S., Terpou, B., Densmore, M., Theberge, J., Frewen, P., McKinnon, M., Lanius, R. (2022). Large-scale functional hyperconnectivity patterns characterizing trauma-related dissociation: A rs-fMRI study of PTSD and its dissociative subtype. PsyArXiv Oct. 7. Web. [Google Scholar]
- Shin, L.M., Rauch, S.L., Pitman, R.K. (2006). Amygdala, medial prefrontal cortex, and hippocampal function in PTSD. Ann N Y Acad Sci, 1071, 67-79. [CrossRef] [PubMed] [Google Scholar]
- Shine, J.M., Bissett, P.G., Bell, P.T., Koyejo, O., Balsters, J.H., Gorgolewski, K.J., Moodie, C.A., Poldrack, R.A. (2016). The dynamics of functional brain networks: Integrated network states during cognitive task performance. Neuron, 92, 544-554. [CrossRef] [PubMed] [Google Scholar]
- Sporns, O. (2013). Network attributes for segregation and integration in the human brain. Curr Opin Neurobiol, 23, 162-171. [CrossRef] [PubMed] [Google Scholar]
- Sporns, O. (2022). The complex brain: Connectivity, dynamics, information. Trends Cogn Sci, 26, 1066-1067. [Google Scholar]
- Suo, X., Zuo, C., Lan, H., Li, W., Li, L., Kemp, G.J., Wang, S., Gong, Q. (2023). Multilayer network analysis of dynamic network reconfiguration in adults with posttraumatic stress disorder. Biol Psych Cogn Neurosci Neuroimaging, 8, 452-461. [Google Scholar]
- Tognoli, E., Kelso, J.A.S. (2014). The metastable brain. Neuron, 81, 35-48. [CrossRef] [PubMed] [Google Scholar]
- Uddin, L.Q., Yeo, B.T.T., Spreng, R.N. (2019). Towards a universal taxonomy of macro-scale functional human brain networks. Brain Topography, 32, 926-942. [CrossRef] [PubMed] [Google Scholar]
- van De Ville, D., Farouj, Y., Preti, M.G., Liégeois, R., Amico, E. (2021). When makes you unique: Temporality of the human brain fingerprint. Sci Adv, 7, eabj0751. [CrossRef] [Google Scholar]
- Varela, F., Lachaux, J.-P., Rodriguez, E., Martinerie, J. (2001). The brainweb: Phase synchronization and large-scale integration. Nat Rev Neurosci, 2, 229-239. [CrossRef] [PubMed] [Google Scholar]
- Wang, R., Liu, M., Cheng, X., Wu, Y., Hildebrandt, A., Zhou, C. (2021). Segregation, integration, and balance of large-scale resting brain networks configure different cognitive abilities. Proc Natl Acad Sci USA, 118, e2022288118. [Google Scholar]
- Wen, Z., Seo, J., Pace-Schott, E.F., Milad, M.R. (2022). Abnormal dynamic functional connectivity during fear extinction learning in PTSD and anxiety disorders. Mol Psychiatry, 27, 2216-2224. [CrossRef] [PubMed] [Google Scholar]
- Wig, G.S. (2017). Segregated systems of human brain networks. Trends Cogn Sci, 21, 981-996. [Google Scholar]
- Yehuda, R., Hoge, C.W., McFarlane, A.C., Vermetten, E., Lanius, R.A., Nievergelt, C.M., Hobfoll, S.E., Koenen, K.C., Neylan, T.C., Hyman, S.E. (2015). Post-traumatic stress disorder. Nat Rev Dis Primers, 1, 15057. [CrossRef] [PubMed] [Google Scholar]
- Yeo, B.T.T., Krienen, F.M., Sepulcre, J., Sabuncu, M.R., Lashkari, D., Hollinshead, M., Roffman, J.L., Smoller, J.W., Zöllei, L., Polimeni, J.R., Fischl, B., Liu, H., Buckner, R.L. (2011) The organization of the human cerebral cortex estimated by intrinsic functional connectivity. J Neurophysiol, 106, 1125-1165. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Corredor, D., Vallet, A., Riou, M., Eustache, F., et Guillery-Girard, B. (2023). Les sciences des réseaux appliquées à l’étude du Trouble de Stress Post-Traumatique. Biologie Aujourd’hui, 217, 79-87
Liste des figures
 |
Figure 1 Modèle dynamique des réseaux neuronaux (DBNM) du TSPT. La topologie des réseaux, représentée par des liens (traits noirs), contraint la manière dont l’information se propage à l’intérieur du réseau (flèches roses) et les patterns de coordination qui apparaissent (similarité de dégradé de la couleur bleue entre les nœuds, i.e., une similarité dans la couleur représente une coordination importante). Avant une éventuelle expérience traumatique, des facteurs de résilience sont présents sous la forme de facteurs latents ou actifs. La partie I représente un réseau avec des facteurs de résilience importants : l’assemblage a-b-c et l’assemblage h-g-d montrent une redondance fonctionnelle, représentée par l’entourage violet de deux assemblages. De plus, les régions a et b présentent une réserve neuronale importante (taille du nœud). Après l’exposition au trauma affectant les régions a et b, ce réseau neuronal tendra plus facilement vers une trajectoire adaptative car il a accès, grâce aux dynamiques de communication efficaces (flèches violettes), à des facteurs de résilience latents. L’assemblage redondant h-g-d + c pourra prendre provisoirement le relais (couleur verte entourant les nœuds). Au contraire, si le réseau ne dispose pas de suffisamment de facteurs de résilience latents, ou si ceux-ci ne sont pas accessibles à cause de l’inefficacité des facteurs de résilience actifs, des réponses mal-adaptatives peuvent survenir après la perturbation. Dans cet exemple, après la perturbation, le réseau annoté II, déjà fragile, entre dans une trajectoire mal-adaptative, avec une affectation générale du fonctionnement du réseau y compris des assemblages plus distants (représentés ici par le changement de couleurs entourant les nœuds). L’image du cerveau est libre d’utilisation (Creative Commons Attribution 4.0) et a été extraite du site https://www.injurymap.com/free-human-anatomy-illustrations. |
| Dans le texte | |
 |
Figure 2 Évolution du profil de la réponse à la perturbation avec le temps. En réponse à la perturbation, le temps d’atténuation est un facteur essentiel dans l’évolution du comportement du réseau. Une trajectoire adaptative qui permet au système de retrouver un état d’équilibre constituerait l’aboutissement de la réponse à la perturbation (trajectoire I). Au contraire, si la réponse persiste dans le temps, le réseau ne retrouve pas un état d’équilibre, le système peut finir par entrer dans une trajectoire mal-adaptative (trajectoire II). De même, une trajectoire mal-adaptative qui se maintient dans le temps peut engendrer des altérations fonctionnelles et structurelles de plus en plus sévères (trajectoire IV). Figure une dernière trajectoire possible et essentielle d’un point de vue thérapeutique, celle de la réincorporation dans une trajectoire adaptative alors que le système était « engagé » dans une trajectoire mal-adaptative (trajectoire III). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


