| Numéro |
Biologie Aujourd'hui
Volume 212, Numéro 3-4, 2018
|
|
|---|---|---|
| Page(s) | 69 - 76 | |
| DOI | https://doi.org/10.1051/jbio/2019002 | |
| Publié en ligne | 11 avril 2019 | |
Article
Vaccins anti-cancer : quel avenir dans les stratégies d’immunothérapie anti-cancéreuse ?
Anti-cancer vaccines: What future in anti-cancer immunotherapy strategies?
Inserm U970 PARCC, Université Paris Descartes, Hôpital européen Georges-Pompidou, Service d’immunologie biologique,
20, rue Leblanc,
75015
Paris, France
* Auteur correspondant : eric.tartour@aphp.fr
Reçu :
27
Décembre
2018
Les cellules tumorales peuvent être reconnues par le système immunitaire et notamment par les lymphocytes T (LT)-CD8 cytotoxiques. Cette observation a permis d’envisager le concept d’une vaccination ciblant les molécules associées aux tumeurs. Différents types de vaccins anti-tumoraux ont été développés. Les vaccins préventifs contre le cancer (vaccins anti-papillomavirus oncogéniques, vaccin contre le virus de l’hépatite B) visent à empêcher l’introduction dans l’organisme de virus jouant un rôle dans l’oncogénèse et ont démontré leur efficacité. Au contraire, en cas de tumeur déjà présente dans l’organisme, les vaccins thérapeutiques anti-cancer n’ont eu, jusqu’à ce jour, que peu d’impact sur la prise en charge des patients. Néanmoins, ces vaccins connaissent un regain d’intérêt, car de nouvelles cibles antigéniques sont apparues et ont été incorporées dans le design des vaccins, tels que les antigènes mutés ou les molécules associées au stroma du microenvironnement tumoral. De nouveaux critères d’efficacité des vaccins ont été identifiés, comme la nécessité d’induire des lymphocytes T résidents intratumoraux, pouvant conduire au développement d’une vaccination muqueuse (voie nasale, voie orale…) pour les amplifier. Enfin, en raison de l’immunosuppression du microenvironnement tumoral et de l’expression de récepteurs inhibiteurs sur les LT-CD8 dans la tumeur, différentes stratégies d’association thérapeutique entre les vaccins anti-cancer et des molécules levant ces phénomènes d’inhibition sont en cours de développement sur le plan clinique.
Abstract
Tumor cells can be recognized by the immune system and in particular by cytotoxic CD8+T cells. From this observation was derived the concept that vaccination targeting these tumor-associated molecules was feasible. Preventive cancer vaccines targeting oncogenic papillomavirus or hepatitis B virus do exist and are efficient. They aim at preventing the introduction into the body of viruses that play a role in oncogenesis. To date, in the case of an already grown cancer, the anti-tumor vaccines have had no impact on the care of patients. These vaccines are gaining renewed interest, as new antigenic targets have emerged and have been incorporated into the design of vaccines, such as mutated antigens which appeared to be more immunogenic. Less editing cells than tumor cells in the tumor microenvironment, such as protumor endothelial cells or fibroblasts, could also be eliminated by cancer vaccines. New vaccine efficacy criteria have been identified, such as the need to induce intratumoral resident T lymphocytes thanks to the development of mucosal vaccination to amplify them. Finally, because of the immunosuppression of the tumor microenvironment and the expression of inhibitory receptors on CD8+T cells in the tumor, various therapeutic association strategies between the anti-cancer vaccines and molecules supporting these inhibitions are currently used in clinical development. Especially, the efficacy of antibodies against costimulatory inhibitory molecules (PD-1, PD-L1…) relies on the presence of pre-existing CD8+T cells occurring in 25–30% of cancer patients. For the 70% resistant patients, cancer vaccine may reprogram this tumor environment via the induction of intratumoral CD8+T cells which will very likely counteract this resistance to anti-PD-1/PD-L1 antibodies.
Mots clés : vaccin anti-tumoral / antigène muté / lymphocytes T-CD8 résidents mémoires / immunosuppression / prévention des cancers associés aux virus
Key words: cancer vaccine / mutated antigen / resident memory CD8+T cells / immunosuppression / cancer preventative vaccine
© Société de Biologie, 2019
Introduction
La vaccination est considérée comme une approche préventive des maladies infectieuses, reposant essentiellement sur l’induction d’anticorps protecteurs contre différents pathogènes. Dans ce contexte, 10 à 15 % des cancers sont associés à des virus ou des bactéries oncogènes (EBV, HTLV1, HHV8, Helicobacter pylori…) contre lesquels existent parfois des vaccins dirigés notamment contre les papillomavirus (HPV) oncogéniques et le virus de l’hépatite B (HBV).
Les cancers liés aux papillomavirus comme le cancer du col de l’utérus, le cancer de l’oropharynx, le cancer de l’anus et celui du vagin sont responsables de 800 000 décès dans le monde. Il existe pourtant deux vaccins, l’un, Gardasil 9® contre 9 sérotypes représentant plus de 90 % des HPV les plus oncogéniques, l’autre le Cervarix® contre les 2 sérotypes (HPV16 et 18) les plus fréquents. Ces vaccins ont démontré leur efficacité chez des patientes non encore infectées par le virus HPV et sont donc particulièrement indiqués chez des adolescentes et adolescents avant l’âge de 14 ans (Arbyn et al., 2018). En effet, les premières infections se situent à l’âge des premiers rapports sexuels. Des études scandinaves et australiennes ont déjà rapporté une diminution significative des lésions pré-néoplasiques chez les adolescentes vaccinées. En France, moins de 20 % de la population cible est vaccinée, ce qui représente l’un des taux de couverture vaccinale les plus bas d’Europe.
De même, en France, il existe 9000 cas par an de cancer du foie dont un tiers pourrait être prévenu par le vaccin contre l’hépatite B. Le taux de couverture vaccinale chez l’enfant s’est bien amélioré pour ce vaccin et est passé à plus de 90 %.
Ces deux vaccins prophylactiques ne sont efficaces que chez des patients non encore infectés par le virus, car les anticorps induits à la suite de la vaccination empêcheront l’entrée du virus dans les cellules, mais pas l’élimination des cellules déjà infectées (Stanley, 2017).
Au début des années 1990, avec la découverte de molécules exprimées par les cellules tumorales (antigènes tumoraux) et reconnues par le système immunitaire, se sont développés des vaccins pour inhiber la croissance de cancers associés ou non à des virus et déjà établis chez les patients. Dans ces derniers cas, on parle de vaccins thérapeutiques, car ciblant des tumeurs déjà présentes chez l’homme.
Contrairement aux vaccins prophylactiques, l’efficacité de ces vaccins est supposée reposer sur l’induction de lymphocytes T-CD8 cytotoxiques, obligeant donc à des stratégies d’immunisation et à un design des vaccins différent de celui des vaccins prophylactiques. Il est intéressant de noter que le premier vaccin contre la rage fut inoculé avec succès en 1885 par Louis Pasteur à un enfant déjà mordu par un chien enragé. Il s’agissait donc du premier vaccin thérapeutique.
Contrastant avec le succès des vaccinations prophylactiques contre des virus associés aux cancers, les vaccins thérapeutiques anti-cancer sont encore dans la majorité des cas en phase expérimentale. L’objet de cette revue sera d’exposer les pistes d’amélioration de tels vaccins et leur place dans l’arsenal thérapeutique de l’immunothérapie anti-cancer (Figure 1).
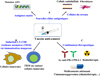 |
Figure 1 Optimisation des vaccins thérapeutiques en cancérologie. A : les vaccins anti-cancer peuvent viser de nouvelles cibles antigéniques, telles que les antigènes mutés, qui sont apparues comme plus immunogéniques, car non soumises au processus de tolérisation contre les antigènes du soi. B : des cellules pro-tumorales du microenvironnement tumoral (cellules endothéliales, fibroblastes…) peuvent également être éliminées par des vaccins. Différents travaux ont montré que les lymphocytes T résidents mémoires intratumoraux jouaient un rôle important dans l’efficacité des vaccins thérapeutiques. Ces lymphocytes sont mieux induits par une immunisation locale mucosale. C : en raison de la paralysie fonctionnelle des LT-CD8 qui expriment PD-1 dans le microenvironnement tumoral, des combinaisons thérapeutiques de vaccins avec des anticorps anti-PD-1/PD-L1 sont en cours d’évaluation. D’autres mécanismes immunosuppresseurs peuvent être inhibés par des molécules spécifiques (blocage LT régulateur, MDSC) ou par des traitements conventionnels (chimiothérapie, radiothérapie…). |
Efficacité clinique limitée des vaccins anti-tumoraux
À ce jour, le seul vaccin thérapeutique anti-cancer ayant démontré son efficacité dans des essais de phase 3 est le vaccin Provenge® (sipuleucel) reposant sur l’administration de cellules mononucléées autologues du patient sensibilisées avec une protéine recombinante dérivée de la phosphatase acide prostatique et couplée au GM-CSF (Granulocyte Macrophage Colony Stimulating Factor, un adjuvant favorisant la différenciation et le recrutement de cellules dendritiques). Ce vaccin a reçu une autorisation de mise sur le marché par la FDA chez des patients atteints de cancer de la prostate métastatique résistant à la castration, mais asymptomatique ou avec une faible charge tumorale ; il augmente la durée de vie des patients de quatre mois (Kantoff et al., 2010). Néanmoins, la difficulté de sa production, qui repose sur une thérapie cellulaire, son caractère autologue nécessitant un vaccin propre à chaque patient, son bénéfice limité sur la survie (4 mois) et son coût élevé (90 000 $) n’ont pas permis son développement sur le plan clinique.
En dehors du sipuleucel, seuls des produits en essais de phase 2 ont montré une certaine efficacité, mais encore, dans la majorité des cas, pour le traitement de lésions pré-néoplasiques ou de cancers à des stades peu avancés. Ainsi, chez des patientes atteintes de lésions pré-néoplasiques de la vulve ou du col de l’utérus associées aux papillomavirus de type 16, deux vaccins, l’un reposant sur de longs peptides et l’autre sur de l’ADN codant les protéines virales E6 et E7, ont montré une efficacité clinique en termes de régression de lésions ou d’élimination du virus (Kenter et al., 2009 ; Trimble et al., 2015). Il est intéressant de noter que l’application de ces mêmes vaccins chez des patientes atteintes de cancers du col de l’utérus associés à HPV16 s’est révélée inefficace. Plus récemment, le groupe de Czerniecki a montré, dans un essai néoadjuvant chez des patientes atteintes de cancer du sein positif pour Her2/neu, que l’administration de cellules dendritiques sensibilisées avec un peptide dérivé d’Her2/neu entraînait une régression des lésions en cas de carcinome in situ mais pas au stade de cancer invasif (Lowenfeld et al., 2017). Enfin, dans un essai de phase 2b en phase adjuvante chez des patientes atteintes de cancer du sein exprimant Her2, un vaccin reposant sur un peptide dérivé d’Her2/neu (vaccin « neuvax ») a permis de réduire le risque de récidive chez ces patientes par comparaison avec un groupe placébo (Hale et al., 2018).
Il apparaît donc que les quelques succès cliniques des vaccins thérapeutiques en monothérapie s’adressent à des patients portant des lésions pré-cancéreuses ou une faible charge tumorale. Or la majorité des essais cliniques ont été développés chez des patients atteints de cancers métastatiques évolués, ce qui peut justifier en partie les nombreux échecs observés lors d’essais de phase 3. L’une des hypothèses pouvant expliquer cette observation est que, lors de l’évolution du cancer, les phénomènes d’immunosuppression s’accentuent et favorisent la résistance à l’immunostimulation. Dans ces indications de cancers à des stades avancés, les vaccins anti-cancer ne devraient plus être administrés en monothérapie mais évalués en combinaison avec des molécules capables d’inhiber les phénomènes d’immunosuppression.
Rôle des LT-CD8 dans l’efficacité des vaccins anti-cancer
Considérations générales
Les lymphocytes T-CD8 possèdent des granules renfermant des molécules cytotoxiques (perforine, granzyme…) ainsi que des molécules membranaires (FasL, Trail, R-TNF…) favorisant la lyse des cellules tumorales.
Ainsi, il n’était pas surprenant d’observer dans les modèles précliniques de cancer une corrélation entre la capacité d’induire des LT-CD8 après vaccination thérapeutique et l’efficacité de ces vaccins. L’élimination de ces LT-CD8 entraîne dans la majorité des cas l’abolition de l’effet thérapeutique du vaccin (Tran et al., 2018). Chez l’homme, le seul vaccin (Provenge®) ayant démontré une efficacité thérapeutique provoque une infiltration des tumeurs par des LT-CD8 ainsi qu’une augmentation de ces LT-CD8 dans le sang, dont le taux corrèle avec la survie des patients (Antonarakis et al., 2018). De façon générale, il existe un lien chez l’homme entre l’induction de LT-CD8 et la réponse clinique aux vaccins, même si la présence de LT-CD8 anti-tumoraux ne semble pas toujours suffisante pour observer une réponse thérapeutique (Tran et al., 2018).
Une réponse clinique aux vaccins sans LT-CD8 a été observée chez l’homme et peut s’expliquer par l’implication d’autres effecteurs dans l’effet du vaccin (LT-CD4, anticorps…) et par l’induction de LT-CD8 non dirigés contre l’antigène présent dans le vaccin. Ce dernier phénomène, appelé epitope spreading, correspond vraisemblablement à une lyse de la tumeur par les LT-CD8 spécifiques de l’antigène vaccinal mais présents en faible concentration, effet suivi d’une amplification de la réponse LT-CD8 dirigée contre des antigènes libérés lors de la lyse tumorale. Ce phénomène permettant une extension du répertoire des LT-CD8 anti-tumoraux est souvent associé à une réponse clinique aux vaccins anti-cancer (Corbière et al., 2011).
Suivant ces différents arguments qui documentent le rôle des LT-CD8 dans la réponse anti-tumorale aux vaccins, plusieurs stratégies ont été développées pour induire ces cellules.
Ainsi l’utilisation de peptides, de virus recombinants codant l’ADNc d’un antigène tumoral, de cellules dendritiques sensibilisées avec un antigène tumoral ou une vaccination avec l’ARN ou de l’ADN codant un antigène tumoral, constituent des stratégies qui se sont montrées très efficaces dans des modèles murins pour induire ces LT-CD8. Chez l’homme, elles sont capables de générer ces cellules, mais à des taux faibles, moins de 1/10−4 LT-CD8 spécifiques parmi les LT-CD8 totaux (Blanc et al., 2017). Ainsi, la vaccination par des longs peptides ou par de l’ARN lipoplexé ne permet d’induire des LT-CD8 spécifiques d’antigènes tumoraux ex vivo (sans technique d’amplification in vitro de la réponse) que chez moins de 20 % des patients (Ott et al., 2017 ; Sahin et al., 2017). Cette difficulté à produire après vaccination les LT-CD8 pourrait résulter d’une immunosuppression au cours des cancers et de l’utilisation d’antigènes associés aux tumeurs souvent exprimés également par des cellules normales et entraînent alors des phénomènes de tolérance contre cet antigène. Afin d’améliorer la réponse lymphocytaire après vaccination, différents groupes essaient de mieux guider les antigènes associés aux tumeurs vers les cellules dendritiques par des vecteurs qui les ciblent. La sélection d’antigènes tumoraux dérivés d’antigènes mutés ou de virus associés aux tumeurs pour lesquels il n’existe pas de tolérance induite dans l’organisme représente une piste prometteuse.
Rôle des LT-CD8 résidents mémoires intratumoraux dans l’efficacité des vaccins anti-cancer
La présence de LT-CD8 dans le sang n’est pas toujours associée à une réponse clinique après vaccination. Notre groupe a montré dans des modèles précliniques que l’induction de LT-CD8 anti-tumoraux dans la tumeur était plus prédictive de l’efficacité de vaccins que la présence de LT-CD8 dans le sang (Nizard et al., 2017). Ces LT-CD8 présents dans la tumeur ont un phénotype particulier et représentent une nouvelle population de LT-CD8 appelée « lymphocytes T résidents mémoires » définis par les marqueurs CD103, CD49a et CD69. Ces LT-CD8 ne recirculent pas et sont localisés au contact de la tumeur. Ils peuvent persister assez longtemps et joueraient donc un rôle dans l’immunosurveillance anti-tumorale (Mami-Chouaib et al., 2018). Ils sont préférentiellement induits par une vaccination locale muqueuse (intranasale, intravaginale, orale…) plutôt que par voie systémique (intramusculaire, sous-cutanée) (Nizard et al., 2016). Nous avons montré, dans des modèles de tumeurs orthotopiques de la sphère ORL ou du poumon, qu’une vaccination thérapeutique par voie nasale était plus efficace pour induire ces lymphocytes et éliminer les tumeurs qu’une vaccination par voie intramusculaire (Nizard et al., 2017). Les LT-CD8 résidents mémoires jouent un rôle clé dans le mécanisme d’action des vaccins thérapeutiques anti-cancer. Le rôle de ces cellules a été également démontré dans des modèles précliniques de cancers du col de l’utérus (Sun et al., 2016) ou de mélanomes (Enamorado et al., 2017 ; Galvez-Cancino et al., 2018). Ces travaux ouvrent la voie à une évaluation des voies muqueuses d’administration des vaccins thérapeutiques pour l’induction de ces cellules et la potentialisation de leur effet.
Nouvelles cibles des vaccins anti-tumoraux
Antigènes mutés
Avec l’avènement de techniques NGS (Next-Generation Sequencing) de séquençage de gènes, une cartographie des mutations présentes dans une tumeur a permis d’identifier des peptides mutés immunogéniques dans différents cancers. Les tumeurs les plus mutées (cancer du poumon lié au tabac, mélanome lié aux UV, cancer avec instabilité microsatellite et défaut de réparation de l’ADN, cancer de la vessie secondaire à des carcinogènes chimiques…) sont considérées comme des tumeurs très immunogéniques. En effet, les peptides mutés dérivant de molécules mutées ne font pas l’objet d’une tolérisation au niveau du thymus ou par des mécanismes de tolérance périphérique et sont mieux reconnus par les LT-CD8 que des peptides du soi. On distingue classiquement des mutations dans des gènes « driver » (ex : R-EGF, Ras, Braf…) participant à l’oncogenèse et des mutations « passenger » sur des gènes non indispensables à la survie de la cellule tumorale. Jusqu’à récemment, les peptides dérivés de mutations dans des gènes « driver » étaient privilégiés dans la sélection des antigènes à inclure dans les vaccins anti-cancer, car leur rôle indispensable dans la survie de la tumeur devrait contraindre la tumeur à ne pas diminuer leur expression pour échapper à la pression immunitaire. Néanmoins, une étude récente a montré que les peptides mutés dérivés des molécules « driver » étaient faiblement présentés par les molécules de CMH de classe I des patients, favorisant vraisemblablement l’émergence de clones tumoraux peu exposés au système immunitaire (Marty et al., 2017). D’après ces différents travaux, les antigènes mutés à privilégier dans le design des vaccins devraient inclure des mutations « passenger » clonales plutôt que sous-clonales, évitant la sélection rapide de variants qui n’expriment pas les antigènes mutés (McGranahan et al., 2016). En pratique, à partir du profil mutationnel des tumeurs, des algorithmes sont générés pour identifier des peptides CD8 potentiellement immunogéniques en tenant compte de l’expression des transcrits de ces gènes, de leur liaison aux molécules HLA, de leur capacité à être dégradés par le protéasome et d’être transportés par les molécules TAP (Transporter associated antigen protein) dans le réticulum endoplasmique pour ensuite s’associer aux molécules HLA de classe I. Dans de rares cas, leur expression par les cellules tumorales sous forme d’un complexe HLA-peptide muté a pu être mise en évidence après élution de ces peptides et caractérisation par spectrométrie de masse (Guo et al., 2018).
Chez la souris, ces peptides mutés se sont avérés très immunogéniques et capables d’éliminer des tumeurs de stade bien avancé (Yadav et al., 2014). Chez l’Homme, différents groupes ont montré que des vaccins thérapeutiques reposant sur des cellules dendritiques sensibilisées avec des peptides mutés, des longs peptides mutés ou de l’ARN lipoplex codant des peptides mutés peuvent induire des LT-CD8 contre ces antigènes mutés, même si leur fréquence reste faible (Carreno et al., 2015 ; Ott et al., 2017 ; Sahin et al., 2017). Quelques réponses cliniques ont été rapportées après vaccination des patients avec ces antigènes mutés.
L’une des limites de ces vaccins est qu’il reste difficile de prédire quels seront les peptides mutés immunogéniques à partir du profil mutationnel NGS. Même si quelques séquences publiques de mutations ont été retrouvées chez plusieurs patients, celles-ci restent rares et les mutations de forte fréquence génèrent des peptides qui se lient mal aux molécules HLA (Marty et al., 2017 ; Klebanoff et Wolchok, 2018). Ce sont donc des vaccins très personnalisés et propres à chaque individu.
Chez la souris, 1 à 2 % des mutations identifiées sont capables d’induire des LT-CD8. À l’aide de techniques de spectrométrie de masse et d’élution de peptides à la surface de cellules tumorales humaines, il n’a été observé qu’un nombre faible (1 à 3) de peptides mutés présentés à la surface de la cellule tumorale (Bassani-Sternberg et al., 2016). D’autres travaux récents rapportent que la majorité des peptides présentés à la surface des cellules tumorales dérive de mutations ou d’expression de protéines issues de séquences introniques ou de sites cryptiques de transcription de séquences exoniques (Laumont et al., 2018). Dans tous les cas, les stratégies conventionnelles de séquençage d’exome n’auraient pas permis d’identifier ces peptides dérivés de séquences le plus souvent introniques, pourtant immunogéniques chez la souris.
Antigènes ciblant le stroma ou la vascularisation
En raison de l’instabilité antigénique des cellules tumorales, d’autres molécules ciblant des cellules non tumorales du microenvironnement tumoral mais protumorales sont sélectionnées comme antigènes dans des vaccins anti-cancer. Ainsi des vaccins contre la molécule FAP (Fibroblast Activation Protein) exprimée par les fibroblastes (Busek et al., 2018) ou contre le VEGF exprimé par les cellules endothéliales (Morera et al., 2017) ont montré une certaine efficacité dans des modèles précliniques.
Corinne Tanchot, dans notre équipe, a rapporté qu’un vaccin composé de longs peptides dérivés de la survivine, une molécule anti-apoptotique exprimée par les cellules tumorales et les cellules endothéliales, induisait des réponses LT-CD8 spécifiques et une régression de tumeurs établies chez la souris (Onodi et al., 2018).
Nouvelles indications et combinaisons thérapeutiques
Association des vaccins anti-tumoraux avec des anticorps ciblant les « checkpoint inhibitors »
Les molécules de co-stimulation inhibitrice PD-1 et CTLA-4 sont les cibles d’anticorps bloquant leur liaison avec leurs ligands, respectivement PD-L1/PD-L2 et CD80-CD86. La levée de ces freins sur les LT-CD8 dans le microenvironnement tumoral permet à ces cellules de s’activer et de proliférer car les cellules tumorales sont alors reconnues, ce qui conduit à leur lyse. Ces traitements, notamment ceux bloquant l’axe PD-1/PD-L1, constituent une nouvelle classe thérapeutique en cancérologie et ont démontré une efficacité thérapeutique chez 20 à 30 % des patients atteints de cancers métastatiques. Les tumeurs les plus sensibles à ces traitements correspondent aux tumeurs les plus mutées (mélanome, cancer du poumon non à petites cellules, cancer du colon MSI, cancer de la vessie…) avec quelques exceptions (tumeurs associées aux virus, tumeur du rein, maladie de Hodgkin…). Il a été montré que la présence de LT-CD8 avant traitement dans le microenvironnement tumoral constituait un biomarqueur prédictif de réponse clinique, suggérant que ces anticorps anti-PD-1/PD-L1 amplifient une réponse LT-CD8 anti-tumorale naturelle mais n’induisent pas une réponse de novo. La réponse LT-CD8 spontanée chez les patients atteints de cancers est estimée à 30 % de cette population (Granier et al., 2017). Pour les 70 % de patients ne présentant pas une tumeur bien infiltrée en LT-CD8, l’objectif est d’induire d’abord une réponse LT-CD8 anti-tumorale avant l’administration de ces anticorps anti-PD-1/PD-L1. Dans un modèle préclinique murin de tumeurs exprimant les protéines virales E6 et E7 d’HPV et PD-L1 et ne présentant pas une réponse LT-CD8 spontanée, notre équipe a montré que l’administration d’anticorps anti-PD-L1 était inefficace. Par contre, une vaccination thérapeutique ciblant la protéine E7 d’HPV permettant d’induire des LT-CD8 anti-tumoraux dans le microenvironnement tumoral, suivie de l’administration d’un anticorps anti-PD-L1, provoque la régression complète des tumeurs (Badoual et al., 2013). Cette validation de concept de l’intérêt de la réponse LT-CD8 naturelle ou induite après vaccination a ouvert la voie à de très nombreux essais cliniques associant des vaccins thérapeutiques à des anticorps anti-PD1/PD-L1 ou anti-CTLA4.
Chez l’Homme, un vaccin thérapeutique ciblant les protéines E6-E7 d’HPV associé à un anticorps anti-PD-1 chez des patients atteints de cancer des voies aérodigestives supérieures associés à HPV a entraîné un bénéfice clinique chez 33 % des patients. Dans les séries historiques d’administration d’anticorps anti-PD-1 en monothérapie chez ce même groupe de patients, les réponses cliniques observées se situaient dans un intervalle compris entre 16 et 22 % (Massarelli et al., 2018). Par ailleurs, dans deux études récentes, des réponses cliniques ont été observées chez des patients atteints de mélanome et traités avec des vaccins ciblant des antigènes mutés. Lors d’une récidive de la maladie, l’administration d’un anticorps anti-PD-1 a permis la régression des lésions, soulignant l’intérêt de l’association des vaccins thérapeutiques avec des anticorps anti-PD-1/PD-L1 (Ott et al., 2017 ; Sahin et al., 2017).
Association de vaccins thérapeutiques avec des molécules atténuant l’immunosuppression du microenvironnement tumoral
Comme mentionné précédemment, le microenvironnement tumoral renferme de nombreuses cellules (LT régulateurs, cellules myéloïdes suppressives (MDSC), macrophages de type M2…) et de molécules (TGFα, IDO [Indoleamine 2,3-DiOxygénase], IL-10, adénosine, VEGF…) immunosuppressives. Cet environnement immunosuppresseur inhibe la réponse lymphocytaire T-CD8 induite par les vaccins thérapeutiques. Dans des modèles murins, une synergie a été montrée lors de la combinaison de vaccins thérapeutiques avec des molécules inhibant les LT régulateurs, les MDSC, IDO, le VEGF ou le TGFα (Terabe et al., 2009 ; Takaku et al., 2010 ; Figlin, 2014 ; Draghiciu et al., 2015 ; Liu et al., 2018 ; Moreno et al., 2018).
Les traitements conventionnels du cancer tels que la chimiothérapie ou la radiothérapie montrent également une synergie avec certains vaccins anti-cancer. Ainsi, l’association de carboplatine et de Taxol élimine partiellement les MDSC et a amélioré l’efficacité d’un vaccin thérapeutique anti-HPV chez des patientes atteintes de cancer du col de l’utérus (Welters et al., 2016). De faibles doses de cyclophosphamide inhibent les LT régulateurs et améliorent l’efficacité de vaccins anti-tumoraux (Klein et al., 2015 ; Tanyi et al., 2018).
De même, la radiothérapie peut augmenter l’efficacité de vaccins anti-cancer par différents mécanismes (Gatti-Mays et al., 2017). Nous avons montré que la radiothérapie à faible dose permet une normalisation vasculaire qui favorise l’infiltration des LT-CD8 intratumoraux induits par la vaccination et la réponse clinique aux vaccins (Mondini et al., 2015).
Conclusions et perspectives
La vaccination thérapeutique est une modalité d’immunothérapie à un stade moins avancé sur le plan clinique que les autres stratégies d’immunothérapie comme les anticorps ciblant l’axe PD-1/PD-L1 ou l’administration de lymphocytes T modifiés (Chimeric antigen receptors T cells, CAR). Néanmoins, ces derniers traitements, en validant le concept d’une stimulation du système immunitaire pouvant combattre le cancer, ont entraîné un regain d’intérêt pour les vaccins anti-cancer. Une meilleure compréhension des mécanismes d’échappement à ces vaccins, notamment l’immunosuppression associée au microenvironnement tumoral et le ciblage d’un nouveau type d’antigènes, a conduit au développement de nombreux essais cliniques tenant compte de cette interaction particulière entre la tumeur et l’hôte.
Références
- Antonarakis, E.S., Small, E.J., Petrylak, D.P., Quinn, D.I., Kibel, A.S., Chang, N.N., Dearstyne, E., Harmon, M., Campogan, D., Haynes, H., Vu T., Sheikh N.A., Drake C.G. (2018). Antigen-Specific CD8 lytic phenotype induced by Sipuleucel-T in hormone-sensitive or castration-resistant prostate cancer and association with overall survival. Clin Cancer Res , 24, 4662–4671. [CrossRef] [PubMed] [Google Scholar]
- Arbyn, M., Xu, L., Simoens, C., Martin-Hirsch, P.P. (2018). Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors. Cochrane Database Syst Rev , 5, CD009069. [PubMed] [Google Scholar]
- Badoual, C., Hans, S., Merillon, N., Van Ryswick, C., Ravel, P., Benhamouda, N., Levionnois, E., Nizard, M., Si-Mohamed, A., Besnier, N., Gey A., Rotem-Yehudar R., Péré H., Tran T., Guérin C.L., Chauvat A., Dransart E., Alanio C., Albert S., Barry B., Sandoval F., Quintin-Colonna F., Bruneval P., Fridman W.H., Lemoine F.M, Oudard S., Johannes L., Olive D., Brasnu D., Tartour E. (2013). PD-1-expressing tumor-infiltrating T cells are a favorable prognostic biomarker in HPV-associated head and neck cancer. Cancer Res , 73, 128–138. [Google Scholar]
- Bassani-Sternberg, M., Braunlein, E., Klar, R., Engleitner, T., Sinitcyn, P., Audehm, S., Straub, M., Weber, J., Slotta-Huspenina, J., Specht, K., Martignoni M.E., Werner A., Hein R.H., Busch D., Peschel C., Rad R., Cox J., Mann M., Krackhardt A.M. (2016). Direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by mass spectrometry. Nat Commun, 7, 13404. [CrossRef] [PubMed] [Google Scholar]
- Blanc, C., Granier, C., Tartour, E. (2017). Vaccination antitumorale. Innovations Ther Oncol , 3, 149–157. [Google Scholar]
- Busek, P., Mateu, R., Zubal, M., Kotackova, L., Sedo, A. (2018). Targeting fibroblast activation protein in cancer − Prospects and caveats. Front Biosci (Landmark Ed) , 23, 1933–1968. [Google Scholar]
- Carreno, B.M., Magrini, V., Becker-Hapak, M., Kaabinejadian, S., Hundal, J., Petti, A.A., Ly, A., Lie, W.R., Hildebrand, W.H., Mardis, E.R., Linette G.P. (2015). Cancer immunotherapy. A dendritic cell vaccine increases the breadth and diversity of melanoma neoantigen-specific T cells. Science , 348, 803–808. [Google Scholar]
- Corbière, V., Chapiro, J., Stroobant, V., Ma, W., Lurquin, C., Lethe, B., van Baren, N., Van den Eynde, B.J., Boon, T., Coulie, P.G. (2011). Antigen spreading contributes to MAGE vaccination-induced regression of melanoma metastases. Cancer Res, 71, 1253-1262. [Google Scholar]
- Draghiciu, O., Nijman, H.W., Hoogeboom, B.N., Meijerhof, T., Daemen, T. (2015). Sunitinib depletes myeloid-derived suppressor cells and synergizes with a cancer vaccine to enhance antigen-specific immune responses and tumor eradication. Oncoimmunology , 4, e989764. [CrossRef] [PubMed] [Google Scholar]
- Enamorado, M., Iborra, S., Priego, E., Cueto, F.J., Quintana, J.A., Martinez-Cano, S., Mejias-Perez, E., Esteban, M., Melero, I., Hidalgo, A., Sancho D. (2017). Enhanced anti-tumour immunity requires the interplay between resident and circulating memory CD8(+) T cells. Nat Commun , 8, 16073. [CrossRef] [PubMed] [Google Scholar]
- Figlin, R.A. (2014). A novel personalized vaccine approach in combination with targeted therapy in advanced renal cell carcinoma. Immunotherapy , 6, 261–268. [CrossRef] [PubMed] [Google Scholar]
- Galvez-Cancino, F., Lopez, E., Menares, E., Diaz, X., Flores, C., Caceres, P., Hidalgo, S., Chovar, O., Alcantara-Hernandez, M., Borgna, V., Varas-Godoy M., Salazar-Onfray F., Idoyaga J., Lladser A. (2018). Vaccination-induced skin-resident memory CD8(+) T cells mediate strong protection against cutaneous melanoma. Oncoimmunology , 7, e1442163. [CrossRef] [PubMed] [Google Scholar]
- Gatti-Mays, M.E., Redman, J.M., Collins, J.M., Bilusic, M. (2017). Cancer vaccines: Enhanced immunogenic modulation through therapeutic combinations. Hum Vaccin Immunother , 13, 2561–2574. [Google Scholar]
- Granier, C., De Guillebon, E., Blanc, C., Roussel, H., Badoual, C., Colin, E., Saldmann, A., Gey, A., Oudard, S., Tartour, E. (2017). Mechanisms of action and rationale for the use of checkpoint inhibitors in cancer. ESMO open, 2, e000213. [CrossRef] [PubMed] [Google Scholar]
- Guo, Y., Lei, K., Tang, L. (2018). Neoantigen vaccine delivery for personalized anticancer immunotherapy. Front Immunol , 9, 1499. [CrossRef] [PubMed] [Google Scholar]
- Hale, D., Mittendorf, E., Brown, T., Clifton, G., Vreeland, T.J., Myers, J., Peace, K., Jackson, D., Greene, J., Holmes, J.P., Peoples, G.E. (2018). Pre-specified interim analysis of a randomized phase 2b trial of trastuzumab + nelipeptimut-S (NeuVax) vs trastuzumab for the prevention of recurrence. Ann Oncol, 29, vii400–viii441. [CrossRef] [Google Scholar]
- Kantoff, P.W., Higano, C.S., Shore, N.D., Berger, E.R., Small, E.J., Penson, D.F., Redfern, C.H., Ferrari, A.C., Dreicer, R., Sims, R.B., Xu Y., Frohlich M.W., Schellhammer P.F.; IMPACT Study Investigators. (2010). Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med, 363, 411–422. [CrossRef] [PubMed] [Google Scholar]
- Kenter, G.G., Welters, M.J., Valentijn, A.R., Lowik, M.J., Berends-van der Meer, D.M., Vloon, A.P., Essahsah, F., Fathers, L.M., Offringa, R., Drijfhout, J.W., Wafelman A.R., Oostendorp J., Fleuren G.J., van der Burg S.H., Melief C.J. (2009). Vaccination against HPV-16 oncoproteins for vulvar intraepithelial neoplasia. N Engl J Med , 361, 1838-1847. [CrossRef] [PubMed] [Google Scholar]
- Klebanoff, C.A., Wolchok, J.D. (2018). Shared cancer neoantigens: making private matters public. J Exp Med , 215, 5–7. [CrossRef] [PubMed] [Google Scholar]
- Klein, O., Davis, I.D., McArthur, G.A., Chen, L., Haydon, A., Parente, P., Dimopoulos, N., Jackson, H., Xiao, K., Maraskovsky, E., Hopkins W., Stan R., Chen W., Cebon J. (2015). Low-dose cyclophosphamide enhances antigen-specific CD4(+) T cell responses to NY-ESO-1/ISCOMATRIX vaccine in patients with advanced melanoma. Cancer Immunol Immunother , 64, 507–518. [CrossRef] [PubMed] [Google Scholar]
- Laumont, C.M., Vincent, K., Hesnard, L., Audemard, E., Bonneil, E., Laverdure, J.P., Gendron, P., Courcelles, M., Hardy, M.P., Côté, C., Durette C., St-Pierre C., Benhammadi M., Lanoix J., Vobecky S., Haddad E., Lemieux S., Thibault P., Perreault C. (2018). Noncoding regions are the main source of targetable tumor-specific antigens. Sci Transl Med , 10, pii: eaau 5516. [Google Scholar]
- Liu, D.Q., Lu, S., Zhang, L.X., Ji, M., Liu, S.Y., Wang, S.W., Liu, R.T. (2018). An indoleamine 2, 3-dioxygenase siRNA nanoparticle-coated and Trp2-displayed recombinant yeast vaccine inhibits melanoma tumor growth in mice. J Control Release , 273, 1–12. [CrossRef] [PubMed] [Google Scholar]
- Lowenfeld, L., Mick, R., Datta, J., Xu, S., Fitzpatrick, E., Fisher, C.S., Fox, K.R., DeMichele, A., Zhang, P.J., Weinstein, S.P., Roses R.E., Czerniecki B.J. (2017). Dendritic cell vaccination enhances immune responses and induces regression of HER2(pos) DCIS independent of route: results of randomized selection design trial. Clin Cancer Res , 23, 2961–2971. [CrossRef] [PubMed] [Google Scholar]
- Mami-Chouaib, F., Blanc, C., Corgnac, S., Hans, S., Malenica, I., Granier, C., Tihy, I., Tartour, E. (2018). Resident memory T cells, critical components in tumor immunology. J Immunother Cancer , 6, 87. [CrossRef] [Google Scholar]
- Marty, R., Kaabinejadian, S., Rossell, D., Slifker, M.J., van de Haar, J., Engin, H.B., de Prisco, N., Ideker, T., Hildebrand, W.H., Font-Burgada, J., Carter, H. (2017). MHC-I genotype restricts the oncogenic mutational landscape. Cell, 171, 1272–1283 e1215. [CrossRef] [PubMed] [Google Scholar]
- Massarelli, E., William, W., Johnson, F., Kies, M., Ferrarotto, R., Guo, M., Feng, L., Lee, J.J., Tran, H., Kim, Y.U., Haymaker C., Bernatchez C., Curran M., Zecchini Barrese T., Rodriguez Canales J., Wistuba I., Li L., Wang J., van der Burg S.H., Melief C.J., Glisson B. (2018). Combining immune checkpoint blockade and tumor-specific vaccine for patients with incurable human papillomavirus 16-related cancer: a phase 2 Clinical Trial. JAMA Oncol, doi: 10.1001/jamaoncol.2018.4051. [Google Scholar]
- McGranahan, N., Furness, A.J., Rosenthal, R., Ramskov, S., Lyngaa, R., Saini, S.K., Jamal-Hanjani, M., Wilson, G.A., Birkbak, N.J., Hiley, C.T., Watkins T.B., Shafi S., Murugaesu N., Mitter R., Akarca A.U., Linares J., Marafioti T., Henry J.Y., Van Allen E.M., Miao D., Schilling B., Schadendorf D., Garraway L.A., Makarov V., Rizvi N.A., Snyder A., Hellmann M.D., Merghoub T., Wolchok J.D., Shukla S.A., Wu C.J., Peggs K.S., Chan T.A., Hadrup S.R., Quezada S.A., Swanton C. (2016). Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade. Science , 351, 1463–1469. [CrossRef] [PubMed] [Google Scholar]
- Mondini, M., Nizard, M., Tran, T., Mauge, L., Loi, M., Clemenson, C., Dugue, D., Maroun, P., Louvet, E., Adam, J., Badoual C., Johannes L., Vozenin M.C., Perfettini J.L., Tartour E., Deutsch E. (2015). Synergy of radiotherapy and a cancer vaccine for the treatment of HPV-associated head and neck cancer. Mol Cancer Ther , 14, 1336–1345. [CrossRef] [Google Scholar]
- Moreno, A.C.R., Porchia, B., Pagni, R.L., Souza, P.D.C., Pegoraro, R., Rodrigues, K.B., Barros, T.B., Aps, L., de Araujo, E.F., Calich, V.L.G., Ferreira, L.C.S. (2018). The combined use of melatonin and an indoleamine 2,3-dioxygenase-1 inhibitor enhances vaccine-induced protective cellular immunity to HPV16-associated tumors. Front Immunol , 9, 1914. [CrossRef] [PubMed] [Google Scholar]
- Morera, Y., Sanchez, J., Bequet-Romero, M., Selman-Housein, K.H., de la Torre, A., Hernandez-Bernal, F., Martin, Y., Garabito, A., Pinero, J., Bermudez, C., de la Torre J., Ayala M., Gavilondo J.V. (2017). Specific humoral and cellular immune responses in cancer patients undergoing chronic immunization with a VEGF-based therapeutic vaccine. Vaccine, 35, 3582-3590. [CrossRef] [PubMed] [Google Scholar]
- Nizard, M., Roussel, H., Diniz, M.O., Karaki, S., Tran, T., Voron, T., Dransart, E., Sandoval, F., Riquet, M., Rance, B., Marcheteau E., Fabre E., Mandavit M., Terme M., Blanc C., Escudie J.B., Gibault L., Barthes F.L.P., Granier C., Ferreira L.C.S., Badoual C., Johannes L., Tartour E. (2017). Induction of resident memory T cells enhances the efficacy of cancer vaccine. Nat Commun , 8, 15221. [Google Scholar]
- Nizard, M., Roussel, H., Tartour, E. (2016). Resident memory T cells as surrogate markers of the efficacy of cancer vaccines. Clin Cancer Res , 22, 530–532. [CrossRef] [PubMed] [Google Scholar]
- Onodi, F., Maherzi-Mechalikh, C., Mougel, A., Ben Hamouda, N., Taboas, C., Gueugnon, F., Tran, T., Nozach, H., Marcon, E., Gey, A., Terme M., Bouzidi A., Maillere B., Kerzerho J., Tartour E., Tanchot C. (2018). High therapeutic efficacy of a new survivin LSP-cancer vaccine containing CD4(+) and CD8(+) T-cell epitopes. Front Oncol, 8, 517. [CrossRef] [PubMed] [Google Scholar]
- Ott, P.A., Hu, Z., Keskin, D.B., Shukla, S.A., Sun, J., Bozym, D.J., Zhang, W., Luoma, A., Giobbie-Hurder, A., Peter, L., Chen C., Olive O., Carter T.A., Li S., Lieb D.J., Eisenhaure T., Gjini E., Stevens J., Lane W.J., Javeri I., Nellaiappan K., Salazar A.M., Daley H., Seaman M., Buchbinder E.I., Yoon C.H., Harden M., Lennon N., Gabriel S., Rodig S.J., Barouch D.H., Aster J.C., Getz G., Wucherpfennig K., Neuberg D., Ritz J., Lander E.S., Fritsch E.F., Hacohen N., Wu C.J. (2017). An immunogenic personal neoantigen vaccine for patients with melanoma. Nature , 547, 217–221. [CrossRef] [PubMed] [Google Scholar]
- Sahin, U., Derhovanessian, E., Miller, M., Kloke, B.P., Simon, P., Lower, M., Bukur, V., Tadmor, A.D., Luxemburger, U., Schrors, B., Omokoko T., Vormehr M., Albrecht C., Paruzynski A., Kuhn A.N., Buck J., Heesch S., Schreeb K.H., Müller F., Ortseifer I., Vogler I., Godehardt E., Attig S., Rae R., Breitkreuz A., Tolliver C., Suchan M., Martic G., Hohberger A., Sorn P., Diekmann J., Ciesla J., Waksmann O., Brück A.K., Witt M., Zillgen M., Rothermel A., Kasemann B., Langer D., Bolte S., Diken M., Kreiter S, Nemecek R., Gebhardt C., Grabbe S., Höller C., Utikal J., Huber C., Loquai C., Türeci Ö. (2017). Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature , 547, 222–226. [CrossRef] [PubMed] [Google Scholar]
- Stanley, M. (2017). Tumour virus vaccines: hepatitis B virus and human papillomavirus. Philos Trans R Soc Lond B Biol Sci, 372 (1732), pii: 20160268 [CrossRef] [PubMed] [Google Scholar]
- Sun, Y.Y., Peng, S., Han, L., Qiu, J., Song, L., Tsai, Y., Yang, B., Roden, R.B., Trimble, C.L., Hung, C.F., Wu, T.C. (2016). Local HPV recombinant vaccinia boost following priming with an HPV DNA vaccine enhances local HPV-specific CD8+ T-cell-mediated Tumor control in the genital tract. Clin Cancer Res, 22, 657–669. [CrossRef] [PubMed] [Google Scholar]
- Takaku, S., Terabe, M., Ambrosino, E., Peng, J., Lonning, S., McPherson, J.M., Berzofsky, J.A. (2010). Blockade of TGF-beta enhances tumor vaccine efficacy mediated by CD8(+) T cells. Int J Cancer, 126, 1666–1674. [PubMed] [Google Scholar]
- Tanyi, J.L., Bobisse, S., Ophir, E., Tuyaerts, S., Roberti, A., Genolet, R., Baumgartner, P., Stevenson, B.J., Iseli, C., Dangaj, D., Czerniecki B., Semilietof A., Racle J., Michel A., Xenarios I., Chiang C., Monos D.S., Torigian D.A., Nisenbaum H.L., Michielin O., June C.H., Levine B.L., Powell D.J. Jr, Gfeller D., Mick R., Dafni U., Zoete V., Harari A., Coukos G., Kandalaft L.E. (2018). Personalized cancer vaccine effectively mobilizes antitumor T cell immunity in ovarian cancer. Sci Transl Med, 10 (436), pii: eaao5931. [CrossRef] [PubMed] [Google Scholar]
- Terabe, M., Ambrosino, E., Takaku, S., O’Konek, J.J., Venzon, D., Lonning, S., McPherson, J.M., Berzofsky, J.A. (2009). Synergistic enhancement of CD8+ T cell-mediated tumor vaccine efficacy by an anti-transforming growth factor-beta monoclonal antibody. Clin Cancer Res , 15, 6560–6569. [Google Scholar]
- Tran, T., Blanc, C., Granier, C., Saldmann, A., Tanchot, C., Tartour, E. (2018). Therapeutic cancer vaccine: building the future from lessons of the past. Semin Immunopathol, doi: 10.1007/s00281-018-0691-z. [Google Scholar]
- Trimble, C.L., Morrow, M.P., Kraynyak, K.A., Shen, X., Dallas, M., Yan, J., Edwards, L., Parker, R.L., Denny, L., Giffear, M., Brown A.S., Marcozzi-Pierce K., Shah D., Slager A.M., Sylvester A.J., Khan A., Broderick K.E., Juba R.J., Herring T.A., Boyer J., Lee J., Sardesai N.Y., Weiner D.B., Bagarazzi M.L. (2015). Safety, efficacy, and immunogenicity of VGX-3100, a therapeutic synthetic DNA vaccine targeting human papillomavirus 16 and 18 E6 and E7 proteins for cervical intraepithelial neoplasia 2/3: a randomised, double-blind, placebo-controlled phase 2b trial. Lancet , 386, 2078–2088. [CrossRef] [PubMed] [Google Scholar]
- Welters, M.J., van der Sluis, T.C., van Meir, H., Loof, N.M., van Ham, V.J., van Duikeren, S., Santegoets, S.J., Arens, R., de Kam, M.L., Cohen, A.F., van Poelgeest M.I., Kenter G.G., Kroep J.R., Burggraaf J., Melief C.J., van der Burg S.H. (2016). Vaccination during myeloid cell depletion by cancer chemotherapy fosters robust T cell responses. Sci Transl Med, 8, 334ra352. [CrossRef] [Google Scholar]
- Yadav, M., Jhunjhunwala, S., Phung, Q.T., Lupardus, P., Tanguay, J., Bumbaca, S., Franci, C., Cheung, T.K., Fritsche, J., Weinschenk, T., Modrusan, Z., Mellman, I., Lill, J.R., Delamarre, L. (2014). Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature , 515, 572–576. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Tartour, E. (2018). Vaccins anti-cancer : quel avenir dans les stratégies d’immunothérapie anti-cancéreuse ? Biologie Aujourd'hui, 212, 69-76
Liste des figures
 |
Figure 1 Optimisation des vaccins thérapeutiques en cancérologie. A : les vaccins anti-cancer peuvent viser de nouvelles cibles antigéniques, telles que les antigènes mutés, qui sont apparues comme plus immunogéniques, car non soumises au processus de tolérisation contre les antigènes du soi. B : des cellules pro-tumorales du microenvironnement tumoral (cellules endothéliales, fibroblastes…) peuvent également être éliminées par des vaccins. Différents travaux ont montré que les lymphocytes T résidents mémoires intratumoraux jouaient un rôle important dans l’efficacité des vaccins thérapeutiques. Ces lymphocytes sont mieux induits par une immunisation locale mucosale. C : en raison de la paralysie fonctionnelle des LT-CD8 qui expriment PD-1 dans le microenvironnement tumoral, des combinaisons thérapeutiques de vaccins avec des anticorps anti-PD-1/PD-L1 sont en cours d’évaluation. D’autres mécanismes immunosuppresseurs peuvent être inhibés par des molécules spécifiques (blocage LT régulateur, MDSC) ou par des traitements conventionnels (chimiothérapie, radiothérapie…). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


