| Numéro |
Biologie Aujourd’hui
Volume 215, Numéro 3-4, 2021
|
|
|---|---|---|
| Page(s) | 119 - 132 | |
| DOI | https://doi.org/10.1051/jbio/2021012 | |
| Publié en ligne | 11 mars 2022 | |
Article
Rôle physiologique du récepteur de l’apéline : Implication dans le maintien de l’équilibre hydrique et de l’hyponatrémie
Physiological role of the apelin receptor: implication in body fluid homeostasis and hyponatremia
Laboratoire « Neuropeptides centraux et régulations hydrique et cardiovasculaire », Centre Interdisciplinaire de Recherche en Biologie, INSERM U1050, Collège de France,
Paris, France
* Auteur correspondant : c.llorens-Cortès@college-de-france.fr
Reçu :
20
Septembre
2021
L’apéline, un neuropeptide vasoactif, son récepteur (Apéline-R) et l’arginine-vasopressine (AVP, hormone antidiurétique) sont co-localisés dans les neurones magnocellulaires vasopressinergiques. Dans le rein, l’Apéline-R est présent dans les artérioles glomérulaires et le canal collecteur (CD) où sont aussi localisés les récepteurs de l’AVP de type 2 (V2-R). L’apéline exerce une action aquarétique par son effet inhibiteur sur l’activité électrique phasique des neurones vasopressinergiques et la sécrétion systémique de l’AVP dans la circulation sanguine, et par son action directe au niveau du rein. Dans cet organe, elle augmente la microcirculation locale et inhibe, au niveau du CD, l’effet antidiurétique de l’AVP médié par les V2-R. L’apéline et l’AVP dans le plasma sont inversement régulées par les stimuli osmotiques aussi bien chez l’Homme que chez le rongeur, montrant que l’apéline participe avec l’AVP au maintien de l’équilibre hydrique. Sur le plan clinique, chez les patients atteints du syndrome d’antidiurèse inappropriée (SIAD), l’équilibre apéline/AVP est altéré, ce qui contribue au défaut du métabolisme de l’eau. L’activation de l’Apéline-R par un analogue métaboliquement stable d’une des isoformes de l’apéline, l’apéline-17, en augmentant la diurèse aqueuse et modérément la prise d’eau, et en corrigeant progressivement l’hyponatrémie, pourrait constituer une nouvelle approche pour le traitement de cette pathologie.
Abstract
Apelin, a vasoactive neuropeptide, its receptor and arginine-vasopressin (AVP, antidiuretic hormone) are co-localized in magnocellular vasopressinergic neurons. In the kidney, the apelin receptor is present in glomerular arterioles and the collecting duct (CD) where the AVP type 2 (V2-R) receptors are located. Apelin exerts an aquaretic action both by its inhibitory effect on the phasic electrical activity of vasopressinergic neurons and the secretion of AVP into the bloodstream and by its direct actions at the kidney level resulting in an increase in the renal microcirculation and the inhibition of the antidiuretic effect of AVP mediated by V2-R in the CD. Plasma apelin and AVP are conversely regulated by osmotic stimuli in both humans and rodents, showing that apelin is involved with AVP in maintaining body fluid homeostasis. Clinically, in patients with inappropriate antidiuresis syndrome (SIAD), the apelin/AVP balance is altered, which contributes to water metabolism defect. Activation of the apelin receptor by the metabolically stable apelin-17 analog, that increases aqueous diuresis and moderately water intake and gradually corrects hyponatremia, may constitute a new approach for the treatment of SIAD.
Mots clés : apéline / récepteur de l’apéline / vasopressine / récepteur V2 / hyponatrémie
Key words: apelin / apelin receptor / vasopressin / V2 receptor / hyponatremia
© Société de Biologie, 2022
Introduction
L’histoire de l’apéline débute en 1993 avec le clonage de l’ADNc du récepteur APJ à partir d’une banque génomique humaine (O’Dowd et al., 1993). Il s’agit d’une séquence qui code pour un récepteur orphelin, à sept domaines transmembranaires, couplé aux protéines G et composé de 380 acides aminés. Ce récepteur a d’abord été nommé APJ pour « protéine putative reliée au récepteur AT1 », AT1 représentant le récepteur de l’angiotensine II (AngII) de type 1. L’ APJ a par ailleurs été cloné chez la souris (Devic et al., 1999) et chez le rat, où il partage 31 % d’identité de séquence protéique avec le récepteur AT1 murin de type 1a (AT1a) (De Mota et al., 2000; O’Carroll et al., 2000). Des expériences de production d’AMP cyclique (AMPc), réalisées sur des cellules eucaryotes exprimant de façon stable le récepteur APJ de rat, ont permis de montrer que ce récepteur ne liait pas les angiotensines II, III ou IV (De Mota et al., 2000) et demeurait un récepteur orphelin. Fin 1998, Tatemoto et al. ont isolé le ligand endogène du récepteur APJ humain à partir d’extraits d’estomac de boeuf en utilisant une méthode de criblage fondée sur la mesure des variations de pH extracellulaire. Le peptide isolé a été nommé « apéline » pour ligand endogène du récepteur APJ. Ainsi, le récepteur APJ est maintenant appelé récepteur de l’apéline (Apéline-R).
L’apéline et son précurseur, la préproapeline
L’apéline est issue d’un large précurseur, la préproapéline, composé de 77 acides aminés (Tatemoto et al., 1998). Le gène humain de l’apéline est situé sur le chromosome X et la phase ouverte de lecture est localisée dans deux exons (1 et 2) séparés par un intron d’environ 6 kb. La partie non codante en 3’ se retrouve aussi dans deux exons (2 et 3). Ces données peuvent expliquer la présence de deux transcrits de tailles différentes, de 3,0 et 3,5 kb, en proportions variables suivant les tissus étudiés (Lee et al., 2000). La préproapéline a été isolée chez plusieurs espèces (Tatemoto et al., 1998; Habata et al., 1999; Lee et al., 2000) et l’alignement des séquences de souris, rat, boeuf et Homme a révélé une conservation stricte des 17 derniers acides aminés situés à l’extrémité C-terminale du précurseur, correspondant à l’apéline-17 ou K17F (Figure 1). In vivo, la préproapéline donne naissance à plusieurs formes moléculaires d’apéline qui diffèrent par leur longueur correspondant aux 36, 17 ou 13 derniers acides aminés situés à l’extrémité C-terminale du précurseur (Figure 1). L’apéline 13 est spontanément pyroglutamylée in vivo à son extrémité N-terminale et donne naissance à la forme pyroglutamylée de l’apéline 13 ou pE13F (Tatemoto et al., 1998) (Figure 1). Dans le cerveau et le plasma de rat, on trouve majoritairement pE13F et, en plus faible quantité, K17F (De Mota et al., 2004). Dans les testicules et l’utérus, l’apéline 36 prédomine, alors que, dans les glandes mammaires, on trouve à la fois l’apéline 36 et pE13F (Kawamata et al., 2001). Chez l’Homme, on détecte majoritairement dans le plasma sanguin K17F, pE13F, et en plus faible quantité, l’apéline 36 (Azizi et al., 2008).
 |
Figure 1 Séquence primaire du précurseur de l’apéline, la préproapéline, chez l’Homme, le bœuf, le rat et la souris. Chez ces espèces, l’alignement des séquences en acides aminés a révélé une conservation stricte des 17 derniers acides aminés carboxyterminaux (en gras) correspondant à l’apéline 17 ou K17F. In vivo, la préproapéline donne naissance à plusiers formes moléculaires d’apéline qui diffèrent par leur longueur, comprenant soit les 36, les 17 ou les 13 derniers acides aminés de l’extremité C-terminale du précurseur. In vivo, l’apéline 13 (Q13F) est spontanément pyroglutamylée en pE13F. |
Les voies de signalisation du récepteur de l’apéline
Les différentes formes moléculaires de l’apéline (apéline 36, K17F et pE13F) présentent une affinité subnanomolaire pour leur récepteur, l’Apéline-R (Medhurst et al., 2003; Iturrioz et al., 2010). Des études structure-fonction par modélisation moléculaire et mutagenèse dirigée ont permis d’identifier les résidus acides de l’Apéline-R situés à la surface du récepteur, Glu172, Asp282 et Asp92 impliqués dans la liaison de l’apéline via leur interaction avec ses résidus basiques (dans pE13F : Arg2, Arg4 et Lys8) (Gerbier et al., 2015).
Plusieurs laboratoires ont montré que les récepteurs murin et humain de l’apéline, exprimés de façon stable dans des cellules ovariennes de hamster chinois (CHO) ou dans des cellules de rein embryonnaire humain (HEK), sont couplés négativement à l’adénylate cyclase. L’apéline 36, K17F et pE13F inhibent la production d’AMPc induite par la forskoline avec une concentration inhibitrice 50 (CI50) subnanomolaire (Habata et al., 1999; De Mota et al., 2000; Réaux et al., 2001; Masri et al., 2002; El Messari et al., 2004). C’est en mettant en évidence le blocage par la toxine de Pertussis de la production d’AMPc induite par l’apéline 36 et pE13F que le couplage de l’Apéline-R à Gαi a pu être démontré (Hosoya et al., 2000; Masri et al., 2006; Bai et al., 2008). L’apéline 36, K17F et pE13F augmentent également la mobilisation du calcium intracellulaire ([Ca2+]i) dans les cellules de tératocarcinome humain Ntera 2 (NT2N), dans les cellules dérivées de basophiles (RBL-2H3) ou les cellules HEK 293 exprimant de manière stable l’Apéline-R humain (Choe et al., 2000; Medhurst et al., 2003; Zhou et al., 2003a, b). De plus, Hus-Citharel et al. (2008) ont montré que K17F diminue la mobilisation du [Ca2+]i induite par l’AngII dans les artérioles glomérulaires microdisséquées via la production d’oxyde nitrique (NO). Fait intéressant, la stimulation de l’Apéline-R par K17F ou pE13F induit une vasodilatation et module le tonus vasculaire via la production de NO (Réaux et al., 2001; Tatemoto et al., 2001; Hus-Citharel et al., 2008; Gerbier et al., 2017).
La stimulation de l’Apéline-R peut également induire l’activation des voies de signalisation liées aux kinases. Dans les cellules endothéliales humaines de veine ombilicale (HUVEC) et dans les cellules CHO exprimant l’Apéline-R de souris, la stimulation de l’Apéline-R par l’apéline induit l’activation de la phosphatidylinositol 3-kinase (PI3K)/Akt et de la voie des MAP kinases (mitogen-activated protein kinases) stimulant la phosphorylation de la protéine kinase ribosomique S6 (p70S6K) (Masri et al., 2002; Bai et al., 2008; Eyries et al., 2008). De plus, D’Aniello et al. (2009) ont montré que l’apéline induit la phosphorylation de la kinase p70S6 dans les cellules souches embryonnaires murines via une voie dépendante des enzymes ERK1 et ERK2 (Extracellular signal-regulated kinases, ERK1/2). De fait, ERK1/2 sont phosphorylées de façon Gαi- et protéine kinase C (PKC)-dépendante dans les cellules CHO exprimant de manière stable l’Apéline-R de souris (Masri et al., 2002, 2006).
Comme pour la plupart des RCPG, l’apéline, en se fixant sur son récepteur, induit la phosphorylation de l’Apéline-R par les kinases des RCPG (GRK), puis le recrutement de la β-arrestine1/2 et l’internalisation de l’Apéline-R via un mécanisme dépendant de la clathrine (Evans et al., 2001; Réaux et al., 2001; Medhurst et al., 2003; Zhou et al., 2003b; El Messari et al., 2004; Iturrioz et al., 2010). K17F entraîne une internalisation plus massive que pE13F. La sérine en position 348 (Ser 348) à l’extrémité C-terminale de l’Apéline-R représente un site de phosphorylation qui est crucial pour les interactions de l’Apéline-R avec GRK2/5 et la β-arrestine1/2, ainsi que pour son internalisation (Chen et al., 2014). De plus, la phénylalanine C-terminale de pE13F s’insère au fond du site de liaison de l’Apéline-R, dans une cavité hydrophobe composée des tryptophanes en positions 152 (Trp 152) dans le domaine transmembranaire IV (TMIV) et 259 (Trp 259) dans le TMVI et de la phénylalanine en position 255 (Phe 255) dans le TMVI (Iturrioz et al., 2010). Des études structure-fonction par modélisation moléculaire et mutagénèse dirigée ont démontré que les résidus Phe 255 et Trp 259, en interagissant avec la phénylalanine C-terminale de pE13F, étaient cruciaux pour l’internalisation de l’Apéline-R mais ne jouaient aucun rôle dans la liaison de l’apéline à son récepteur ou dans le couplage de l’Apéline-R à Gαi.
La délétion de la phénylalanine C-terminale de K17F menant à K16P ou sa substitution par une alanine donnant naissance à K17A diminue fortement la capacité du peptide à déclencher l’internalisation de l’Apéline-R, sans affecter son affinité pour ce récepteur ou sa capacité à activer son couplage à Gαi (El Messari et al., 2004; Iturrioz et al., 2010; Wang et al., 2016). Toutes ces données indiquent une dissociation fonctionnelle entre le couplage de l’Apéline-R à Gi et l’internalisation du récepteur. Cela implique que l’Apéline-R existe sous différentes conformations produites en fonction du ligand qui s’insère dans son site de liaison, celles-ci déclenchant alors l’activation de différentes voies de signalisation et des effets biologiques variés (Iturrioz et al., 2010). Ainsi, l’Apéline-R peut présenter une sélectivité fonctionnelle ou une signalisation biaisée, d’une part par son couplage avec Gi et d’autre part en recrutant la β-arrestine 1/2. Cette hypothèse a été confirmée par Ceraudo et al. (2014) qui ont montré que K17F active la phosphorylation de ERK1/2 de façon β-arrestine- et protéine Gi-dépendante alors que K16P n’active la phosphorylation de ERK1/2 que par la protéine Gi. Cette sélectivité fonctionnelle des différentes formes moléculaires de l’apéline indique que l’activation ERK1/2 dépendante de la β-arrestine et indépendante de Gi peut participer à la diminution de la pression artérielle (PA) induite par K17F. En effet, lorsque pE13A et K16P sont injectés par voie intraveineuse (iv) chez le rat, ils ne sont plus capables de diminuer la PA, contrairement aux peptides naturels correspondants pE13F et K17F (El Messari et al., 2004; Lee et al., 2005). De plus, le complexe Apéline-R/pE13F internalisé est rapidement recyclé à la surface cellulaire via une voie Rab4, tandis que le complexe Apéline-R/apéline 36 internalisé est dirigé via la voie Rab7 vers les lysosomes pour être dégradé (Lee et al., 2010), montrant que le trafic intracellulaire de l’Apéline-R dépend du ligand utilisé pour activer le récepteur (Lee et al., 2010). Ces différences sont en accord avec le fait que l’apéline 36 conduit à une désensibilisation forte et soutenue alors que celle induite par pE13F est transitoire (Masri et al., 2006). Par conséquent, des différences subtiles existent entre les isoformes d’apéline concernant leurs propriétés pharmacologiques, qui peuvent influencer leurs actions physiologiques.
Distribution de l’apéline et de son récepteur dans le cerveau
Des travaux de transcription inverse et d’amplification génique (RT-PCR) quantitative (Kawamata et al., 2001; Medhurst et al., 2003), d’hybridation in situ et de Northern blot (Lee et al., 2000; O’Carroll et al., 2000) ont montré que les ARNm codant pour la préproapéline ou pour l’Apéline-R sont distribués de façon hétérogène dans diverses structures cérébrales chez le rat et chez l’Homme.
Concernant l’apéline, le développement d’un anticorps polyclonal de hautes affinité et sélectivité contre K17F a permis de visualiser, pour la première fois, la présence de neurones apélinergiques dans le cerveau de rat (Réaux et al., 2001, 2002; De Mota et al., 2004). Les corps cellulaires de ces neurones sont particulièrement abondants au sein de l’hypothalamus et du bulbe rachidien, des structures impliquées dans le contrôle neuroendocrinien, les comportements dipsique et alimentaire et la régulation de la PA. Un immunomarquage a été notamment observé dans le noyau supraoptique (SON) et la partie magnocellulaire du noyau paraventriculaire (PVN) de l’hypothalamus, le noyau arqué, le noyau réticulaire latéral et le noyau ambigu (Réaux et al., 2002). Les fibres et les terminaisons des neurones apélinergiques sont plus largement distribuées, et présentent en particulier une forte densité dans la couche interne de l’éminence médiane et dans l’hypophyse postérieure (Brailoiu et al., 2002; Réaux et al., 2002), suggérant que les neurones apélinergiques du PVN et du SON projettent, comme les neurones magnocellulaires vasopressinergiques et ocytocinergiques, dans l’hypophyse postérieure. Des études de double marquage en immunofluorescence ont confirmé cette hypothèse en montrant que l’apéline était co-localisée avec l’arginine-vasopressine (AVP, hormone antidiurétique) (De Mota et al., 2004; Réaux-Le Goazigo et al., 2004) et l’ocytocine (Brailoiu et al., 2002) dans les neurones magnocellulaires hypothalamiques. De nombreuses fibres apélinergiques ont également été visualisées dans la région située le long du troisième ventricule, dans la lame terminale (composée de l’organe subfornical, de l’organe vasculaire de la lame terminale et du noyau médian préoptique), impliquée dans la régulation du comportement dipsique (Johnson et al., 1996). Tout comme l’apéline, son récepteur est très largement distribué dans le cerveau de rat (De Mota et al., 2000; Lee et al., 2000; O’Carroll et al., 2000). Ainsi, l’expression de l’ARNm de l’Apéline-R a été observée par hybridation in situ dans le cortex piriforme et entorhinal, l’hippocampe et des structures contenant les neurones monoaminergiques (dopamine, sérotonine, noradrénaline) telles que la substance noire pars compacta, le noyau raphé dorsal et le locus cœruleus. Une expression très forte est détectée dans les noyaux hypothalamiques riches en apéline, dont le PVN, le SON et le noyau arqué, ainsi que dans la glande pinéale et les lobes antérieur et intermédiaire de l’hypophyse. De plus, des doubles marquages associant l’immunohistochimie et l’hybridation in situ ont démontré qu’au niveau du PVN et du SON, l’ARNm codant pour l’Apéline-R (Réaux et al., 2001; O’Carroll & Lolait, 2003) est co-exprimé avec les transcrits codant pour les récepteurs de l’AVP de type 1a (V1a) et 1b (V1b) (Hurbin et al., 1998) dans les neurones magnocellulaires vasopressinergiques.
Distribution de l’apéline et de son récepteur dans le rein
Les ARNm codant pour la préproapéline, ainsi que pour l’Apéline-R, sont exprimés dans le rein chez le rat et chez l’Homme (Hosoya et al., 2000; O’Carroll et al., 2000; Medhurst et al., 2003). Une « immunoréactivité apéline » est également détectée dans les cellules endothéliales des petits vaisseaux intrarénaux chez l’Homme (Kleinz et al., 2005). Chez le rat, l’expression de l’apéline a été détectée dans les cellules épithéliales tubulaires, les glomérules et les cellules épithéliales vasculaires (Ripoll et al., 2011), mais d’autres auteurs ont rapporté que l’expression de l’apéline reste surtout limitée aux cellules de la zone médullaire (O’Carroll et al., 2017). Enfin, une « immunoréactivité apéline » a également été visualisée dans le CD chez l’Homme (De Falco et al., 2002) et dans les canaux collecteurs médullaires chez le rat, où elle est co-localisée avec l’expression de l’aquaporine 2 (AQP2) (Xu et al., 2020).
L’expression de l’ARNm de l’Apéline-R est détectée dans les cellules endothéliales et les cellules musculaires lisses des artérioles glomérulaires de rat (Hus-Citharel et al., 2008). Dans les glomérules, l’expression de cet ARN est environ huit fois plus élevée que dans les segments de néphron où elle est néanmoins présente à tous les niveaux (O’Carroll et al., 2000; Hus-Citharel et al., 2008). Enfin, le transcrit de l’Apéline-R est également localisé dans le CD où les récepteurs de l’AVP de type 2 (V2-R) sont co-exprimés (Ostrowski et al., 1992). Une description détaillée a souligné que l’expression de l’Apéline-R est plus faible dans le CD cortical comparé au CD de la médullaire externe et plus élevée dans le CD de la médullaire interne (Hus-Citharel et al., 2008; O’Carroll et al., 2017).
Implication de l’apéline dans la régulation de l’équilibre hydrique via des effets centraux et rénaux
Action centrale de l’apéline sur l’activité des neurones magnocellulaires vasopressinergiques, la libération systémique d’AVP et la diurèse
Il est établi depuis longtemps que les neurones neurosécrétoires magnocellulaires qui projettent dans la neurohypophyse libèrent l’AVP, un peptide antidiurétique et vasoconstricteur, dans la circulation sanguine, en réponse aux variations d’osmolalité plasmatique et de volémie (Manning et al., 1977; Brownstein et al., 1980) ou sous l’action de différentes neurohormones dont l’AngII et l’AngIII et de peptides natriurétiques (Zini et al., 1996; Gouzènes et al., 1998). La co-localisation AVP/apéline dans les neurones magnocellulaires hypothalamiques et l’association étroite des récepteurs des deux peptides avec ces mêmes neurones suggéraient l’existence d’une interaction entre ces deux peptides et la possibilité d’une réponse apélinergique aux stimuli osmotiques et volémiques. Ainsi, indépendamment du rétrocontrôle exercé par l’AVP, qui augmente sa propre libération par une action autocrine via ses récepteurs de type 1 (V1-R) localisés sur les neurones vasopressinergiques (Gouzènes et al., 1998; Ludwig, 1998), l’apéline pourrait également moduler l’activité de ces neurones, et par conséquent la libération de l’AVP dans la circulation sanguine, en agissant sur ses récepteurs exprimés par les neurones vasopressinergiques. Cette hypothèse a été testée dans le modèle de la ratte en lactation chez laquelle une hyperactivité des neurones magnocellulaires vasopressinergiques a été observée (Poulain et al., 1977) afin de conserver l’eau de l’organisme pour une production optimale de lait pour les nouveau-nés (Gimpl & Fahrenholz, 2001). Dans ce modèle, K17F, injectée dans le troisième ventricule, diminue l’activité électrique phasique des neurones vasopressinergiques, réduit la sécrétion d’AVP dans la circulation sanguine et entraîne une diurèse aqueuse (De Mota et al., 2004) (Figure 2).
De même, une réduction importante de la sécrétion de l’AVP dans la circulation sanguine est observée après injection par voie icv de K17F ou de pE13F chez des souris déshydratées pendant 24 h (Réaux et al., 2001), une condition qui entraîne, elle aussi, une hyperactivité des neurones vasopressinergiques. On peut conclure de ces résultats que l’apéline pourrait, comme l’AVP, être libérée au niveau somatodendritique et exercer un effet inhibiteur direct sur l’activité des neurones vasopressinergiques et la libération systémique d’AVP par une action autocrine via ses récepteurs localisés sur ces neurones. Par ce mécanisme, l’apéline jouerait donc le rôle d’un inhibiteur naturel de l’effet antidiurétique de l’AVP et serait impliquée dans l’osmorégulation.
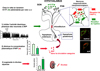 |
Figure 2 Action centrale de l’apéline sur l’activité des neurones magnocellulaires vasopressinergiques, la libération systémique d’AVP et la diurèse. L’apéline et son récepteur (vert) colocalisent avec l’AVP et son récepteur V1-R (rouge) au sein des neurones magnocellulaires vasopressinergiques des noyaux paraventriculaire (PVN) et supraoptique (SON). Chez la ratte en lactation, K17F inhibe l’activité électrique phasique de ces neurones et la sécrétion de l’AVP de l’hypophyse postérieure dans la circulation sanguine, ce qui provoque au niveau rénal une augmentation de la diurèse aqueuse. |
Action rénale de l’apéline dans la régulation de la diurèse
Le CD est connu pour être le site de l’action antidiurétique de l’AVP (Terada et al., 1993; Morello & Bichet, 2001). En effet, dans ce segment, l’AVP, en stimulant les V2-R, induit une augmentation de la production d’AMPc et active la protéine kinase A qui phosphoryle le canal à eau, AQP2. Cela se traduit par l’insertion de l’AQP2 phosphorylé dans la membrane apicale des cellules principales du CD (Nielsen et al., 1995; Sands et al., 1997), menant à une réabsorption d’eau, diminuant la diurèse et augmentant l’osmolalité urinaire. La présence des ARNm de l’Apéline-R le long du CD suggère que l’apéline pourrait agir comme un peptide aquarétique non seulement par une action centrale, mais aussi par une action directe sur le CD.
En accord avec cette hypothèse, l’application de K17F dans le CD inhibe la production d’AMPc induite par la (déamino-Cys1, D-Arg8)-vasopressine (dDAVP), un agoniste spécifique et sélectif du V2-R (Hus-Citharel et al., 2014). De plus, chez la ratte en lactation, l’administration par voie iv de K17F induit une diminution significative de l’immunomarquage AQP2 à la membrane apicale du CD selon un gradient cortico-médullaire (Hus-Citharel et al., 2014) (Figure 3). Finalement, K17F injectée par voie iv chez des rattes en lactation (Hus-Citharel et al., 2008) ou l’apéline-13 infusée en iv pendant 24 h chez des rats mâles Sprague-Dawley (Murza et al., 2016) augmente fortement la diurèse de manière dose-dépendante. Simultanément intervient une diminution significative de l’osmolalité urinaire sans modification de l’excrétion de Na+ et K+.
Ces données ont été récemment renforcées par les travaux de Boulkeroua et al. (2019). Ces auteurs ont rapporté que, sur une lignée cellulaire issue de CD cortical de souris hautement différenciée (mpkCCD) exprimant le V2-R et l’Apéline-R, l’application de l’apéline-13 diminue la phosphorylation induite par la dDAVP et l’expression à la membrane apicale de l’AQP2 après 30 à 60 min de traitement, ainsi que l’expression de l’ARNm de l’AQP2 induite par la dDAVP après 8 à 24 h de traitement. Plus récemment, une autre étude a montré que l’action diurétique de pE13F impliquerait la voie AMPc/protéine kinase A/récepteur soluble de la prorénine dans le CD (Chen et al., 2021). Ainsi, l’effet aquarétique de l’apéline est dû en partie à son action directe au niveau des reins qui neutralise l’effet antidiurétique de l’AVP survenant via les V2-R dans le CD. In fine, les effets opposés de l’apéline et de l’AVP dans cette structure contribuent à contrôler l’osmolalité plasmatique en régulant la réabsorption d’eau par le rein (Figure 3).
Les ARNm de l’Apéline-R ont également été détectés dans les cellules endothéliales et les cellules musculaires des artérioles glomérulaires (Hus-Citharel et al., 2008), et l’application de l’apéline sur ces artérioles préalablement contractées par l’AngII induit une vasorelaxation. Cet effet vasodilatateur de l’apéline est NO-dépendant et directement lié à une inhibition par ce peptide de l’augmentation de [Ca2+]i induite par l’AngII (Hus-Citharel et al., 2008). L’expression de l’Apéline-R dans les glomérules et les artérioles glomérulaires ainsi que les effets vasoactifs de l’apéline au niveau des artérioles musculaires efférentes (qui proviennent du cortex juxtamédullaire et vont donner naissance aux vasa recta), suggèrent fortement que l’apéline, en se fixant sur ses récepteurs localisés dans ces structures, provoque une augmentation du débit sanguin rénal, qui participe également à l’augmentation de la diurèse induite par ce peptide. Par ailleurs, l’inhibition par l’apéline de l’effet vasoconstricteur provoqué par l’AngII dans les artérioles glomérulaires contribue aussi aux effets opposés du système apélinergique et du système rénine-angiotensine sur la PA (Ishida et al., 2004).
L’ensemble de ces données souligne le rôle crucial de l’apéline dans le maintien de l’équilibre hydrique via son action non seulement au niveau central où elle inhibe la sécrétion de l’AVP de l’hypophyse postérieure dans la circulation sanguine, mais aussi directement au niveau rénal, où elle bloque l’effet antidiurétique de l’AVP dans le CD et augmente le flux sanguin rénal.
 |
Figure 3 Régulation de l’apéline et de la vasopressine dans les conditions physiologiques, au cours de la déshydratation/perfusion de soluté salé hypertonique ou lors d’une charge aqueuse. Dans les conditions physiologiques, l’apéline (vert) et l’AVP (violet) sont libérées par les neurones magnocellulaires vasopressinergiques à des niveaux appropriés pour l’osmolalité plasmatique. Dans le canal collecteur du rein, l’AVP agit sur les V2-R pour augmenter la production d’AMPc et l’insertion de l’aquaporine 2 (AQP2) à la membrane apicale, conduisant à la réabsorption d’eau. À l’inverse, l’apéline, par son action sur l’Apéline-R, a un effet opposé. Dans des conditions physiologiques, la réabsorption d’eau est adéquate et les concentrations plasmatiques de sodium sont normales. À la suite d’une déshydratation, les neurones vasopressinergiques sont fortement activés et l’AVP est libérée dans la circulation sanguine plus rapidement qu’elle n’est synthétisée, entraînant une diminution du contenu neuronal en AVP, tandis que l’apéline s’accumule dans les neurones plutôt que d’être libérée. En revanche, lors d’une charge hydrique, les neurones sont inhibés, ce qui arrête la libération d’AVP et entraîne une accumulation du contenu neuronal en AVP. À l’inverse, la libération d’apéline dans la circulation sanguine augmente rapidement, ce qui entraîne une diminution du contenu neuronal en apéline. Ainsi, les niveaux d’apéline et d’AVP sont régulés de façon opposée par les stimuli osmotiques. Cette figure a été modifiée avec l’autorisation de Llorens-Cortès et Moos (Llorens-Cortès & Moos, 2012), disponible sur https://onlinelibrary.wiley.com/doi/epdf/10.1111/j.1365-2826.2012.02316.x. |
Régulation croisée de l’apéline et de la vasopressine dans le maintien de l’équilibre hydrique
La colocalisation AVP/apéline au sein des mêmes neurones et leurs actions opposées sur la diurèse ont conduit à différentes investigations visant à caractériser les régulations de ces peptides dans le cadre du maintien de l’équilibre hydrique. Bien que les deux peptides soient localisés dans les mêmes neurones, chez le rat déshydraté pendant 24 h, l’hyperactivité des neurones vasopressinergiques et l’augmentation concomitante de la sécrétion systémique d’AVP s’accompagnent d’une diminution des taux d’apéline dans le plasma (De Mota et al., 2004). Parallèlement, il a été mis en évidence, par une approche d’immunohistochimie quantitative, lors d’une déshydratation chez le rat, une augmentation du contenu neuronal en apéline dans les neurones magnocellulaires vasopressinergiques du PVN et du SON alors que le contenu neuronal en AVP diminuait fortement (Réaux-Le Goazigo et al., 2004). Ceci suggérait qu’en situation de déshydration, l’apéline s’accumule dans les neurones vasopressinergiques plutôt que d’être libérée. De plus, l’augmentation du contenu neuronal en apéline observée chez les animaux déshydratés est inhibée par l’injection par voie icv d’un antagoniste sélectif des V1-R et, au contraire, reproduite sous l’action de l’AVP administrée par cette même voie (De Mota et al., 2004; Réaux-Le Goazigo et al., 2004). Ceci suggère que l’accumulation d’apéline est due à l’augmentation de la libération somatodendritique d’AVP secondaire à la déshydratation. Cette interprétation implique que l’apéline et l’AVP soient libérées de façon différentielle par les neurones magnocellulaires vasopressinergiques dans lesquels elles sont colocalisées. En accord avec cette hypothèse, des études de double marquage en microscopie confocale ont montré que les deux peptides se trouvent en grande partie dans des granules neurosécrétoires de taille et de distribution distinctes au sein des neurones magnocellulaires (De Mota et al., 2004; Réaux-Le Goazigo et al., 2004) (Figure 2). Ainsi, l’ensemble de ces données démontre que lors d’une déshydratation, l’apéline et l’AVP jouent des rôles complémentaires dans le maintien de l’équilibre hydrique. Alors que l’augmentation de la libération somatodentritique d’AVP renforce l’activité électrique phasique des neurones vasopressinergiques (Gouzènes et al., 1998; Ludwig, 1998), facilitant ainsi la sécrétion d’AVP dans la circulation sanguine, l’apéline s’accumule dans ces neurones au lieu d’être libérée dans la circulation sanguine, provoquant une diminution de l’inhibition qu’elle exerce (dans les conditions physiologiques normales) sur les neurones vasopressinergiques (De Mota et al., 2004) et amplifiant ainsi l’activité électrique phasique des neurones vasopressinergiques (Figure 2). Cette régulation croisée de l’apéline et de l’AVP à la suite d’une stimulation osmotique a été aussi mise en évidence dans une autre étude chez l’Homme (Azizi et al., 2008). En l’occurrence, 10 volontaires sains de sexe masculin ont été soumis soit à une restriction hydrique de 12 h suivie d’une perfusion de soluté salé hypertonique, afin d’augmenter l’osmolalité plasmatique, soit à une charge hydrique par voie orale pour, au contraire, la diminuer. L’augmentation de l’osmolalité plasmatique s’accompagne d’une baisse des taux d’apéline dans le plasma alors que ceux d’AVP augmentent de façon linéaire. À l’inverse, la diminution de l’osmolalité plasmatique produit une réduction de la concentration plasmatique d’AVP et une rapide élévation de celle d’apéline (Figure 4). Ces résultats montrent, pour la première fois chez l’Homme, que les sécrétions d’apéline et d’AVP sont régulées de façon opposée par les stimuli osmotiques (Figure 4), suggérant que l’apéline comme l’AVP pourrait jouer un rôle important dans le maintien de l’équilibre hydrique chez l’Homme comme chez le rongeur. L’apéline et l’AVP pourraient être considérées comme le Yin et le Yang de l’équilibre hydrique de l’organisme (Figure 3).
 |
Figure 4 Corrélations linéaires entre les concentrations plasmatiques d’AVP et d’apéline et l’osmolalité plasmatique. (A) entre la concentration plasmatique d’AVP et l’osmolalité plasmatique ; (B) entre la concentration plasmatique d’apéline et l’osmolalité plasmatique, chez des patients volontaires sains après une perfusion de soluté salé hypertonique ou une charge hydrique. |
L’apéline et le comportement dispsique
En relation avec un rôle de l’apéline dans la régulation de l’équilibre hydrique qui dépend non seulement de la sécrétion d’AVP et de son action au niveau rénal, mais aussi de la régulation de la soif et de la prise de sel (Denton et al., 1996), des fibres et des terminaisons apélinergiques ont été visualisées dans les structures cérébrales contrôlant le comportement dipsique (l’organe subfornical, l’organe vasculaire de la lame terminale et le noyau médian préoptique) (Réaux et al., 2002). De plus, il a été montré que l’injection d’apéline par voie icv chez le rat déshydraté pendant 24 h réduisait la quantité d’eau ingérée (Réaux et al., 2001). Toujours chez le rat, il a été rapporté que lorsque l’animal est nourri avec une alimentation standard, l’injection d’apéline par voie icv diminue la quantité d’eau ingérée, mais que cet effet disparaît lorsqu’il est soumis à un régime riche en graisses le rendant obèse (Clarke et al., 2009). Cette réponse pourrait être liée à la modification de l’expression de l’ARNm de l’Apéline-R qui a été observée chez le rat obèse. Cependant, chez les souris déficientes en Apéline-R ayant un libre accès à l’eau, la quantité d’eau ingérée est significativement diminuée (−26 %), de même que les taux plasmatiques d’AVP (−40 %), bien que le volume et l’osmolalité urinaires restent au niveau des valeurs mesurées chez les animaux contrôles (Roberts et al., 2009). Ceci pourrait suggérer qu’en l’absence de l’Apéline-R, pour rétablir l’équilibre hydrique assuré par l’apéline et l’AVP, la libération d’AVP dans la circulation sanguine est diminuée ainsi que les entrées d’eau.
Ainsi, l’influence de l’apéline sur la diurèse (via une action centrale et rénale), de même que celle qu’elle exerce sur le comportement dipsique, pourraient contribuer à une régulation fine des pertes hydriques, régulation dont l’importance physiologique varierait en fonction de l’état physiopathologique de l’organisme.
Implication de la balance apéline/AVP dans l’hyponatrémie
L’hyponatrémie
L’hyponatrémie, définie par une concentration plasmatique de sodium inférieure à 135 mmol/L, est le trouble électrolytique le plus fréquent chez les patients hospitalisés. Diverses affections ont été associées à l’hyponatrémie, notamment le syndrome d’antidiurèse inappropriée (SIAD) mais aussi l’insuffisance cardiaque chronique, l’insuffisance rénale chronique et la cirrhose (Ellison & Berl, 2007). L’hyponatrémie est importante à reconnaître car elle conduit à des taux de mortalité élevés (Kim et al., 2008; Waikar et al., 2009; Kovesdy et al., 2012) et elle peut être un marqueur d’une maladie sous-jacente.
Syndrome d’antidiurèse inappropriée
Le SIAD, précédemment dénommé syndrome de sécrétion inappropriée de l’hormone antidiurétique (SIADH), est la cause la plus fréquente d’hyponatrémie. De nombreuses affections cliniques peuvent provoquer un SIAD et parmi elles des tumeurs, qui peuvent sécréter de l’AVP par voie ectopique, des troubles du système nerveux central et des maladies pulmonaires. Un certain nombre de médicaments peuvent également induire un SIAD en augmentant la sécrétion d’AVP, comme les antidépresseurs tricycliques, les inhibiteurs de la recapture de la sérotonine, les opiacés, et/ou en potentialisant son effet comme la carbamazépine, la chlorpropamide ou les anti-inflammatoires non stéroïdiens (Peri, 2019). Dans le SIAD, les taux plasmatiques d’AVP sont anormalement élevés par rapport à l’osmolalité plasmatique (Ellison & Berl, 2007). En agissant sur les V2-R présents dans le rein au niveau des CD, cette concentration accrue de l’AVP va augmenter la production d’AMPc, conduisant à une insertion plus importante de l’AQP2 à la membrane apicale, entraînant une réabsorption d’eau plus élevée, une diminution de la diurèse et une hyponatrémie. L’hyponatrémie provoque l’entrée d’eau dans les cellules en raison de l’état hypotonique (Verbalis et al., 2013). Les symptômes sont principalement liés à l’hypertrophie des cellules du système nerveux central et leur gravité dépend de la concentration sérique de sodium. Des symptômes graves, tels que coma, convulsions, arrêt respiratoire, sont généralement associés à une hyponatrémie aiguë, mettant la vie en danger. Des symptômes moins sévères tels que maux de tête, irritabilité, nausées/vomissements, ralentissement mental, confusion, désorientation sont observés dans l’hyponatrémie chronique (Verbalis, 2019). Étant donné la régulation opposée des taux plasmatiques d’apéline et d’AVP par les stimuli osmotiques chez des sujets sains, la réponse de l’apéline au défaut d’osmorégulation de l’AVP dans le SIAD a été étudiée (Blanchard et al., 2013). Chez les patients SIAD, les taux plasmatiques d’apéline et de copeptine (peptide de 39 acides aminés issu, comme l’AVP, de la pré-pro-vasopressine et libéré en quantités équimolaires avec l’AVP dans la circulation sanguine) ajustés en fonction du sexe et de l’âge sont augmentés (+26 % et +75 % respectivement) par rapport à ceux mesurés chez des sujets sains (Blanchard et al., 2013). Chez une large majorité (86 %) de patients atteints de SIAD, le rapport apéline/copeptine plasmatique est en dehors des limites physiologiques, mettant en évidence le défaut de régulation de l’osmolalité chez ces patients. L’équilibre apéline/AVP anormal contribue à la rétention d’eau chez les patients hyponatrémiques SIAD (Blanchard et al., 2013). Il a donc été émis l’hypothèse selon laquelle l’activation de l’Apéline-R par un agoniste spécifique pourrait contrecarrer la réabsorption d’eau accrue induite par l’augmentation des taux d’AVP et corriger l’hyponatrémie.
Effets d’un analogue métaboliquement stable de l’apéline 17, le LIT01-196, dans un modèle expérimental d’hyponatrémie
Développement et propriétés pharmacologiques du LIT01-196
Dans le plasma de souris, Gerbier et al. (2017) ont montré que K17F et pE13F ont une demi-vie (ex vivo) de 4,6 et 7,2 minutes respectivement et Murza et al. (2014) que pE13F a une demi-vie de 14 minutes dans le plasma de rat. Concernant l’apéline-36, Japp et al. (2010) ont rapporté, à partir d’expériences réalisées sur des sujets humains en bonne santé, que la demi-vie de l’apéline 36 est inférieure à 5 minutes. La demi-vie in vivo de K17F dans la circulation sanguine après administration par voie iv est respectivement de 44 et 50 s chez la souris et le rat (Flahault et al., 2021). Ces demi-vies courtes sont dues au métabolisme rapide des apélines par des enzymes telles que l’enzyme de conversion 2 (ACE2) et l’endopeptidase neutre 24.11 (NEP, néprilysine) (McKinnie et al., 2016; Wang et al., 2016). La disparition rapide de l’apéline in vivo a encouragé le développement d’analogues de l’apéline métaboliquement stables pour des applications thérapeutiques potentielles. De nombreuses approches, telles que la PEGylation (Jia et al., 2012; Galon-Tilleman et al., 2017; Fischer et al., 2020), les modifications synthétiques au sein du motif RPRL de l’apéline (Choe et al., 2000), la palmitoylation et l’utilisation d’acides aminés non naturels (O’Harte & Flatt, 2015; Juhl et al., 2016; Fischer et al., 2019) ou les modifications de la chaîne principale (cyclisation) (Brame et al., 2015; Murza et al., 2017; Trân et al., 2018) ont été utilisées pour augmenter la demi-vie de l’apéline. La plupart des études visant à développer des analogues métaboliquement stables de l’apéline se sont concentrées sur pE13F (Brame et al., 2015; Murza et al., 2015, 2017; Juhl et al., 2016; Gerbier et al., 2017; Trân et al., 2018) et l’apéline-36 (Jia et al., 2012; Galon-Tilleman et al., 2017). Cependant, comparé à pE13F, K17F a une affinité 10 fois supérieure pour l’Apéline-R humain, est plus efficace pour induire la mobilisation de la β-arrestine (x20) et l’internalisation de l’Apéline-R de rat (x10-30) (Gerbier et al., 2017) et est également plus actif pour diminuer la PA (El Messari et al., 2004). Compte tenu de ces données, des analogues de K17F métaboliquement stables ont été développés (Gerbier et al., 2017; Fischer et al., 2019). Dans les travaux de Gerbier et al. (2017), la stratégie originale pour améliorer la protection des peptides endogènes vis-à-vis de la dégradation enzymatique a consisté à ajouter une chaîne fluorocarbonée directement à l’extrémité N-terminale de K17F, générant le LIT01-196.
Ce composé présente une forte affinité pour l’Apéline-R murin (Ki = 0,08 nM) et est beaucoup plus stable dans le plasma (demi-vie > 24 h) que K17F (cf ci-dessus : 4,6 min chez la souris). Le LIT01-196 a montré une résistance remarquable aux enzymes de dégradation plasmatiques, puisque >90 % du peptide est resté intact après 24 h d’incubation dans le plasma de souris à 37°C. Le LIT01-196 présente un profil d’agoniste complet pour l’Apéline-R, que ce soit pour la production d’AMPc, la phosphorylation d’ERK1/2 (nanomolaire), le recrutement de la β-arrestine ou l’internalisation de l’Apéline-R (efficacité subnanomolaire) (Gerbier et al., 2017).
Effets du LIT01-196 sur la libération d’AVP et sur l’effet antidiurétique de l’AVP chez les animaux contrôles
Chez la souris, l’administration par voie icv du LIT01-196 diminue significativement et de façon dose dépendante la libération de l’AVP induite par la déshydratation dans la circulation sanguine. De plus, il est 160 fois plus efficace que K17F pour produire cet effet (Gerbier et al., 2017). Ces données suggèrent que le LIT01-196, injecté par voie icv (comme le K17F), atteint rapidement les structures hypothalamiques, le PVN et le SON, et agit ensuite sur les Apéline-R exprimés par les neurones magnocellulaires vasopressinergiques pour inhiber la libération de l’AVP dans la circulation sanguine et augmenter la diurèse. Par ailleurs, dans le rein, au niveau du CD, le LIT01-196 diminue la production d’AMPc induite par la dDAVP et l’expression à la surface apicale de l’AQP2 phosphorylée, entraînant une diminution de la réabsorption d’eau et par conséquent une augmentation de la diurèse aqueuse (Gerbier et al., 2017; Flahault et al., 2021). Le LIT01-196 et le tolvaptan, un antagoniste des V2-R, à une dose équimolaire de 900 nmol/kg, augmentent de manière similaire, chez des rats normo-natrémiques, la diurèse sur 24 h (+79 % et +77 %, respectivement), et diminuent l’osmolalité urinaire (−52 % et −40 %, respectivement) (Flahault et al., 2021). L’accroissement de la diurèse est associé à une élévation significative de la consommation d’eau dans le groupe tolvaptan (+37 %) et à une légère augmentation non significative dans le groupe LIT01-196 (+11 %). La fraction d’excrétion urinaire de sodium n’est pas modifiée par l’administration de LIT01-196 ou de tolvaptan (Flahault et al., 2021). Parallèlement, le LIT01-196 induit, comme K17F, une vasorelaxation des artérioles juxtamédullaires qui donnent naissance aux vasa recta (Gerbier et al., 2017), suggérant que le LIT01-196 peut augmenter comme K17F le flux sanguin rénal et par conséquent la diurèse (Hus-Citharel et al., 2008). L’ensemble de ces données indique que le LIT01-196, par ses effets centraux et rénaux, est un aquarétique efficace qui pourrait être particulièrement utile pour le traitement des rétentions hydriques et de l’hyponatrémie.
Effets du LIT01-196 sur l’effet antidiurétique de l’AVP dans un modèle expérimental d’hyponatrémie
La perfusion continue d’AVP par voie sc (30 ng/h) chez des rats pendant 4 jours, associée à un régime semi-liquide, entraîne une diminution de la diurèse, une augmentation de l’osmolalité urinaire et une diminution des taux plasmatiques de sodium, qui restent stables autour de 100 mmol/L pendant 2–4 jours après le début de la perfusion. Le LIT01-196, administré pendant 2 jours par voie sc (900 nmol/kg) dans ce même modèle d’hyponatrémie, inhibe efficacement les effets de l’AVP sur la diurèse et l’osmolalité urinaire et induit une correction progressive des taux plasmatiques de sodium (Flahault et al., 2021). En accord avec les observations de Miyazaki et al. (2005), nous avons noté que le tolvaptan, à la même dose équimolaire, inhibe également les effets antidiurétiques de l’AVP. Cependant, si la dose de tolvaptan est augmentée, une élévation encore plus importante de la diurèse intervient, contrairement à ce qui est observé lorsque l’on accroît la dose de LIT01-196. Ces données suggèrent que le LIT01-196 inhibe la production accrue d’AMPc induite dans le CD par la perfusion continue de l’AVP. En conséquence, l’AQP2 n’est plus inséré massivement à la membrane apicale du CD, ce qui entraîne l’inhibition de la réabsorption d’eau par le rein, une augmentation de la diurèse aqueuse et la correction progressive de l’hyponatrémie (Figure 5). Ainsi, l’activation de l’Apéline-R par le LIT01-196 et donc la modification de la balance apéline/AVP entraîneraient une polyurie moins sévère et peut-être mieux tolérée qu’avec le traitement par un antagoniste du V2-R tel que le tolvapan.
Les différents effets physiologiques associés à l’activation de l’Apéline-R résultent de celle de différentes voies de signalisation. Dans ce cadre, le développement d’analogues de K17F métaboliquement stables biaisés, qui ne pourraient cibler que la voie de signalisation Gi mise en jeu dans l’effet aquarétique de l’apéline, représente une stratégie intéressante pour améliorer leur spécificité d’action sur le métabolisme de l’eau.
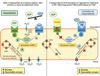 |
Figure 5 Effets du LIT01-196 sur les cellules principales du canal collecteur dans le SIAD. Dans un modèle experimental de SIAD, la sécrétion de l’AVP dans la circulation sanguine est trop élevée par rapport à l’osmolalité plasmatique. En se fixant sur le V2-R présent dans le canal collecteur, l’AVP augmente la production d’AMPc, la mobilisation de l’aquaporine 2 (AQP2) à la membrane apicale et accroît la réabsorption d’eau, entraînant une hyponatrémie. L’administration du LIT01-196, un analogue métaboliquement stable de l’apéline-17 (K17F), en stimulant l’Apéline-R localisé dans les canaux collecteurs, inhibe la production d’AMPc induite par l’AVP, réduit la mobilisation de l’AQP2 à la membrane apicale et la réabsorption d’eau, augmentant ainsi la diurèse aqueuse. Ceci a pour conséquence d’améliorer progressivement l’hyponatrémie. |
Conclusions
La découverte de l’apéline comme ligand endogène du récepteur orphelin APJ constitue une avancée importante à la fois en termes de recherche fondamentale et d’applications cliniques. Sur le plan fondamental, elle représente un bon exemple de la validité de l’approche de « désorphanisation » des récepteurs orphelins pour l’identification de nouveaux peptides bioactifs et de nouvelles cibles thérapeutiques. Les données expérimentales obtenues jusqu’ici démontrent que l’apéline exerce une action aquarétique par des effets centraux et rénaux : par son rôle inhibiteur sur l’activité phasique des neurones vasopressinergiques et la sécrétion de l’AVP dans la circulation sanguine et par son action directe au niveau du rein en augmentant le flux sanguin dans cet organe et en inhibant au niveau tubulaire l’effet antidiurétique de l’AVP médié par les V2-R. De plus, à la suite d’une déshydratation ou d’une charge aqueuse, chez l’Homme comme chez les rongeurs, l’AVP et l’apéline sont inversement régulées pour, soit optimiser la libération systémique d’AVP et éviter ainsi une perte d’eau supplémentaire au niveau des reins lors de la déshydratation, soit faciliter la libération de l’apéline pour augmenter l’élimination d’eau afin de rétablir un équilibre hydrique lors d’une charge aqueuse. Ces données montrent que l’apéline, comme l’AVP, joue un rôle crucial dans le maintien de l’équilibre hydrique aussi bien chez l’Homme que chez les rongeurs. Sur le plan clinique, chez les patients SIAD, l’équilibre apéline/AVP est altéré, ce qui contribue au défaut du métabolisme de l’eau. Dans un modèle expérimental d’hyponatrémie, le traitement par un analogue de l’apéline-17 métaboliquement stable, le LIT01-196, inhibe l’effet antidiurétique de l’AVP, augmente la diurèse aqueuse et modérément la prise d’eau et corrige progressivement l’hyponatrémie. Ainsi, l’activation de l’Apéline-R par le LIT01-196 pourrait constituer une nouvelle approche thérapeutique pour le traitement de l’hyponatrémie.
Abréviations
AngI, AngII, AngIII : Angiotensine I, II, III
AT1 : Récepteur de l’angiotensine II/III de type 1
Apéline-R : Récepteur de l’apéline
AVP : Arginine-vasopressine (hormone antidiurétique)
[Ca2+]i : Calcium intracellulaire
icv : Intracérébroventriculaire
RCPG : Récepteur couplé aux protéines G
SIAD : Syndrome d’antidiurèse inappropriée
V1-R : Récepteur de la vasopressine de type 1
V2-R : Récepteur de la vasopressine de type 2
Références
- Azizi, M., Iturrioz, X., Blanchard, A., Peyrard, S., De Mota, N., Chartrel, N., Vaudry, H., Corvol, P., Llorens-Cortès, C. (2008). Reciprocal regulation of plasma apelin and vasopressin by osmotic stimuli. J Am Soc Nephrol, 19, 1015-1024. [CrossRef] [PubMed] [Google Scholar]
- Bai, B., Tang, J., Liu, H., Chen, J., Li, Y., Song, W. (2008). Apelin-13 induces ERK1/2 but not p38 MAPK activation through coupling of the human apelin receptor to the Gi2 pathway. Acta Biochim Biophys Sin (Shanghai), 40, 311-318. [CrossRef] [PubMed] [Google Scholar]
- Blanchard, A., Steichen, O., De Mota, N., Curis, E., Gauci, C., Frank, M., Wuerzner, G., Kamenicky, P., Passeron, A., Azizi, M., Llorens-Cortès, C. (2013). An abnormal apelin/vasopressin balance may contribute to water retention in patients with the syndrome of inappropriate antidiuretic hormone (SIADH) and heart failure. J Clin Endocrinol Metab, 98, 2084-2089. [CrossRef] [PubMed] [Google Scholar]
- Boulkeroua, C., Ayari, H., Khalfaoui, T., Lafrance, M., Besserer-Offroy, É., Ekindi, N., Sabbagh, R., Dumaine, R., Lesur, O., Sarret, P., Chraibi, A. (2019). Apelin-13 Regulates Vasopressin-Induced Aquaporin-2 Expression and Trafficking in Kidney Collecting Duct Cells. Cell Physiol Biochem, 53, 687-700. [CrossRef] [PubMed] [Google Scholar]
- Brailoiu, G.C., Dun, S.L., Yang, J., Ohsawa, M., Chang, J.K., Dun, N.J. (2002). Apelin-immunoreactivity in the rat hypothalamus and pituitary. Neurosci Lett, 327, 193-197. [CrossRef] [PubMed] [Google Scholar]
- Brame, A.L., Maguire, J.J., Yang, P., Dyson, A., Torella, R., Cheriyan, J., Singer, M., Glen, R.C., Wilkinson, I.B., Davenport, A.P. (2015). Design, characterization, and first-in-human study of the vascular actions of a novel biased apelin receptor agonist. Hypertension, 65, 834-840. [CrossRef] [PubMed] [Google Scholar]
- Brownstein, M.J., Russell, J.T., Gainer, H. (1980). Synthesis, transport, and release of posterior pituitary hormones. Science, 207, 373-378. [CrossRef] [PubMed] [Google Scholar]
- Ceraudo, E., Galanth, C., Carpentier, E., Banegas-Font, I., Schonegge, A.-M., Alvear-Perez, R., Iturrioz, X., Bouvier, M., Llorens-Cortès, C. (2014). Biased signaling favoring gi over β-arrestin promoted by an apelin fragment lacking the C-terminal phenylalanine. J Biol Chem, 289, 24599-24610. [CrossRef] [PubMed] [Google Scholar]
- Chen, X., Bai, B., Tian, Y., Du, H., Chen, J. (2014). Identification of serine 348 on the apelin receptor as a novel regulatory phosphorylation site in apelin-13-induced G protein-independent biased signaling. J Biol Chem, 289, 31173-31187. [CrossRef] [PubMed] [Google Scholar]
- Chen, Y., Xu, C., Hu, J., Deng, M., Qiu, Q., Mo, S., Du, Y., Yang, T. (2021). Diuretic Action of Apelin-13 Mediated by Inhibiting cAMP/PKA/sPRR Pathway. Front Physiol, 12, 642274. [CrossRef] [PubMed] [Google Scholar]
- Choe, W., Albright, A., Sulcove, J., Jaffer, S., Hesselgesser, J., Lavi, E., Crino, P., Kolson, D.L. (2000) Functional expression of the seven-transmembrane HIV-1 co-receptor APJ in neural cells. J Neurovirol, 6, S61-S69. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Clarke, K.J., Whitaker, K.W., Reyes, T.M. (2009) Diminished metabolic responses to centrally-administered apelin-13 in diet-induced obese rats fed a high-fat diet. J Neuroendocrinol, 21, 83-89. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- D’Aniello, C., Lonardo, E., Iaconis, S., Guardiola, O., Liguoro, A.M., Liguori, G.L., Autiero, M., Carmeliet, P., Minchiotti, G. (2009). G protein-coupled receptor APJ and its ligand apelin act downstream of Cripto to specify embryonic stem cells toward the cardiac lineage through extracellular signal-regulated kinase/p70S6 kinase signaling pathway. Circ Res, 105, 231-238. [CrossRef] [PubMed] [Google Scholar]
- De Falco, M., De Luca, L., Onori, N., Cavallotti, I., Artigiano, F., Esposito, V., De Luca, B., Laforgia, V., Groeger, A.M., De Luca, A. (2002). Apelin expression in normal human tissues. In Vivo, 16, 333-336. [Google Scholar]
- De Mota, N., Lenkei, Z., Llorens-Cortès, C. (2000). Cloning, pharmacological characterization and brain distribution of the rat apelin receptor. Neuroendocrinology, 72, 400-407. [CrossRef] [PubMed] [Google Scholar]
- De Mota, N., Réaux-Le Goazigo, A., El Messari, S., Chartrel, N., Roesch, D., Dujardin, C., Kordon, C., Vaudry, H., Moos, F., Llorens-Cortès, C. (2004). Apelin, a potent diuretic neuropeptide counteracting vasopressin actions through inhibition of vasopressin neuron activity and vasopressin release. Proc Natl Acad Sci USA, 101, 10464-10469. [Google Scholar]
- Denton, D.A., McKinley, M.J., Weisinger, R.S. (1996). Hypothalamic integration of body fluid regulation. Proc Natl Acad Sci USA, 93, 7397-7404. [CrossRef] [PubMed] [Google Scholar]
- Devic, E., Rizzoti, K., Bodin, S., Knibiehler, B., Audigier, Y. (1999). Amino acid sequence and embryonic expression of msr/apj, the mouse homolog of Xenopus X-msr and human APJ. Mech Dev, 84, 199-203. [CrossRef] [PubMed] [Google Scholar]
- El Messari, S., Iturrioz, X., Fassot, C., De Mota, N., Roesch, D., Llorens-Cortès, C. (2004). Functional dissociation of apelin receptor signaling and endocytosis: implications for the effects of apelin on arterial blood pressure. J Neurochem, 90, 1290-1301. [CrossRef] [PubMed] [Google Scholar]
- Ellison, D.H., Berl, T. (2007). Clinical practice. The syndrome of inappropriate antidiuresis. N Engl J Med, 356, 2064-2072. [CrossRef] [PubMed] [Google Scholar]
- Evans, N.A., Groarke, D.A., Warrack, J., Greenwood, C.J., Dodgson, K., Milligan, G., Wilson, S. (2001). Visualizing differences in ligand-induced beta-arrestin-GFP interactions and trafficking between three recently characterized G protein-coupled receptors. J Neurochem, 77, 476-485. [CrossRef] [PubMed] [Google Scholar]
- Eyries, M., Siegfried, G., Ciumas, M., Montagne, K., Agrapart, M., Lebrin, F., Soubrier, F. (2008). Hypoxia-induced apelin expression regulates endothelial cell proliferation and regenerative angiogenesis. Circ Res, 103, 432-440. [CrossRef] [PubMed] [Google Scholar]
- Fischer, C., Lamer, T., Fernandez, K., Gheblawi, M., Wang, W., Pascoe, C., Lambkin, G., Iturrioz, X., Llorens-Cortès, C., Oudit, G.Y., Vederas, J.C. (2020). Optimizing PEG-extended apelin analogues as cardioprotective drug leads: Importance of the KFRR motif and aromatic head group for improved physiological activity. J Med Chem, 63, 12073-12082. [CrossRef] [PubMed] [Google Scholar]
- Fischer, C., Lamer, T., Wang, W., McKinnie, S.M.K., Iturrioz, X., Llorens-Cortès, C., Oudit, G.Y., Vederas, J.C. (2019). Plasma kallikrein cleaves and inactivates apelin-17: Palmitoyl- and PEG-extended apelin-17 analogs as metabolically stable blood pressure-lowering agents. Eur J Med Chem, 166, 119-124. [CrossRef] [PubMed] [Google Scholar]
- Flahault, A., Girault-Sotias, P.-E., Keck, M., Alvear-Perez, R., De Mota, N., Estéoulle, L., Ramanoudjame, S.M., Iturrioz, X., Bonnet, D., Llorens-Cortès, C. (2021). A metabolically stable apelin-17 analog decreases AVP-induced antidiuresis and improves hyponatremia. Nat Commun, 12, 305. [CrossRef] [PubMed] [Google Scholar]
- Galon-Tilleman, H., Yang, H., Bednarek, M.A., Spurlock, S.M., Paavola, K.J., Ko, B., To, C., Luo, J., Tian, H., Jermutus, L., Grimsby, J., Rondinone, C.M., Konkar, A., Kaplan, D.D. (2017). Apelin-36 modulates blood glucose and body weight independently of canonical APJ receptor signaling. J Biol Chem, 292, 1925-1933. [CrossRef] [PubMed] [Google Scholar]
- Gerbier, R., Alvear-Perez, R., Margathe, J.-F., Flahault, A., Couvineau, P., Gao, J., De Mota, N., Dabire, H., Li, B., Ceraudo, E., Hus-Citharel, A., Esteoulle, L., Bisoo, C., Hibert, M., Berdeaux, A., Iturrioz, X., Bonnet, D., Llorens-Cortès, C. (2017). Development of original metabolically stable apelin-17 analogs with diuretic and cardiovascular effects. FASEB J, 31, 687-700. [CrossRef] [PubMed] [Google Scholar]
- Gerbier, R., Leroux, V., Couvineau, P., Alvear-Perez, R., Maigret, B., Llorens-Cortès, C., Iturrioz, X. (2015). New structural insights into the apelin receptor: identification of key residues for apelin binding. FASEB J, 29, 314-322. [CrossRef] [PubMed] [Google Scholar]
- Gimpl, G., Fahrenholz, F. (2001). The oxytocin receptor system: structure, function, and regulation. Physiol Rev, 81, 629-683. [CrossRef] [PubMed] [Google Scholar]
- Gouzènes, L., Desarménien, M.G., Hussy, N., Richard, P., Moos, F.C. (1998). Vasopressin regularizes the phasic firing pattern of rat hypothalamic magnocellular vasopressin neurons. J Neurosci, 18, 1879-1885. [CrossRef] [PubMed] [Google Scholar]
- Habata, Y., Fujii, R., Hosoya, M., Fukusumi, S., Kawamata, Y., Hinuma, S., Kitada, C., Nishizawa, N., Murosaki, S., Kurokawa, T., Onda, H., Tatemoto, K., Fujino, M. (1999). Apelin, the natural ligand of the orphan receptor APJ, is abundantly secreted in the colostrum. Biochim Biophys Acta, 1452, 25-35. [CrossRef] [PubMed] [Google Scholar]
- Hosoya, M., Kawamata, Y., Fukusumi, S., Fujii, R., Habata, Y., Hinuma, S., Kitada, C., Honda, S., Kurokawa, T., Onda, H., Nishimura, O., Fujino, M. (2000). Molecular and functional characteristics of APJ. Tissue distribution of mRNA and interaction with the endogenous ligand apelin. J Biol Chem, 275, 21061-21067. [CrossRef] [PubMed] [Google Scholar]
- Hurbin, A., Boissin-Agasse, L., Orcel, H., Rabié, A., Joux, N., Desarménien, M.G., Richard, P., Moos, F.C. (1998). The V1a and V1b, but not V2, vasopressin receptor genes are expressed in the supraoptic nucleus of the rat hypothalamus, and the transcripts are essentially colocalized in the vasopressinergic magnocellular neurons. Endocrinology, 139, 4701-4707. [CrossRef] [PubMed] [Google Scholar]
- Hus-Citharel, A., Bouby, N., Frugière, A., Bodineau, L., Gasc, J.-M., Llorens-Cortès, C. (2008). Effect of apelin on glomerular hemodynamic function in the rat kidney. Kidney Int, 74, 486-494. [CrossRef] [PubMed] [Google Scholar]
- Hus-Citharel, A., Bodineau, L., Frugière, A., Joubert, F., Bouby, N., Llorens-Cortès, C. (2014). Apelin counteracts vasopressin-induced water reabsorption via cross talk between apelin and vasopressin receptor signaling pathways in the rat collecting duct. Endocrinology, 155, 4483-4493. [CrossRef] [PubMed] [Google Scholar]
- Ishida, J., Hashimoto, T., Hashimoto, Y., Nishiwaki, S., Iguchi, T., Harada, S., Sugaya, T., Matsuzaki, H., Yamamoto, R., Shiota, N., Okunishi, H., Kihara, M., Umemura, S., Sugiyama, F., Yagami, K., Kasuya, Y., Mochizuki, N., Fukamizu, A. (2004) Regulatory Roles for APJ, a Seven-transmembrane Receptor Related to Angiotensin-type 1 Receptor in Blood Pressure in Vivo. J Biol Chem, 279, 26274-26279. [CrossRef] [PubMed] [Google Scholar]
- Iturrioz, X., Gerbier, R., Leroux, V., Alvear-Perez, R., Maigret, B., Llorens-Cortès, C. (2010). By interacting with the C-terminal Phe of apelin, Phe255 and Trp259 in helix VI of the apelin receptor are critical for internalization. J Biol Chem, 285, 32627-32637 [CrossRef] [PubMed] [Google Scholar]
- Japp, A.G., Cruden, N.L., Barnes, G., van Gemeren, N., Mathews, J., Adamson, J., Johnston, N.R., Denvir, M.A., Megson, I.L., Flapan, A.D., Newby, D.E. (2010). Acute cardiovascular effects of apelin in humans: Potential role in patients with chronic heart failure. Circulation, 121, 1818-1827. [CrossRef] [PubMed] [Google Scholar]
- Jia, Z.Q., Hou, L., Leger, A., Wu, I., Kudej, A.B., Stefano, J., Jiang, C., Pan, C.Q., Akita, G.Y. (2012). Cardiovascular effects of a PEGylated apelin. Peptides, 38, 181-188. [CrossRef] [PubMed] [Google Scholar]
- Johnson, A.K., Cunningham, J.T., Thunhorst, R.L. (1996). Integrative role of the lamina terminalis in the regulation of cardiovascular and body fluid homeostasis. Clin Exp Pharmacol Physiol, 23, 183-191. [CrossRef] [PubMed] [Google Scholar]
- Juhl, C., Els-Heindl, S., Schönauer, R., Redlich, G., Haaf, E., Wunder, F., Riedl, B., Burkhardt, N., Beck-Sickinger, A.G., Bierer, D. (2016). Development of potent and metabolically stable APJ ligands with high therapeutic potential. Chem Med Chem, 11, 2378-2384. [CrossRef] [Google Scholar]
- Kawamata, Y., Habata, Y., Fukusumi, S., Hosoya, M., Fujii, R., Hinuma, S., Nishizawa, N., Kitada, C., Onda, H., Nishimura, O., Fujino, M. (2001). Molecular properties of apelin: Tissue distribution and receptor binding. Biochim Biophys Acta, 1538, 162-171. [CrossRef] [PubMed] [Google Scholar]
- Kim, W.R., Biggins, S.W., Kremers, W.K., Wiesner, R.H., Kamath, P.S., Benson, J.T., Edwards, E., Therneau, T.M. (2008). Hyponatremia and mortality among patients on the liver-transplant waiting list. N Engl J Med, 359, 1018-1026. [CrossRef] [PubMed] [Google Scholar]
- Kleinz, M.J., Skepper, J.N., Davenport, A.P. (2005). Immunocytochemical localisation of the apelin receptor, APJ, to human cardiomyocytes, vascular smooth muscle and endothelial cells. Regul Pept, 126, 233-240. [CrossRef] [PubMed] [Google Scholar]
- Kovesdy, C.P., Lott, E.H., Lu, J.L., Malakauskas, S.M., Ma, J.Z., Molnar, M.Z., Kalantar-Zadeh, K. (2012). Hyponatremia, hypernatremia, and mortality in patients with chronic kidney disease with and without congestive heart failure. Circulation, 125, 677-684. [CrossRef] [PubMed] [Google Scholar]
- Lee, D.K., Cheng, R., Nguyen, T., Fan, T., Kariyawasam, A.P., Liu, Y., Osmond, D.H., George, S.R., O’Dowd, B.F. (2000). Characterization of apelin, the ligand for the APJ receptor. J Neurochem, 74, 34-41. [Google Scholar]
- Lee, D.K., Saldivia, V.R., Nguyen, T., Cheng, R., George, S.R., O’Dowd, B.F. (2005). Modification of the terminal residue of apelin-13 antagonizes its hypotensive action. Endocrinology, 146, 231-236. [CrossRef] [PubMed] [Google Scholar]
- Lee, D.K., Ferguson, S.S.G., George, S.R., O’Dowd, B.F. (2010). The fate of the internalized apelin receptor is determined by different isoforms of apelin mediating differential interaction with beta-arrestin. Biochem Biophys Res Commun, 395, 185-189. [CrossRef] [PubMed] [Google Scholar]
- Llorens-Cortès, C., Moos, F. (2012). Apelin and vasopressin: two work better than one. J Neuroendocrinol, 24, 1085-1086. [CrossRef] [PubMed] [Google Scholar]
- Ludwig, M. (1998). Dendritic release of vasopressin and oxytocin. J Neuroendocrinol, 10, 881-895. [CrossRef] [PubMed] [Google Scholar]
- Manning, M., Lowbridge, J., Haldar, J., Sawyer, W.H. (1977). Design of neurohypophyseal peptides that exhibit selective agonistic and antagonistic properties. Fed Proc, 36, 1848-1852. [PubMed] [Google Scholar]
- Masri, B., Lahlou, H., Mazarguil, H., Knibiehler, B., Audigier, Y. (2002). Apelin (65-77) activates extracellular signal-regulated kinases via a PTX-sensitive G protein. Biochem Biophys Res Commun, 290, 539-545. [CrossRef] [PubMed] [Google Scholar]
- Masri, B., Morin, N., Pedebernade, L., Knibiehler, B., Audigier, Y. (2006). The apelin receptor is coupled to Gi1 or Gi2 protein and is differentially desensitized by apelin fragments. J Biol Chem, 281, 18317-18326. [CrossRef] [PubMed] [Google Scholar]
- McKinnie, S.M.K., Fischer, C., Tran, K.M.H., Wang, W., Mosquera, F., Oudit, G.Y., Vederas, J.C. (2016). The metalloprotease neprilysin degrades and inactivates apelin peptides. Chembiochem, 17, 1495-1498. [CrossRef] [PubMed] [Google Scholar]
- Medhurst, A.D., Jennings, C.A., Robbins, M.J., Davis, R.P., Ellis, C., Winborn, K.Y., Lawrie, K.W.M., Hervieu, G., Riley, G., Bolaky, J.E., Herrity, N.C., Murdock, P., Darker, J.G. (2003). Pharmacological and immunohistochemical characterization of the APJ receptor and its endogenous ligand apelin. J Neurochem, 84, 1162-1172. [CrossRef] [PubMed] [Google Scholar]
- Miyazaki, T., Yamamura, Y., Onogawa, T., Nakamura, S., Kinoshita, S., Nakayama, S., Fujiki, H., Mori, T. (2005). Therapeutic effects of tolvaptan, a potent, selective nonpeptide vasopressin V2 receptor antagonist, in rats with acute and chronic severe hyponatremia. Endocrinology, 146, 3037-3043. [CrossRef] [PubMed] [Google Scholar]
- Morello, J.P., Bichet, D.G. (2001). Nephrogenic diabetes insipidus. Annu Rev Physiol, 63, 607-630. [CrossRef] [PubMed] [Google Scholar]
- Murza, A., Belleville, K., Longpré, J.-M., Sarret, P., Marsault, É. (2014). Stability and degradation patterns of chemically modified analogs of apelin-13 in plasma and cerebrospinal fluid. Biopolymers, 102, 297-303. [CrossRef] [PubMed] [Google Scholar]
- Murza, A., Besserer-Offroy, É., Côté, J., Bérubé, P., Longpré, J.-M., Dumaine, R., Lesur, O., Auger-Messier, M., Leduc, R., Sarret, P., Marsault, É. (2015). C-Terminal modifications of apelin-13 significantly change ligand binding, receptor signaling, and hypotensive action. J Med Chem, 58, 2431-2440. [CrossRef] [PubMed] [Google Scholar]
- Murza, A., Sainsily, X., Coquerel, D., Côté, J., Marx, P., Besserer-Offroy, É., Longpré, J.-M., Lainé, J., Reversade, B., Salvail, D., Leduc, R., Dumaine, R., Lesur, O., Auger-Messier, M., Sarret, P., Marsault, E. (2016). Discovery and structure-activity relationship of a bioactive fragment of ELABELA that modulates vascular and cardiac functions. J Med Chem, 59, 2962-2972. [CrossRef] [PubMed] [Google Scholar]
- Murza, A., Sainsily, X., Côté, J., Bruneau-Cossette, L., Besserer-Offroy, É., Longpré, J.-M., Leduc, R., Dumaine, R., Lesur, O., Auger-Messier, M., Sarret, P., Marsault, É. (2017). Structure-activity relationship of novel macrocyclic biased apelin receptor agonists. Org Biomol Chem, 15, 449-458. [CrossRef] [MathSciNet] [PubMed] [Google Scholar]
- Nielsen, S., Chou, C.L., Marples, D., Christensen, E.I., Kishore, B.K., Knepper, M.A. (1995). Vasopressin increases water permeability of kidney collecting duct by inducing translocation of aquaporin-CD water channels to plasma membrane. Proc Natl Acad Sci USA, 92, 1013-1017. [CrossRef] [PubMed] [Google Scholar]
- O’Carroll, A.-M., Lolait, S.J. (2003). Regulation of rat APJ receptor messenger ribonucleic acid expression in magnocellular neurones of the paraventricular and supraopric nuclei by osmotic stimuli. J Neuroendocrinol, 15, 661-666. [CrossRef] [PubMed] [Google Scholar]
- O’Carroll, A.-M., Salih, S., Griffiths, P.R., Bijabhai, A., Knepper, M.A., Lolait, S.J. (2017). Expression and functional implications of the renal apelinergic system in rodents. PLoS One, 12, e0183094. [CrossRef] [PubMed] [Google Scholar]
- O’Carroll, A.M., Selby, T.L., Palkovits, M., Lolait, S.J. (2000). Distribution of mRNA encoding B78/apj, the rat homologue of the human APJ receptor, and its endogenous ligand apelin in brain and peripheral tissues. Biochim Biophys Acta, 1492, 72-80. [CrossRef] [MathSciNet] [Google Scholar]
- O’Dowd, B.F., Heiber, M., Chan, A., Heng, H.H., Tsui, L.C., Kennedy, J.L., Shi, X., Petronis, A., George, S.R., Nguyen, T. (1993). A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11. Gene, 136, 355-360. [CrossRef] [PubMed] [Google Scholar]
- O’Harte, F.P.M., Flatt, P.R. (2015). Patent: Apelin analogues – WO 2015/165936 Al. [Google Scholar]
- Ostrowski, N.L., Lolait, S.J., Bradley, D.J., O’Carroll, A.M., Brownstein, M.J., Young, W.S. (1992). Distribution of V1a and V2 vasopressin receptor messenger ribonucleic acids in rat liver, kidney, pituitary and brain. Endocrinology, 131, 533-535. [CrossRef] [PubMed] [Google Scholar]
- Peri, A. (2019). Management of hyponatremia: causes, clinical aspects, differential diagnosis and treatment. Expert Rev Endocrinol Metab, 14, 13-21. [CrossRef] [PubMed] [Google Scholar]
- Poulain, D.A., Wakerley, J.B., Dyball, R.E. (1977). Electrophysiological differentiation of oxytocin- and vasopressin-secreting neurones. Proc R Soc Lond B Biol Sci, 196, 367-384. [CrossRef] [PubMed] [Google Scholar]
- Réaux, A., De Mota, N., Skultetyova, I., Lenkei, Z., El Messari, S., Gallatz, K., Corvol, P., Palkovits, M., Llorens-Cortès, C. (2001). Physiological role of a novel neuropeptide, apelin, and its receptor in the rat brain. J Neurochem, 77, 1085-1096. [CrossRef] [PubMed] [Google Scholar]
- Réaux, A., Gallatz, K., Palkovits, M., Llorens-Cortès, C. (2002). Distribution of apelin-synthesizing neurons in the adult rat brain. Neuroscience, 113, 653-662. [CrossRef] [PubMed] [Google Scholar]
- Réaux-Le Goazigo, A., Morinville, A., Burlet, A., Llorens-Cortès, C., Beaudet, A. (2004). Dehydration-induced cross-regulation of apelin and vasopressin immunoreactivity levels in magnocellular hypothalamic neurons. Endocrinology, 145, 4392-4400. [CrossRef] [PubMed] [Google Scholar]
- Ripoll, E., Pluvinet, R., Torras, J., Olivar, R., Vidal, A., Franquesa, M., Cassis, L., Cruzado, J.M., Bestard, O., Grinyó, J.M., Aran, J.M., Herrero-Fresneda, I. (2011). In vivo therapeutic efficacy of intra-renal CD40 silencing in a model of humoral acute rejection. Gene Ther, 18, 945-952. [CrossRef] [PubMed] [Google Scholar]
- Roberts, E.M., Newson, M.J.F., Pope, G.R., Landgraf, R., Lolait, S.J., O’Carroll, A.-M. (2009). Abnormal fluid homeostasis in apelin receptor knockout mice. J Endocrinol, 202, 453-462. [CrossRef] [PubMed] [Google Scholar]
- Sands, J.M., Naruse, M., Baum, M., Jo, I., Hebert, S.C., Brown, E.M., Harris, H.W. (1997). Apical extracellular calcium/polyvalent cation-sensing receptor regulates vasopressin-elicited water permeability in rat kidney inner medullary collecting duct. J Clin Invest, 99, 1399-1405. [CrossRef] [PubMed] [Google Scholar]
- Tatemoto, K., Hosoya, M., Habata, Y., Fujii, R., Kakegawa, T., Zou, M.X., Kawamata, Y., Fukusumi, S., Hinuma, S., Kitada, C., Kurokawa, T., Onda, H., Fujino, M. (1998). Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor. Biochem Biophys Res Commun, 251, 471-476. [CrossRef] [PubMed] [Google Scholar]
- Tatemoto, K., Takayama, K., Zou, M.-X., Kumaki, I., Zhang, W., Kumano, K., Fujimiya, M. (2001). The novel peptide apelin lowers blood pressure via a nitric oxide-dependent mechanism. Regulatory Peptides, 99, 87-92. [CrossRef] [PubMed] [Google Scholar]
- Terada, Y., Tomita, K., Nonoguchi, H., Yang, T., Marumo, F. (1993). Different localization and regulation of two types of vasopressin receptor messenger RNA in microdissected rat nephron segments using reverse transcription polymerase chain reaction. J Clin Invest, 92, 2339-2345. [CrossRef] [PubMed] [Google Scholar]
- Trân, K., Murza, A., Sainsily, X., Coquerel, D., Côté, J., Belleville, K., Haroune, L., Longpré, J.-M., Dumaine, R., Salvail, D., Lesur, O., Auger-Messier, M., Sarret, P., Marsault, É. (2018). A systematic exploration of macrocyclization in Apelin-13: Impact on binding, signaling, stability, and cardiovascular effects. J Med Chem, 61, 2266-2277. [CrossRef] [PubMed] [Google Scholar]
- Verbalis, J.G. (2019). Euvolemic hyponatremia secondary to the syndrome of inappropriate antidiuresis. Front Horm Res, 52, 61-79. [CrossRef] [PubMed] [Google Scholar]
- Verbalis, J.G., Goldsmith, S.R., Greenberg, A., Korzelius, C., Schrier, R.W., Sterns, R.H., Thompson, C.J. (2013). Diagnosis, evaluation, and treatment of hyponatremia: expert panel recommendations. Am J Med, 126, S1-42. [CrossRef] [PubMed] [Google Scholar]
- Waikar, S.S., Mount, D.B., Curhan, G.C. (2009). Mortality after hospitalization with mild, moderate, and severe hyponatremia. Am J Med, 122, 857-865. [CrossRef] [PubMed] [Google Scholar]
- Wang, W., McKinnie, S.M.K., Farhan, M., Paul, M., McDonald, T., McLean, B., Llorens-Cortès, C., Hazra, S., Murray, A.G., Vederas, J.C., Oudit, G.Y. (2016). Angiotensin-converting enzyme 2 metabolizes and partially inactivates Pyr-Apelin-13 and Apelin-17: Physiological effects in the cardiovascular system. Hypertension, 68, 365-377. [CrossRef] [PubMed] [Google Scholar]
- Xu, C., Wang, F., Chen, Y., Xie, S., Sng, D., Reversade, B., Yang, T. (2020). ELABELA antagonizes intrarenal renin-angiotensin system to lower blood pressure and protects against renal injury. Am J Physiol Renal Physiol, 318, F1122- F1135. [CrossRef] [PubMed] [Google Scholar]
- Zhou, N., Fan, X., Mukhtar, M., Fang, J., Patel, C.A., DuBois, G.C., Pomerantz, R.J. (2003a). Cell-cell fusion and internalization of the CNS-based, HIV-1 co-receptor, APJ. Virology, 307, 22-36 [CrossRef] [Google Scholar]
- Zhou, N., Zhang, X., Fan, X., Argyris, E., Fang, J., Acheampong, E., DuBois, G.C., Pomerantz, R.J. (2003b). The N-terminal domain of APJ, a CNS-based coreceptor for HIV-1, is essential for its receptor function and coreceptor activity. Virology, 317, 84-94. [CrossRef] [Google Scholar]
- Zini, S., Fournie-Zaluski, M.C., Chauvel, E., Roques, B.P., Corvol, P., Llorens-Cortès, C. (1996). Identification of metabolic pathways of brain angiotensin II and III using specific aminopeptidase inhibitors: predominant role of angiotensin III in the control of vasopressin release. Proc Natl Acad Sci USA, 93, 11968-11973. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article: Girault-Sotias, P.-E., De Mota, N., et Llorens-Cortès, C. (2021). Rôle physiologique du récepteur de l’apéline : Implication dans le maintien de l’équilibre hydrique et de l’hyponatrémie. Biologie Aujourd’hui, 215, 119-132
Liste des figures
 |
Figure 1 Séquence primaire du précurseur de l’apéline, la préproapéline, chez l’Homme, le bœuf, le rat et la souris. Chez ces espèces, l’alignement des séquences en acides aminés a révélé une conservation stricte des 17 derniers acides aminés carboxyterminaux (en gras) correspondant à l’apéline 17 ou K17F. In vivo, la préproapéline donne naissance à plusiers formes moléculaires d’apéline qui diffèrent par leur longueur, comprenant soit les 36, les 17 ou les 13 derniers acides aminés de l’extremité C-terminale du précurseur. In vivo, l’apéline 13 (Q13F) est spontanément pyroglutamylée en pE13F. |
| Dans le texte | |
 |
Figure 2 Action centrale de l’apéline sur l’activité des neurones magnocellulaires vasopressinergiques, la libération systémique d’AVP et la diurèse. L’apéline et son récepteur (vert) colocalisent avec l’AVP et son récepteur V1-R (rouge) au sein des neurones magnocellulaires vasopressinergiques des noyaux paraventriculaire (PVN) et supraoptique (SON). Chez la ratte en lactation, K17F inhibe l’activité électrique phasique de ces neurones et la sécrétion de l’AVP de l’hypophyse postérieure dans la circulation sanguine, ce qui provoque au niveau rénal une augmentation de la diurèse aqueuse. |
| Dans le texte | |
 |
Figure 3 Régulation de l’apéline et de la vasopressine dans les conditions physiologiques, au cours de la déshydratation/perfusion de soluté salé hypertonique ou lors d’une charge aqueuse. Dans les conditions physiologiques, l’apéline (vert) et l’AVP (violet) sont libérées par les neurones magnocellulaires vasopressinergiques à des niveaux appropriés pour l’osmolalité plasmatique. Dans le canal collecteur du rein, l’AVP agit sur les V2-R pour augmenter la production d’AMPc et l’insertion de l’aquaporine 2 (AQP2) à la membrane apicale, conduisant à la réabsorption d’eau. À l’inverse, l’apéline, par son action sur l’Apéline-R, a un effet opposé. Dans des conditions physiologiques, la réabsorption d’eau est adéquate et les concentrations plasmatiques de sodium sont normales. À la suite d’une déshydratation, les neurones vasopressinergiques sont fortement activés et l’AVP est libérée dans la circulation sanguine plus rapidement qu’elle n’est synthétisée, entraînant une diminution du contenu neuronal en AVP, tandis que l’apéline s’accumule dans les neurones plutôt que d’être libérée. En revanche, lors d’une charge hydrique, les neurones sont inhibés, ce qui arrête la libération d’AVP et entraîne une accumulation du contenu neuronal en AVP. À l’inverse, la libération d’apéline dans la circulation sanguine augmente rapidement, ce qui entraîne une diminution du contenu neuronal en apéline. Ainsi, les niveaux d’apéline et d’AVP sont régulés de façon opposée par les stimuli osmotiques. Cette figure a été modifiée avec l’autorisation de Llorens-Cortès et Moos (Llorens-Cortès & Moos, 2012), disponible sur https://onlinelibrary.wiley.com/doi/epdf/10.1111/j.1365-2826.2012.02316.x. |
| Dans le texte | |
 |
Figure 4 Corrélations linéaires entre les concentrations plasmatiques d’AVP et d’apéline et l’osmolalité plasmatique. (A) entre la concentration plasmatique d’AVP et l’osmolalité plasmatique ; (B) entre la concentration plasmatique d’apéline et l’osmolalité plasmatique, chez des patients volontaires sains après une perfusion de soluté salé hypertonique ou une charge hydrique. |
| Dans le texte | |
 |
Figure 5 Effets du LIT01-196 sur les cellules principales du canal collecteur dans le SIAD. Dans un modèle experimental de SIAD, la sécrétion de l’AVP dans la circulation sanguine est trop élevée par rapport à l’osmolalité plasmatique. En se fixant sur le V2-R présent dans le canal collecteur, l’AVP augmente la production d’AMPc, la mobilisation de l’aquaporine 2 (AQP2) à la membrane apicale et accroît la réabsorption d’eau, entraînant une hyponatrémie. L’administration du LIT01-196, un analogue métaboliquement stable de l’apéline-17 (K17F), en stimulant l’Apéline-R localisé dans les canaux collecteurs, inhibe la production d’AMPc induite par l’AVP, réduit la mobilisation de l’AQP2 à la membrane apicale et la réabsorption d’eau, augmentant ainsi la diurèse aqueuse. Ceci a pour conséquence d’améliorer progressivement l’hyponatrémie. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


