| Numéro |
Biologie Aujourd’hui
Volume 213, Numéro 1-2, 2019
|
|
|---|---|---|
| Page(s) | 43 - 49 | |
| DOI | https://doi.org/10.1051/jbio/2019022 | |
| Publié en ligne | 5 juillet 2019 | |
Article
Mécanismes de régulation cérébrale impliqués dans la crise migraineuse
Brain network dysfunctions as substrates of primary headaches
1
Université Paris Descartes,
Paris, France
2
Institut de Psychiatrie et Neurosciences de Paris (IPNP), Inserm U1261,
102–108, rue de la Santé,
75014
Paris, France
* Auteur correspondant : luis.villanueva@inserm.fr
Reçu :
10
Juin
2019
L’aura migraineuse ainsi que le manque d’habituation aux stimuli hétéro-sensoriels suggèrent l’implication du cortex cérébral dans la pathogenèse migraineuse. D’autre part, les signes prémonitoires couramment observés chez les migraineux, tels que les perturbations du cycle veille-sommeil et les modifications de l’humeur, sont liés à une régulation hypothalamique. Nos études effectuées chez le rat ont permis de mettre en évidence plusieurs mécanismes de plasticité dysfonctionnelle au sein du tronc cérébral, de l’hypothalamus et du cortex cérébral à l’origine des céphalées migraineuses et algies vasculaires de la face. Une meilleure connaissance de ces mécanismes constitue un préalable nécessaire pour la mise en œuvre de nouvelles stratégies thérapeutiques dépourvues d’effets secondaires et/ou à visée prophylactique.
Abstract
A large body of clinical and pre-clinical evidence has shown complex interactions between bottom-up and top-down mechanisms that are essential for the discrimination of noxious information and pain perception. These endogenous systems, mainly originating from the brainstem, hypothalamus and cerebral cortex, are strongly influenced by behavioral, cognitive and emotional factors that are relevant for the survival of the individual. Under pathological conditions, however, dysfunctional engagement of these descending pathways certainly contributes to the transformation from acute into chronic pain states. In disorders such as primary headaches, dysfunctions affecting brain regulation mechanisms contribute to the generation of episodic painful states in susceptible individuals, and to the evolution from acute to chronic migraine or cluster headache. Taken together, these studies support the concept that CNS mechanisms that process trigemino-vascular pain do not consist only of a bottom-up process, whereby a painful focus modifies the inputs to the next higher level. Indeed, several CNS regions mediate subtle forms of plasticity by adjusting neural maps downstream and, consequently, altering all the modulatory mechanisms as a result of sensory, autonomic, endocrine, cognitive and emotional influences. Disturbances in normal sensory processing within these loops could lead to maladaptive changes and impaired craniofacial functions at the origin of primary headaches.
Mots clés : aura migraineuse / algie vasculaire de la face / sensibilisation centrale / stress / dépression corticale propagée
Key words: migraine aura / cluster headache / central sensitization / stress / cortical spreading depression
© Société de Biologie, 2019
Depuis la fin du 19e siècle, les recherches sur la douleur ont été fortement influencées par la théorie « spécifiste », proposant que chacune des sensations cutanées serait sous-tendue par des neurones répondant seulement à un type de stimulus et codant exclusivement une sous-modalité somato-sensorielle.
Ce cloisonnement strict a amené à mesurer les sensations indépendamment les unes des autres, sans considérer le rôle fondamental que jouent leurs interactions dans la perception des sensations douloureuses. Nos recherches ont contribué à conforter l’hypothèse selon laquelle les réseaux neuronaux qui intègrent les influx nociceptifs agissent de concert avec les systèmes de modulation, dès l’arrivée du message nociceptif dans le système nerveux central.
La perception de la douleur à l’origine des céphalées implique l’activation des fibres nociceptives méningées appartenant à la branche ophtalmique (V1) du nerf trijumeau. Ces nocicepteurs méningés, dont les corps cellulaires se trouvent dans le ganglion trigéminal, sont localisés autour des vaisseaux sanguins intracrâniens. La branche centrale des nocicepteurs active les neurones trigéminovasculaires, localisés dans les premiers segments de la moelle cervicale et le tronc cérébral (noyau spinal caudal du trijumeau, Sp5C ; figure 1), qui transfèrent l’information vers des structures thalamiques et corticales. Nos travaux ont montré qu’il existe également une puissante régulation descendante de l’activité des neurones du Sp5C, issue du tronc cérébral, de l’hypothalamus ainsi que du cortex cérébral (figure 2). Ces mécanismes de régulation centrale sont à l’origine de la grande variabilité des douleurs observées chez des patients ayant le même type de lésion tissulaire. Nous verrons ci-dessous que ces réseaux sont également impliqués dans la genèse et les mécanismes de sensibilisation centrale à l’origine des céphalées primaires telles que les migraines et algies vasculaires de la face (Villanueva & Noseda, 2013 ; Bourgeais et al., 2014).
Le tronc cérébral est à l’origine des contrôles inhibiteurs diffus induits par stimulation nociceptive (CIDN)
Un stimulus nociceptif appliqué sur n’importe quelle région corporelle déclenche la mise en jeu des CIDN. Les CIDN provoquent une inhibition puissante de l’activité de l’ensemble des neurones spinaux et du Sp5C (Villanueva & Le Bars, 1995). Nos travaux, effectués chez le rat, ont montré que les CIDN sont sous-tendus par une boucle de rétroaction (spino-trigémino)-bulbo-trigéminale (Villanueva et al., 1996 ; figure 2). Des études cliniques ont mis en évidence un substrat anatomique et fonctionnel analogue des CIDN chez l’homme (De Broucker et al., 1990). Les CIDN participent au masquage d’une douleur provoquée par un stimulus intense appliqué sur une autre partie du corps. Ce phénomène, connu depuis l’antiquité et souvent décrit sous le terme de « contre-stimulation », est à la base de traitements antalgiques traditionnels telles certaines formes d’acupuncture et de stimulation électrique transcutanée intense à basse fréquence ou électro-acupuncture (Bing et al., 1990 ; Villanueva & Le Bars, 1995). La découverte des CIDN, caractérisés notamment par leur remarquable reproductibilité, a suscité de nombreuses recherches cliniques et fondamentales sur leur plasticité dysfonctionnelle lors des douleurs chroniques. Le terme de « modulation douloureuse conditionnée » (Conditioned Pain Modulation, CPM) a été utilisé en clinique pour décrire le masquage d’un état douloureux chronique par un stimulus nociceptif appliqué sur une autre partie du corps. On a ainsi observé une diminution de la puissance de la CPM chez des patients ayant des douleurs dysfonctionnelles incluant la sphère trigéminale, notamment lors de migraines (Sandrini et al., 2006), d’algies vasculaires de la face (Perrotta et al., 2013), de céphalées tensionnelles (Pielsticker et al., 2005 ; Cathcart et al., 2010), de douleurs liées aux troubles de l’articulation temporo-mandibulaire (Maixner et al., 1995) et de douleurs trigéminales neuropathiques (Léonard et al., 2009). Les CIDN agissant sur les neurones du Sp5C sont abolis dans un modèle animal de céphalée induite par abus médicamenteux (Okada-Ogawa et al., 2009). Cette perte d’inhibition a été observée aussi dans des modèles animaux de douleur neuropathique impliquant des mécanismes sérotoninergiques et noradrénergiques (Bannister & Dickenson, 2017). La CPM a été également utilisée en recherche clinique comme un outil biomarqueur prédictif de l’occurrence de douleurs postopératoires et il semble donc raisonnable d’explorer la puissance de la CPM chez les patients migraineux dans le but d’établir des corrélations avec le degré d’efficacité d’un traitement préventif (Yarnitsky et al., 2014).
L’hypothalamus : une source de régulation impliquée dans les algies vasculaires de la face et les migraines
Grâce à ses connexions avec de nombreuses régions du système nerveux central, l’hypothalamus joue un rôle fondamental dans des multiples fonctions nécessaires au maintien de l’homéostasie, telles que le contrôle du système endocrinien et la coordination du système végétatif, constituant ainsi un véritable centre d’intégration des émotions et des motivations. La régulation hypothalamique des céphalées primaires a été d’abord proposée sur la base du lien possible entre les manifestations d’origine parasympathique observées dans les algies vasculaires de la face telles que l’injection conjonctivale, le larmoiement, la congestion nasale et le ptosis (Goadsby & Lipton, 1997) ainsi que dans les signes prémonitoires couramment observés chez les migraineux comme les perturbations du cycle veille-sommeil, les modifications de l’humeur, de l’appétit, de la soif et de la miction (Giffin et al., 2003). De nombreuses études anatomiques chez l’animal ont montré des liens entre l’hypothalamus et le Sp5C (Malick et al., 2000 ; Gauriau & Bernard, 2004 ; Robert et al., 2013).
La contribution directe de l’hypothalamus à la genèse des céphalées primaires a été suggérée par des études d’imagerie fonctionnelle montrant une augmentation d’activité hypothalamique chez des patients souffrant d’algies vasculaires de la face (May et al., 1998 ; Matharu et al., 2004) et des migraineux (Denuelle et al., 2007).
Nous avons identifié plusieurs réseaux neuronaux issus du noyau paraventriculaire de l’hypothalamus (PVN), une région clé dans la régulation autonome et hormonale de l’axe du stress, susceptibles d’être impliqués à la fois dans la régulation de l’homéostasie et dans le déclenchement des céphalées primaires (Robert et al., 2013 ; figure 3). La zone capsulaire du PVN projette directement sur les couches superficielles du Sp5C, lieu d’arrivée des afférences nociceptives méningées qui véhiculent les influx à l’origine des céphalées. Par ailleurs, les neurones préganglionnaires parasympathiques du noyau salivaire supérieur (SSN) sont densément innervés par le PVN. Le SSN régule, via le ganglion sphénopalatin, le tonus parasympathique des régions nasales et céphaliques incluant les terminaisons périvasculaires méningées. Ce tonus parasympathique est clairement exacerbé et potentialise la douleur provoquée pendant les crises de migraine et d’algies vasculaires de la face, probablement via une vasodilatation et la libération de molécules pro-inflammatoires dans plusieurs régions intracrâniennes, activant ainsi les nocicepteurs méningés et les neurones du Sp5C.
Nous avons mis en évidence la participation de mécanismes GABAergiques, PACAPergiques (PACAP : polypeptide activateur de l’adénylate cyclase pituitaire) et sérotoninergiques issus du PVN, dans la régulation des activités nociceptives trigémino-vasculaires au sein du Sp5C (Robert et al., 2013). Le PVN constitue non seulement un relais majeur dans la régulation neuroendocrinienne et neuro-végétative, mais serait également à l’origine de rétrocontrôles responsables de l’installation des états de douleurs trigéminales chroniques sous-tendues par des mécanismes de sensibilisation périphérique et centrale.
La population neuronale qui projette sur le Sp5C se situe dans la région du PVN répondant à la corticolibérine (Simmons & Swanson, 2009). Lors du stress aigu, la perte du frein GABAergique issu du PVN pourrait déclencher un mécanisme dysfonctionnel majeur à l’origine d’une hyperexcitabilité neuronale au sein du Sp5C, par lequel les céphalées primaires seraient générées principalement au niveau hypothalamique (Robert et al., 2013). Cette perte de la puissance inhibitrice GABAergique au niveau des neurones du PVN est due à une régulation négative du transporteur transmembranaire KCC2 provoquée spécifiquement par le stress (Bains et al., 2015). C’est ainsi que, dans des conditions de stress soutenu, le PVN constituerait un générateur central de douleurs chroniques associées aux comorbidités liées au stress et à la dépression, survenant sans lésion organique apparente, et parfois modulées par les rythmes biologiques comme la fibromyalgie, certaines douleurs myofasciales et les céphalées primaires.
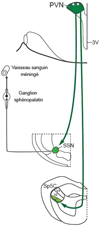 |
Figure 3 Les mécanismes de comorbidité à l’origine de nombreux syndromes douloureux chroniques associés à l’anxiété et à la dépression restent mal connus. Nous avons établi un lien direct entre le dysfonctionnement du noyau hypothalamique paraventriculaire (PVN) – région clé de la régulation autonome et hormonale de l’axe du stress – et le déclenchement des céphalées primaires. En effet, le PVN est la seule région hypothalamique qui régule simultanément l’excitabilité des neurones trigéminovasculaires (Sp5C) et l’activité d’une région bulbaire, le noyau salivaire supérieur (SSN), responsable de la régulation autonome, via le ganglion sphénopalatin, du tonus des vaisseaux sanguins méningés porteurs de nocicepteurs dans leur paroi. |
Cortex cérébral, modulation nociceptive et migraine
Les réactions comportementales liées aux sensations des organes internes (intéroception), incluant la douleur issue des méninges et les réactions émotionnelles qui en résultent, sont régulées de manière hiérarchique au niveau cérébral. Le premier niveau de régulation se situe dans l’hypothalamus, les cortex somatosensoriels et l’insula, tandis que le niveau suivant implique les cortex préfrontal et cingulaire (Critchley et al., 2001 ; Craig, 2005). L’impact des réactions comportementales sur la genèse de la sensation douloureuse dépend de la régulation corticale car l’ensemble des relais nociceptifs centraux qui se trouvent en amont du cortex subit cette influence. Contrairement aux contrôles descendants issus du tronc cérébral, la régulation corticale n’est pas dépendante d’une stimulation nociceptive mais peut être provoquée par des réactions comportementales d’origines diverses telles que la distraction, l’anticipation, l’hypnose ou celles en réponse à un placebo (Colloca & Benedetti, 2005 ; Garcia Larrea & Bastuji, 2018 ; Mouraux & Iannetti, 2018).
Dans les conditions physiologiques, les contrôles corticofuges participent au traitement de l’information somatosensorielle d’origine trigéminale. Par exemple, chez des singes éveillés entraînés à réaliser des tâches comportementales faisant l’objet d’une récompense, l’activité des neurones nociceptifs du Sp5C varie en fonction de la signification du stimulus. Si le stimulus est associé à une récompense, la réponse neuronale est plus importante. Ainsi, les neurones qui répondent à une stimulation thermique nociceptive peuvent être activés par un stimulus visuel ou moteur uniquement dans le cadre de la tâche comportementale, alors que l’intégration d’un stimulus visuel ou d’un mouvement de la main n’avait auparavant jamais été associée à l’activité neuronale dans le Sp5C (Bushnell et al., 1984 ; Duncan et al., 1987). Il semble donc qu’une information pertinente en relation avec l’environnement soit traitée dans des régions cérébrales impliquées dans le comportement de l’animal. Ainsi, l’activité neuronale du Sp5C peut dépendre entièrement du contexte environnemental dans lequel un signal sensoriel est reçu. Étant donné que des activités similaires, modulées par une tâche comportementale, ont été mises en évidence dans plusieurs aires corticales, ces modifications de l’activité trigéminale sont probablement dues aux mécanismes de modulation corticofuge sollicités lors des paradigmes comportementaux (Villanueva & Fields, 2004).
La participation du cortex somatosensoriel primaire (S1) dans la dimension sensori-discriminative de la douleur a été proposée à partir des données anatomiques montrant que des zones restreintes de S1 sont innervées par le thalamus ventrobasal (noyau ventro-postérolatéral, VPL ; noyau ventro-postéro-médian, VPM), qui reçoit directement les projections du faisceau spino (trigémino)-thalamique (Villanueva & Noseda, 2013). Des études anatomo-fonctionnelles suggèrent aussi que les activités corticales sont largement dépendantes des interactions réciproques existant avec leurs relais thalamiques, car il y a environ 10 fois plus de fibres qui projettent en retour du cortex au thalamus que celles innervant le cortex, en provenance du thalamus (Deschênes et al., 1998). L’impact de cette boucle de rétroaction massive a été observé lors de l’inactivation du cortex S1, qui provoque une modification des champs récepteurs somatosensoriels des neurones thalamiques ainsi qu’une limitation de leur capacité à se réorganiser après désafférentation des afférences trigéminales (Krupa et al., 1999). Nos études anatomo-fonctionnelles ont montré que la discrimination des modalités somatosensorielles (nociceptives ou non-nociceptives) au sein du cortex S1 s’exerce par le biais des boucles cortico-thalamiques, qui régulent simultanément et de façon sélective les réponses tactiles et nociceptives au sein du VPL, par l’intermédiaire de systèmes GABAergiques et glutamatergiques (Monconduit et al., 2006).
En dehors des boucles cortico-thalamiques, nos données montrent une innervation corticale directe, confinée à la région ophtalmique du Sp5C, strictement latéralisée et issue des cortex S1 et insulaire (Noseda et al., 2010 ; figure 4). Le cortex S1 innerve les couches profondes tandis que l’insula innerve seulement les couches superficielles du Sp5C, ces deux régions contenant l’ensemble des neurones nociceptifs trigémino-vasculaires. Il existe une relation étroite entre les projections du cortex insulaire, le récepteur 5-HT1D de la sérotonine et le CGRP (Calcitonin Gene-Related Peptide) dans le Sp5C. En revanche, une telle relation n’existe pas dans le cas des projections issues du cortex S1.
Par ailleurs, il a été proposé que la dépression corticale propagée (Cortical Spreading Depression, CSD) joue un rôle clé dans les attaques de migraine. La CSD est une vague lente de dépolarisation neuronale suivie d’une activation gliale (Smith et al., 2006), considérée à la fois comme le substrat physiopathologique de l’aura migraineuse et aussi comme un déclencheur probable de la céphalée migraineuse (Brennan & Pietrobon, 2018). Cependant, les mécanismes d’initiation et de propagation de la CSD ne sont que partiellement connus et le lien entre la CSD et la céphalée qui s’ensuit n’est pas clairement établi. Des études chez le rongeur suggèrent que les vagues de CSD déclenchent une inflammation neurogène et une sensibilisation des nocicepteurs méningés (Pietrobon & Moskowitz, 2013). Chez l’animal, la CSD peut être déclenchée par une stimulation locale intense du cortex cérébral, et se caractérise par une vague de dépolarisation neuronale qui se propage de façon lente (2–6 mm par minute) et soutenue à la surface du cortex. Cette dépolarisation est suivie d’une phase de dépression de l’activité neuronale qui peut durer quelques minutes. La phase de dépolarisation est associée à une augmentation du flux sanguin cérébral (hyperémie), tandis que la phase de dépression est liée à une réduction du flux sanguin (oligémie).
Chez l’homme, l’imagerie par résonance magnétique fonctionnelle mesurant le niveau d’oxygénation du sang (BOLD fMRI) a montré des changements du flux sanguin de type CSD dans le cortex occipital des migraineux pendant la phase d’aura visuelle. Bien que la pathogenèse exacte de la migraine ne soit pas encore connue, de nombreuses études cliniques suggèrent l’existence d’un état hyperexcitable caractérisé par un dysfonctionnement cortical qui peut être détecté dans les phases inter-critiques (Coppola et al., 2007). L’étude de modèles expérimentaux tels que les souris FMH (migraine hémiplégique familiale) a permis de déceler chez les rongeurs une sensibilité accrue à la CSD en liaison avec la physiopathologie migraineuse (van den Maagdenberg et al., 2004). Cette hypersensibilité à la CSD a été également mise en évidence dans un modèle murin de CADASIL, une maladie héréditaire des petites artères cérébrales dans laquelle on observe, avant l’apparition des lésions cérébrales, une incidence accrue de migraines avec aura (Eikermann-Haerter et al., 2001).
En accord avec l’organisation des réseaux cortico-trigéminaux issus des cortex S1 et insulaire, nous avons observé, chez le rat, que l’induction de la CSD dans le cortex S1 provoque l’inhibition à la fois des réponses tactiles cutanées et des réponses nociceptives méningées des neurones du Sp5C. En revanche, une facilitation sélective des réponses nociceptives méningées est provoquée lors de l’induction de la CSD au niveau du cortex insulaire. Enfin, la CSD déclenchée au niveau du cortex visuel primaire provoque un changement biphasique des réponses des neurones du Sp5C évoquées par les nocicepteurs méningés, lié à la diffusion de la CSD du cortex visuel aux cortex S1 et insulaire (Noseda et al., 2010). Récemment, le couplage de l’imagerie cérébrale à ultrasons avec l’électrophysiologie in vivo chez le rongeur nous a permis d’effectuer un suivi à haute résolution spatio-temporelle des mécanismes du dysfonctionnement cérébral provoqué par la CSD. Nos données préliminaires montrent que la régulation neurovasculaire ainsi que la cartographie sensorielle de la branche ophtalmique trigéminale au niveau des cortex S1 et insulaire sont profondément modifiées, de manière précise sur le plan spatio-temporel, à la suite d’une seule vague de CSD déclenchée à partir du cortex visuel primaire.
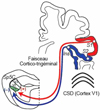 |
Figure 4 Modulation corticofuge directe des neurones trigéminovasculaires (Sp5C) qui véhiculent les messages nociceptifs des nocicepteurs méningés aux régions cérébrales impliquées dans le déclenchement des migraines. Nos études ont mis en évidence une régulation cortico-trigéminale excitatrice et inhibitrice sur le Sp5C, à partir des projections controlatérales issues respectivement du cortex S1 et du cortex insulaire. Ces projections corticales descendantes sont confinées dans la région ophtalmique du Sp5C, qui reçoit les afférences nociceptives méningées. La dépression corticale propagée (CSD) déclenchée à partir du cortex visuel primaire (V1) provoque d’abord une inhibition, suivie d’une amplification des décharges des neurones du Sp5C évoquées par la stimulation des méninges, tandis que les réponses évoquées par stimulation cutanée ne sont pas affectées. |
Conclusions
L’ensemble des travaux présentés ici montre que le système nerveux central constitue un système sélectif de reconnaissance qui permet de modifier l’information nociceptive afférente en fonction du contexte, de telle sorte que la spécificité d’une sensation douloureuse résulte d’une sélection a posteriori.
Les sensations et les réactions provoquées par une attaque de migraine résultent de mécanismes de type bottom-up et top-down étroitement imbriqués. Des régions hypothalamiques et corticales, en ajustant à la fois les cartes sensorielles thalamiques et pré-thalamiques, sont en mesure de modifier l’activité de l’ensemble des réseaux situés en amont. De fait, les études d’imagerie fonctionnelle montrent que les aires corticales ne sont pas simplement des récepteurs de l’information afférente mais participent activement à la modulation de divers aspects de la sensation douloureuse, en fonction de facteurs environnementaux (Mouraux & Iannetti, 2018).
En l’absence d’influx périphériques, les projections corticofuges pourraient générer des activités dans les relais situés en amont, et être ainsi à l’origine de phénomènes de simulation ou d’anticipation. Dans les conditions pathologiques, elles pourraient donc représenter un générateur central de douleurs qui surviennent sans lésion organique apparente ou bien en absence de stimulation nociceptive. Il est intéressant de souligner à cet égard le cas d’un patient présentant une insensibilité congénitale à la douleur qui a expérimenté une seule et unique attaque de céphalée intense, juste après la mort de son frère (Danziger & Willer, 2005). Cette observation est à rapprocher des données montrant que des mécanismes de modulation corticale de la douleur participent également au traitement des processus déclenchés par le stress de séparation ou d’exclusion lié à la perte d’un être cher. Les réseaux nociceptifs possèdent une activité somesthésique de base non seulement importante pour la douleur, mais qui fournit également une information en continu, essentielle pour l’homéostasie et la construction de notre schéma corporel, constamment sélectionnée et modulée en vue d’une réponse appropriée.
Sur la base d’une meilleure compréhension des mécanismes à l’origine des dysfonctionnements neuronaux et des comorbidités associées, il nous semble désormais possible d’aller au-delà des approches classiques d’analgésie expérimentale, visant essentiellement à réduire l’influx nociceptif. Les nouveaux modèles expérimentaux en cours de développement permettront de construire des outils translationnels directs pour développer des traitements prophylactiques des migraines, avec pour objectif de permettre aux réseaux nociceptifs cérébraux, une fois sensibilisés et devenus dysfonctionnels, de rebasculer vers un mode de fonctionnement délivré de la douleur.
Abréviations
CGRP : Calcitonin Gene-Related Peptide
CIDN : Contrôles Inhibiteurs Diffus Induit par stimulation Nociceptive
CPM : Conditioned Pain Modulation
CSD : Cortical Spreading Depression
PACAP : Polypeptide Activateur de l’Adénylate Cyclase Pituitaire
PVN : noyau paraventriculaire de l’hypothalamus
S1 : cortex somatosensoriel primaire
Sp5C : noyau spinal caudal du trijumeau
SSN : noyau salivaire supérieur
VPL : noyau ventro-postéro-latéral
VPM : noyau ventro-postéro-médian
Références
- Bains, J.S., Wamsteeker-Cusulin, J.I., Inoue, W. (2015). Stress-related synaptic plasticity in the hypothalamus. Nat Rev Neurosci, 16, 377-388. [CrossRef] [PubMed] [Google Scholar]
- Bannister, K., Dickenson, A.H. (2017). The plasticity of descending controls in pain: translational probing. J Physiol, 595, 4159-4166. [CrossRef] [PubMed] [Google Scholar]
- Bing, Z., Villanueva, L., Le Bars, D. (1990). Acupuncture and diffuse noxious inhibitory controls; naloxone reversible depression of activities of trigeminal convergent neurones. Neuroscience, 37, 809-818. [PubMed] [Google Scholar]
- Bourgeais, L., Arreto, C.D., Robert, C., Villanueva, L. Brain network dysfunctions as substrates of pain disorders: translational impact of animal studies. In: S.N. Raja, C.L. Sommer (Eds.), Refresher courses, 15th World Congress on Pain, IASP Press, Washington, DC, 2014, pp. 1-12. [Google Scholar]
- Brennan, K.C., Pietrobon, D. (2018). A systems neuroscience approach to migraine. Neuron, 97, 1004-1021. [CrossRef] [PubMed] [Google Scholar]
- Bushnell, M.C., Duncan, G.H., Dubner, R., He, L.F. (1984). Activity of trigeminothalamic neurons in medullary dorsal horn of awake monkeys trained in a thermal discrimination task. J Neurophysiol, 52, 170-187. [CrossRef] [PubMed] [Google Scholar]
- Cathcart, S., Winefield, A.H., Lushington, K, Rolan, P. (2010). Stress and tension-type headache mechanisms. Cephalalgia, 30, 1250-1267. [CrossRef] [PubMed] [Google Scholar]
- Colloca, L., Benedetti, F. (2005). Placebos and painkillers: is mind as real as matter? Nat Rev Neurosci, 6, 545-552. [CrossRef] [PubMed] [Google Scholar]
- Coppola, G., Pierelli, F., Schoenen, J. (2007). Is the cerebral cortex hyperexcitable or hyperresponsive in migraine? Cephalalgia, 27, 1427-1439. [CrossRef] [PubMed] [Google Scholar]
- Craig, A.D. (2005). Forebrain emotional asymmetry: a neuroanatomical basis? Trends Cogn Sci, 9, 566-571. [CrossRef] [PubMed] [Google Scholar]
- Critchley, H.D., Mathias, C.J., Dolan, R.J. (2001). Neuroanatomical basis for first- and second-order representations of bodily states. Nat Neurosci, 4, 207-212. [CrossRef] [PubMed] [Google Scholar]
- Danziger, N., Willer, J.C. (2005). Tension-type headache as the unique pain experience of a patient with congenital insensitivity to pain. Pain, 117, 478-483. [CrossRef] [PubMed] [Google Scholar]
- De Broucker, T., Cesaro, P., Willer, J.C., Le Bars, D. (1990). Diffuse noxious inhibitory controls in man. Involvement of the spinoreticular tract. Brain, 113, 1223-1234. [CrossRef] [PubMed] [Google Scholar]
- Denuelle, M., Fabre, N., Payoux, P., Chollet, F., Géraud, G. (2007). Hypothalamic activation in spontaneous migraine attacks. Headache, 47, 1418-1426. [PubMed] [Google Scholar]
- Deschênes, M., Veinante, P., Zhang, ZW. (1998). The organization of corticothalamic projections: reciprocity versus parity. Brain Res Rev, 28, 286-308. [CrossRef] [PubMed] [Google Scholar]
- Duncan, G.H., Bushnell, M.C., Bates, R., Dubner, R. (1987). Task-related responses of monkey medullary dorsal horn neurons. J Neurophysiol, 57, 289-310. [CrossRef] [PubMed] [Google Scholar]
- Eikermann-Haerter, K., Yuzawa, I., Dilekoz, E., Joutel, A., Moskowitz, M.A., Ayata, C. (2001). CADASIL mutations increase susceptibility to spreading depression. Ann Neurol, 69, 413-418. [Google Scholar]
- Garcia Larrea, L., Bastuji, H. (2018). Pain and consciousness. Prog Neuropsychopharmacol Biol Psychiatry, 87, 193-199. [CrossRef] [PubMed] [Google Scholar]
- Gauriau, C., Bernard, JF. (2004). A comparative reappraisal of projections from the superficial laminae of the dorsal horn in the rat: the forebrain. J Comp Neurol, 468, 24-56. [PubMed] [Google Scholar]
- Giffin, N.J., Ruggiero, L., Lipton, R.B., Silberstein, S.D., Tvedskov, J.F., Olesen, J., Altman, J., Goadsby, P.J., Macrae, A. (2003). Premonitory symptoms in migraine: an electronic diary study. Neurology, 60, 935-940. [Google Scholar]
- Goadsby, P.J., Lipton, R.B. (1997). A review of paroxysmal hemicranias, SUNCT syndrome and other short-lasting headaches with autonomic feature, including new cases. Brain, 120, 193-209. [CrossRef] [PubMed] [Google Scholar]
- Krupa, D.J., Ghazanfar, A.A., Nicolelis, MA. (1999). Immediate thalamic sensory plasticity depends on corticothalamic feedback. Proc Natl Acad Sci USA, 9, 8200-8205. [CrossRef] [Google Scholar]
- Léonard, G., Goffaux, Mathieu, D., Blanchard, J., Kenny, B., Marchand, S. (2009). Evidence of descending inhibition deficit in atypical but not classical trigeminal neuralgia. Pain, 147, 217-223. [CrossRef] [PubMed] [Google Scholar]
- Maixner, W., Fillingim, R., Booker, D., Sigurdsson, A. (1995). Sensitivity of patients with painful temporomandibular disorders to experimentally evoked pain. Pain, 63, 341-351. [CrossRef] [PubMed] [Google Scholar]
- Malick, A., Strassman, R.M., Burstein, R. (2000). Trigeminohypothalamic and reticulohypothalamic tract neurons in the upper cervical spinal cord and caudal medulla of the rat. J Neurophysiol, 84, 2078-2112. [CrossRef] [PubMed] [Google Scholar]
- Matharu, M.S., Cohen, A.S., McGonigle, D.J., Ward, N., Frackowiak, R.S., Goadsby, P.J. (2004). Posterior hypothalamic and brainstem activation in hemicrania continua. Headache, 44, 747-761. [CrossRef] [PubMed] [Google Scholar]
- May, A., Bahra, A., Buchel, C, Frackowiak, R.S., Goadsby, P.J. (1998). Hypothalamic activation in cluster headache attacks. Lancet, 352, 275-278. [CrossRef] [PubMed] [Google Scholar]
- Monconduit, L., Lopez-Avila, A., Molat, J.L., Chalus, M., Villanueva, L. (2006). Corticofugal output from the primary somatosensory cortex selectively modulates innocuous and noxious inputs in the rat spinothalamic system. J Neurosci, 26, 8441-8450. [CrossRef] [PubMed] [Google Scholar]
- Mouraux, A., Iannetti, G.D. (2018). The search for pain biomarkers in the human brain. Brain, 141, 3290-3307. [CrossRef] [PubMed] [Google Scholar]
- Noseda, R., Constandil, L., Bourgeais, L., Chalus, M., Villanueva, L. (2010). Changes of meningeal excitability mediated by corticotrigeminal networks: a link for the endogenous modulation of migraine pain. J Neurosci, 30, 14420-14429. [CrossRef] [PubMed] [Google Scholar]
- Okada-Ogawa, A., Porreca, F., Meng, I.D. (2009). Sustained morphine-induced sensitization and loss of diffuse noxious inhibitory controls in dura-sensitive medullary dorsal horn neurons. J Neurosci, 29, 15828-15835. [CrossRef] [PubMed] [Google Scholar]
- Perrotta, A., Serrao, M., Ambrosini, A., Bolla, M., Coppola, G., Sandrini, G., Pierelli, F. (2013). Facilitated temporal processing of pain and defective supraspinal control of pain in cluster headache. Pain, 154, 1325-1332. [CrossRef] [PubMed] [Google Scholar]
- Pielsticker, A., Haag, G., Zaudig, M., Lautenbacher, S. (2005). Impairment of pain inhibition in chronic tension-type headache. Pain, 118, 215-223. [CrossRef] [PubMed] [Google Scholar]
- Pietrobon, D., Moskowitz, M.A. (2013). Pathophysiology of migraine. Annu Rev Physiol, 5, 365-391. [Google Scholar]
- Robert, C., Bourgeais, L., Arreto, C.D., Condes-Lara, M., Noseda, R., Jay, T., Villanueva, L. (2013). Paraventricular hypothalamic regulation of trigeminovascular mechanisms involved in headaches. J Neurosci, 33, 8827-8840. [CrossRef] [PubMed] [Google Scholar]
- Sandrini, G., Rossi, P., Milanov, I., Serrao, M., Cecchini, AP., Nappi, G. (2006). Abnormal modulatory influence of diffuse noxious inhibitory controls in migraine and chronic tension-type headache patients. Cephalalgia, 26, 782-789. [CrossRef] [PubMed] [Google Scholar]
- Simmons, D.M., Swanson, L.W. (2009). Comparison of the spatial distribution of seven types of neuroendocrine neurons in the rat paraventricular nucleus: toward a global 3D model. J Comp Neurol, 516, 423-441. [PubMed] [Google Scholar]
- Smith, J.M., Bradley, D.P, James, M.F., Huang, CL. (2006). Physiological studies of cortical spreading depression. Biol Rev Camb Philos Soc, 81, 457-481. [CrossRef] [PubMed] [Google Scholar]
- van den Maagdenberg, A.M.J.M., Pietrobon, D., Pizzorusso, T., Kaja, S., Broos, L.A.M., Cesetti, T., van de Ven, R.C.G., Tottene, A., van der Kaa, J., Plomp, J.J., Frants, R.R., Ferrari, M.D. (2004). A Cacna 1a knock in migraine mouse model with increased susceptibility to cortical spreading depression. Neuron, 41, 701-710. [CrossRef] [PubMed] [Google Scholar]
- Villanueva, L., Le Bars, D. (1995). The activation of bulbo-spinal controls by peripheral nociceptive inputs: diffuse noxious inhibitory controls. Biol Res, 28, 113-125. [PubMed] [Google Scholar]
- Villanueva, L., Bouhassira, D., Le Bars, D. (1996). The medullary subnucleus reticularis dorsalis (SRD) as a key link in both the transmission and modulation of pain signals. Pain, 67, 231-240. [CrossRef] [PubMed] [Google Scholar]
- Villanueva, L., Fields, H.L. Endogenous central mechanisms of pain modulation. In: L. Villanueva, A.H. Dickenson, H. Ollat (Eds.), Progress in Pain Research and Management, IASP Press, Seattle, 2004 , vol. 31, pp. 223-246. [Google Scholar]
- Villanueva, L., Noseda, R. Trigeminal mechanisms of nociception. In: S.L. McMahon, M. Koltzenburg, I. Tracey, D.C. Turk (Eds.), Wall and Melzack’s Textbook of Pain, 6 ed., Elsevier-Saunders, Philadelphia, 2013, pp. 793-802. [Google Scholar]
- Yarnitsky, D., Granot, M., Granovsky, Y. (2014). Pain modulation profile and pain therapy: between pro- and antinociception. Pain, 155, 663-665. [CrossRef] [PubMed] [Google Scholar]
Citation de l’article : Bourgeais-Rambur, L., Beynac, L., et Villanueva, L. (2019). Mécanismes de régulation cérébrale impliqués dans la crise migraineuse. Biologie Aujourd’hui, 213, 43-49
Liste des figures
 |
Figure 1 La douleur des céphalées serait déclenchée par l’activation des fibres nociceptives méningées appartenant à la branche ophtalmique (V1) du nerf trijumeau. Ces nocicepteurs méningés, dont les corps cellulaires se trouvent dans le ganglion trigéminal (TG), sont localisés autour des vaisseaux sanguins intracrâniens. La branche centrale de ces nocicepteurs active les neurones trigéminovasculaires (dans le noyau Sp5C), qui transfèrent l’information vers des structures bulbaires, thalamiques et corticales. Nous avons montré qu’il existe également une puissante régulation descendante de l’activité des neurones du Sp5C, d’origine bulbaire, hypothalamique et corticale, jouant un rôle clé dans la genèse des céphalées primaires. |
| Dans le texte | |
 |
Figure 2 Schéma des principales voies de régulation centrale des céphalées. Un stimulus nociceptif active des mécanismes de modulation segmentaire et bulbo-trigéminale par lesquels l’influx nociceptif peut être atténué ou augmenté au niveau des neurones trigémino-vasculaires (Sp5C). Les aires corticales (S1, S2, Ins) et hypothalamiques constituent la source principale de modulation descendante car pratiquement l’ensemble des relais nociceptifs du système nerveux central est sous l’influence de ces contrôles. Abréviations : Pyx : décussation pyramidale ; SRD : subnucleus reticularis dorsalis ; RVM : région bulbaire rostro-ventrale médiane ; SSN : noyau salivaire supérieur ; PAG : substance grise périaqueducale ; Ins : cortex insulaire ; S1 : cortex somatosensoriel primaire ; S2 : cortex somatosensoriel secondaire ; 3V : 3e ventricule. |
| Dans le texte | |
 |
Figure 3 Les mécanismes de comorbidité à l’origine de nombreux syndromes douloureux chroniques associés à l’anxiété et à la dépression restent mal connus. Nous avons établi un lien direct entre le dysfonctionnement du noyau hypothalamique paraventriculaire (PVN) – région clé de la régulation autonome et hormonale de l’axe du stress – et le déclenchement des céphalées primaires. En effet, le PVN est la seule région hypothalamique qui régule simultanément l’excitabilité des neurones trigéminovasculaires (Sp5C) et l’activité d’une région bulbaire, le noyau salivaire supérieur (SSN), responsable de la régulation autonome, via le ganglion sphénopalatin, du tonus des vaisseaux sanguins méningés porteurs de nocicepteurs dans leur paroi. |
| Dans le texte | |
 |
Figure 4 Modulation corticofuge directe des neurones trigéminovasculaires (Sp5C) qui véhiculent les messages nociceptifs des nocicepteurs méningés aux régions cérébrales impliquées dans le déclenchement des migraines. Nos études ont mis en évidence une régulation cortico-trigéminale excitatrice et inhibitrice sur le Sp5C, à partir des projections controlatérales issues respectivement du cortex S1 et du cortex insulaire. Ces projections corticales descendantes sont confinées dans la région ophtalmique du Sp5C, qui reçoit les afférences nociceptives méningées. La dépression corticale propagée (CSD) déclenchée à partir du cortex visuel primaire (V1) provoque d’abord une inhibition, suivie d’une amplification des décharges des neurones du Sp5C évoquées par la stimulation des méninges, tandis que les réponses évoquées par stimulation cutanée ne sont pas affectées. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


